丙泊酚对转化生长因子-β1诱导肝星状细胞激活的影响及其机制*
张倩璐,旷 昕
(南华大学附属第一医院麻醉科,湖南 衡阳 421001)
肝纤维化(hepatic fibrosis, HF)是慢性肝脏疾病共同的病理特征,其主要的病理学特点包括肝脏组织内结缔组织和纤维组织的大量增生,细胞外基质合成大于分解,细胞外基质大量沉积,肝脏正常结构被破坏和纤维结节形成等[1]。HF的发病机制复杂至今尚未阐明清楚,研究发现肝星状细胞(hepatic stellate cells, HSCs)的激活是HF形成的初始环节,在HF的发展进程中发挥十分关键的作用[2]。参与HF形成的细胞外基质主要来源于肝星状细胞,转化生长因子β 1(transforming growth factor β1, TGF-β1)是导致HSCs激活的重要因素,激活的HSCs也可大量分泌TGF-β1,形成恶性循环,最终导致HF的发生[3]。丙泊酚是目前主要的静脉注射麻醉药,其作用机制目前认为是激活γ氨基丁酸(gamma aminobutyric acid, GABA)受体-氯离子复合物而发挥效应[4]。丙泊酚具有诱导期短,起效快,苏醒时间短,术后出现消化道副作用小等优点,被广泛用于麻醉诱导和维持等[5]。研究显示丙泊酚具有肝脏保护作用[6-7],但其机制不清。因此该研究拟观察丙泊酚对TGF-β1诱导的肝星状细胞系HSC2-T6细胞激活的影响,并从哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)-自噬途径的角度探讨丙泊酚抑制肝星状细胞的可能机制。
1 材料与方法
1.1 材料
鼠肝星状细胞系HSC2-T6细胞(上海佳和生物科技有限公司)、DMEM培养基(美国Invitrogen公司)、小牛血清(中国杭州四季青公司)、转化生长因子β1(transforming growth factor beta 1, TGF-β1)(美国Pedro Tech公司)、丙泊酚(propofol)、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT)和雷帕霉素(美国Sigma公司)、兔抗鼠α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)、Beclin 1、p62/SQSTM1、微管相关蛋白1轻链3A/B(microtubule-associated protein light chain-3 A/B, LC3 A/B)和GAPDH一抗及相应的二抗(美国Santa Cruz公司)。BCA法蛋白定量试剂盒(美国Pierce公司)。透明质酸(hyaluronic acid, HA)、IV型胶原(collagen IV, IV-C)和层粘连蛋白(laminin, LN)ELISA检测试剂盒(武汉博士德生物工程有限公司)。
1.2 肝星状细胞的培养与分组
将肝星状细胞系HSC2-T6细胞按密度为1×104cells/ml接种在75 cm2的培养瓶中,培养在含小牛血清(10%)的DMEM培养基中。细胞培养在37℃,含5% CO2饱和湿度的培养箱中,每隔一天更换培养液一次。处于对数生长期的HSC2-T6被用于后续的研究。细胞随机地分为以下各组:对照组:用DMEM培养液培养HSC2-T6细胞24 h。TGF-β1组:用含TGF-β1(5 ng/ml)的培养液培养24 h。丙泊酚组:用含丙泊酚(100 μmol/L)的培养液培养24 h。TGF-β1+丙泊酚组:先用含丙泊酚(100 μmol/L)的培养液培养1 h,再加入TGF-β1(5 ng/ml)共同继续培养至24 h。雷帕霉素组:用含雷帕霉素(5 μmol/L)的DMEM培养液培养24 h。TGF-β1+丙泊酚 + 雷帕霉素组:先用含雷帕霉素(5 μmol/L)DMEM培养液培养1 h,用丙泊酚(100 μmol/L)处理1 h,然后再加入TGF-β1(5 ng/ml)继续共同培养至24 h。每组设3个平行孔(n=3)。
1.3 MTT法检测细胞活力
在各处理因素到时间后,往每个细胞培养孔中加入MTT工作液20 μl,再继续孵育4 h。往每个细胞培养孔中再加入150 μl 的DMSO,置于摇床上摇晃振荡,时间定为10 min。设定酶标仪波长至570 nm,然后测量各细胞培养孔的吸光度。MTT法用来检测细胞活力的变化。
1.4 ELISA法检测细胞培养液上清中HA、IV-C和LN的浓度
在各处理到时间后,吸出培养液,1 000 r/min离心10 min,收集上清。按照试剂盒的说明开展实验操作,根据标准曲线计算出细胞培养液上清中HA、IV-C和LN的浓度。ELISA法用来检测细胞培养液上清中HA、IV-C和LN浓度的变化。
1.5 透射电镜检测 HSC2-T6细胞中自噬体等超微结构
胰酶消化后,收集HSC2-T6细胞,加PBS清洗制成细胞悬液,3 000 r/min,离心5 min,弃上清,收集细胞沉淀。将细胞沉淀加入到戊二醛(2.5%)和锇酸(1.9%)溶液中完成双重固定。用不同浓度的丙酮溶液对细胞团进行逐级脱水。用树脂包埋细胞团。切片时切片厚度设定为50 nm,切片机进行超薄切片。用柠檬酸铅醋酸铀溶液进行双重染色。在透射电镜(H-7500型)下进行观察,并拍照保存结果。透射电镜检测用来观察HSC2-T6细胞中自噬体形成等超微结构的变化。
1.6 Western blot检测α-SMA、Beclin-1、LC-3、p62、mTOR和p-mTOR蛋白的表达
提取各实验组细胞的总蛋白。采用BCA法测定样本的蛋白浓度。总蛋白样本加入加样缓冲液中,煮沸充分变性蛋白质。采用聚丙烯酰胺凝胶电泳的办法将已变性蛋白分离,通过电转移的办法将蛋白质转至聚偏氟乙烯(polyvinyl fluoride, PVDF)膜上。为了将非特异性抗原封闭通过脱脂牛奶(5%)在室温下孵育PVDF膜2 h。加入鼠抗兔α-SMA(1∶500)、Beclin-1(1∶400)、LC-3(1∶300)、p62(1∶400)、mTOR(1∶400)、p-mTOR(1∶200)和GAPDH(1∶400)的一抗,4℃过夜。采用Tris-盐酸缓冲盐溶液清洗PVDF膜3次,然后加入二抗,继续在4℃条件下孵育4 h,再通过Tris-盐酸缓冲盐溶液清洗PVDF膜3次。经曝光、显影、定影后,通过图像分析软件对胶片进行扫描,以GAPDH作为内参照,对目的蛋白的表达水平进行半定量分析。Western blot检测用来观察α-SMA、Beclin-1、LC-3、p62、mTOR和p-mTOR蛋白表达的变化。
1.7 统计学处理
2 结果
2.1 丙泊酚和TGF-β1(5 ng/ml)对HSC2-T6细胞增殖的影响
结果如表1所示:TGF-β1组细胞中OD值较对照组显著性增加(P<0.05);丙泊酚+TGF-β1组OD值与TGF-β1组比较显著性降低(P<0.05)。与对照组比较,丙泊酚组OD值没有显著性差异(P> 0.05)。
Tab. 1 Effects of propofol on the cell proliferation, secretion of extracellular matrix induced and activation of hepatic stellate cells by TGF-β1 in HSC2-T6 cells n=3)
2.2 丙泊酚对TGF-β1诱导的肝星状细胞活化的影响
结果如图1-A和表1所示:TGF-β1组细胞中α-SMA蛋白的表达水平较对照组显著性上调(P< 0.05);丙泊酚+TGF-β1组细胞中α-SMA蛋白的表达水平与TGF-β1组比较显著性下调(P<0.05)。与对照组比较,丙泊酚组细胞中α-SMA蛋白的表达水平没有显著性差异(P>0.05)。分泌细胞外基质是肝星状细胞激活的重要特征,因此进一步采用ELISA法测量培养液上清液中HA、IV-C和LN的浓度。结果如表1所示:TGF-β1组培养液上清中HA、IV-C和LN的浓度与对照组比较均明显增加(P均<0.05);丙泊酚+TGF-β1组培养液上清中HA、IV-C和LN的浓度与TGF-β1组比较均明显降低(P均<0.05)。与对照组比较,丙泊酚组细胞中培养液上清中HA、IV-C和LN的浓度均没有显著性差异(P均>0.05)。
2.3 丙泊酚对TGFβ1诱导的肝星状细胞自噬水平的影响
结果如图1-B所示:对照组的HSC2-T6细胞中偶尔可见自噬体。TGF-β1组HSC2-T6细胞中自噬体与对照组相比较明显增加(黑色箭头所示)。丙泊酚+ TGF-β1组HSC2-T6细胞中自噬体与TGF-β1组比较均明显减少。丙泊酚组HSC2-T6细胞中偶尔可发现自噬体。
进一步观察了肝星状细胞中自噬相关蛋白表达的变化。结果如图1-C和表2所示:TGF-β1组细胞中Beclin-1和LC3-Ⅱ的蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值较对照组显著性上调,p62的蛋白表达较对照组显著性下调(P均<0.05);丙泊酚+TGF-β1组细胞中Beclin-1和LC3-Ⅱ的蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值与TGF-β1组比较显著性下调,p62的蛋白表达较对照组显著性上调(P均<0.05)。与对照组比较,丙泊酚组细胞中Beclin-1、LC3-Ⅱ和p62的蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值没有显著性差异(P均>0.05)。
2.4 丙泊酚和TGF-β1对肝星状细胞中mTOR和p-mTOR表达的影响
结果如图1-D和表2所示:TGF-β1组细胞中p-mTOR和p-mTOR/mTOR比值较对照组均显著性降低(P均<0.05);丙泊酚+TGF-β1组细胞中p-mTOR和p-mTOR/mTOR比值与TGF-β1组比较均显著性增加(P均<0.05)。mTOR的蛋白表达在对照组、丙泊酚组、TGF-β1组及丙泊酚+TGF-β1组之间没有显著性差异(P>0.05)。
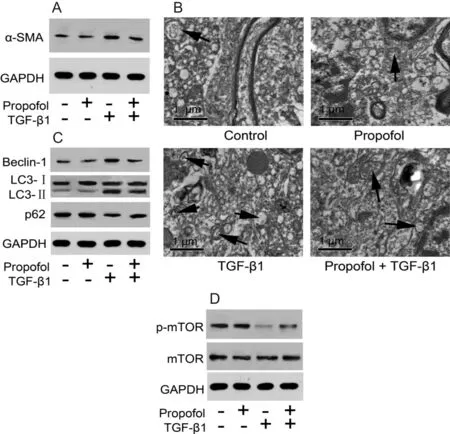
Fig. 1 Effect of propofol on activation of hepatic stellate cells, autophagy and expressions of autophagy-related proteins, expression of mTOR and p-mTOR induced by TGF-β1 in HSC2-T6 cells
2.5 丙泊酚通过mTOR/自噬通路抑制TGF-β1诱导的肝星状细胞的激活
进一步证实mTOR/自噬通路参与丙泊酚抑制由TGF-β1诱导的肝星状细胞的激活,观察mTOR抑制剂(自噬诱导剂)雷帕霉素对丙泊酚作用的影响。结果如图2所示:与对照组比较,雷帕霉素组细胞中α-SMA蛋白显著性增加(蛋白相对表达量分别为100.00±7.86和154.73±11.56,P﹤0.05)。与丙泊酚+TGF-β1组比较,丙泊酚+TGF-β1+雷帕霉素组细胞中α-SMA蛋白显著性增加(蛋白相对表达量分别为132.75±15.84和176.11±17.22,P﹤0.05),提示mTOR抑制剂雷帕霉素部分逆转丙泊酚抑制由TGF-β1诱导的肝星状细胞激活的作用(表2)。
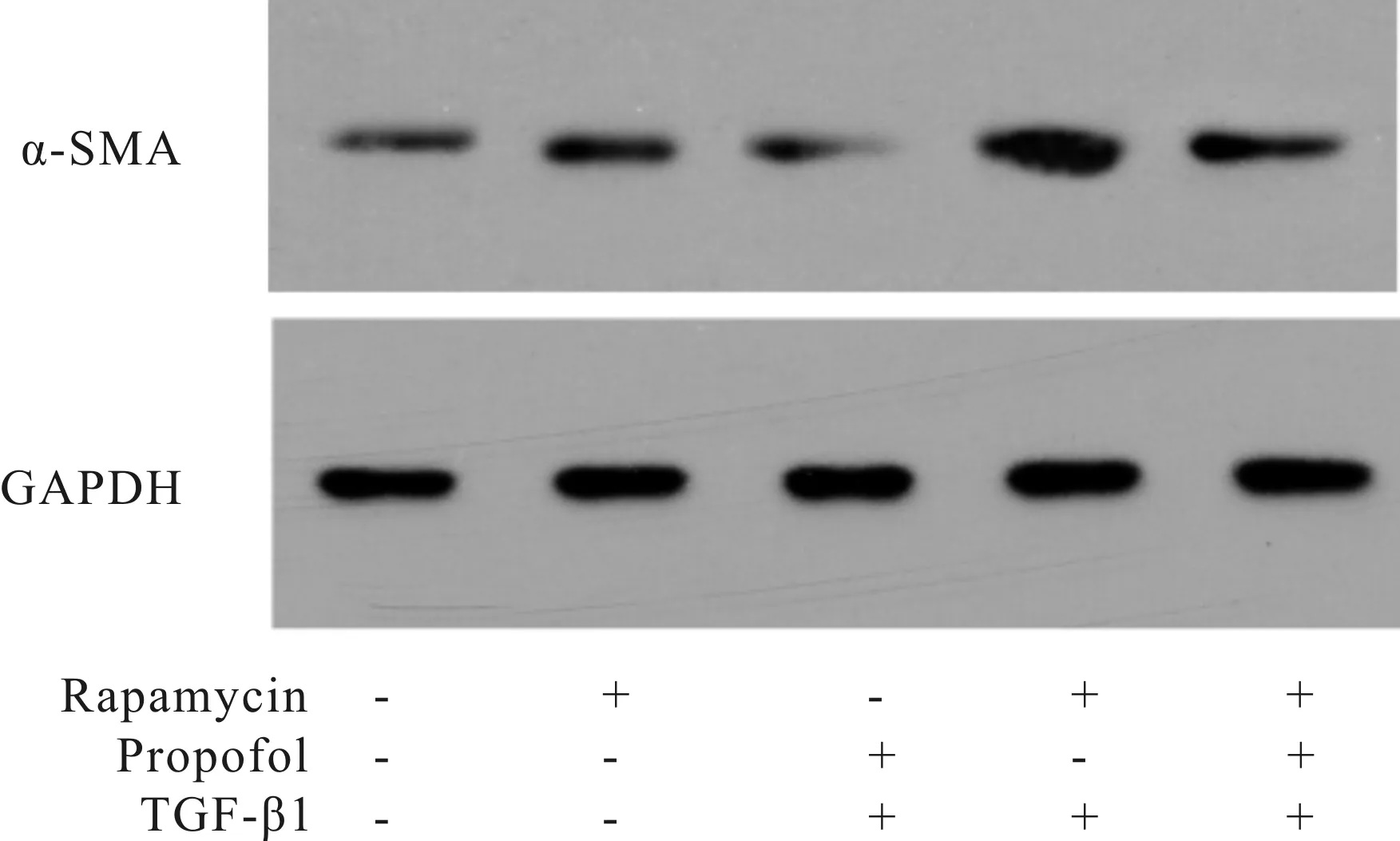
Fig. 2 Rapamycin reverses the inhibitory effect of propofol on the activation of hepatic stellate cells induced by TGF-β1 in HSC2-T6 cells n=3)
3 讨论
丙泊酚是常用的静脉麻醉药,具有起效较快,持续输注后没有蓄积,其代谢受肝功能障碍的影响较小等优点,广泛用于各类手术的临床麻醉。丙泊酚被认为是通过激活抑制性神经递质GABA的受体而发挥麻醉作用,近年来丙泊酚的非麻醉作用备受人们关注,特别是肝脏保护作用。王建珍等研究发现丙泊酚联合瑞芬太尼可以减轻肝硬化大鼠肝脏缺血/再灌注损伤,而其机制与调节Bcl-2和Bax蛋白的表达,减少肝细胞凋亡有关[6]。张虹等的研究也发现丙泊酚可抑制H2O2诱导的人肝细胞LO2的凋亡,而其作用机制可能是通过抑制Bda和Bax的表达实现的[8]。Wei L等研究发现丙泊酚对大鼠肝脏缺血/再灌注损伤具有保护作用,其机制可能是通过PI3K/AKT/mTOR信号通路[9]。本研究的结果显示,TGF-β1处理HSC2-T6 24 h显著增加细胞中α-SMA蛋白的表达、培养液上清中HA、IV-C和LN的浓度,表明TGF-β1诱导HSCs的激活,而给予丙泊酚处理显著抑制TGF-β1诱导的HSC2-T6细胞的激活。因此本研究的结果提示丙泊酚对肝脏的保护作用可能是通过抑制HSCs激活而实现的,同时也表明丙泊酚适用于肝功能有损伤的患者或其他肝脏手术的临床麻醉。
Tab. 2 Effects of propofol on the expressions of autophagy-related proteins, mTOR and p-mTOR of hepatic stellate cells induced by TGF-β1 (%, n=3)
HF是由多种慢性肝损伤因素,如:酒精、毒物和乙肝病毒等长期作用的结果,是各种原因导致的肝病向肝硬化进展的共同病理过程。HSCs的激活是HF发生的核心环节。TGF-β1是引发HSCs激活的重要原因,在HF的发病机制中发挥关键的作用。TGF-β1主要由HSCs本身以及库普弗细胞和肝窦的内皮细胞分泌,通过与HSCs表面的TGF受体结合,激活Smad通路,促进HSCs的激活[10]。激活后的HSCs在细胞形态和功能上都发生较大的变化,转化为肌成纤维细胞,并表达肌原性标志蛋白,如α-SMA等,大量分泌HA、IV-C和LN等细胞外基质[11]。细胞增殖也是HSCs激活的重要特点之一[12]。
自噬是一种通过溶酶体的作用来降解细胞内的错误折叠的蛋白、长寿蛋白质、损伤的细胞器和病原微生物的生物过程,是维持细胞内稳态的重要代谢途径[13]。多种蛋白参与自噬的全过程,在自噬的起始环节发挥关键作用的是Beclin-1,促进自噬体的形成,被认为是自噬体形成的标志物[14]。在自噬被激活后,LC3从胞质型LC3-I转变为结合在自噬体膜上的LC3-II,形成具有双层膜结构的自噬体。因此,Beclin-1和LC3-II的表达水平以及LC3-II/LC3-I的比值常用来反映自噬的水平。在自噬体形成后,p62与LC3-II蛋白相结合形成复合物,并可与选择性底物相互结合,最终会在溶酶体内降解,因此p62被认为是自噬的底物,p62水平的增加通常表示自噬体与溶酶体的结合并最终导致降解的过程受到损伤[15]。mTOR是一种丝氨酸/苏氨酸蛋白激酶,是细胞内整合参与调节自噬相关信号的中枢,是哺乳动物细胞中自噬的主要上游负性调控因子[16]。研究显示肝星状细胞的自噬介导其激活[17-18]。本研究结果显示丙泊酚抑制TGF-β1诱导的HSC2-T6细胞中自噬体数量、Beclin-1和LC3-Ⅱ的蛋白表达及LC3-Ⅱ/LC3-Ⅰ比值的增加,以及p-mTOR蛋白表达、p-mTOR/mTOR比值及p62蛋白表达的降低,而mTOR抑制剂雷帕霉素部分逆转丙泊酚抑制TGF-β1诱导的肝星状细胞激活的作用。以上结果提示丙泊酚抑制TGF-β1诱导的肝星状细胞的激活,其机制可能是通过激活mTOR信号而抑制自噬实现的。目前丙泊酚对自噬的影响较复杂,还存在矛盾的结果。Wang H等研究发现丙泊酚可通过抑制JNK的活化,抑制缺氧/复氧诱导的HK-2细胞自噬[19],这与我们的结果是一致的。但Qiao H等研究发现丙泊酚可诱导神经祖细胞的自噬[20]。这些矛盾的结果可能与细胞的种类不同有关。
总之,本研究结果表明丙泊酚抑制TGF-β1诱导的肝星状细胞的激活,其作用机制可能与丙泊酚激活mTOR信号而抑制自噬有关,为以肝星状细胞的激活为重要基础的HF的防治提供新的思路和策略,也为拓宽丙泊酚的临床应用提供理论和实验依据,也为临床肝硬化和肝炎等肝功能受损患者的麻醉用药提供理论和实验依据。
——雷帕霉素

