长链非编码RNA SNHG16靶向miR-16-5p调控胃癌细胞增殖、凋亡的机制
常利普
(郑州卫生健康职业学院基础教学系,河南 郑州 450005)
胃癌发病率高居世界第二位,死亡率在恶性肿瘤中居第三位〔1,2〕,5年生存率低于50%,且预后较差〔3〕。因此,研究胃癌发生和转移的分子机制,寻找潜在的诊断治疗靶点,已成为胃癌分子诊断和治疗基础研究领域的热点。研究表明,长链非编码RNA(lncRNA)和微小RNA(miRNA)在多种肿瘤组织和细胞中表达异常,参与肿瘤发生发展的全过程〔4~6〕。小核内 RNA 宿主基因(SNHG)16是位于人类 17 号染色体 17q25.1 上的lncRNA,首次发现于神经母细胞中,作为癌基因在神经母细胞瘤中表达上调,与患者不良预后有关〔7〕。后来研究发现,SNHG16 在结直肠癌和膀胱癌中也表达上调,与肿瘤的迁移和侵袭过程密切相关〔8,9〕。SNHG16 在胃癌组织中表达上调,表达水平与胃癌细胞的侵袭有关〔10〕。miRNA在胃癌组织和细胞中作为癌基因或抑癌因子,参与癌细胞的增殖、侵袭、迁移等过程。miR-16-5p在多种肿瘤组织或细胞中表达下调或缺失,与癌细胞的凋亡有关〔11,12〕。胃癌细胞中miR-16-5p表达下调,可以作为胃癌早期筛查和进展评价的潜在标志物〔13〕。miR-16-5p和SNHG16在胃癌增殖凋亡中都具有重要作用,而两者是否存在某种调控关系,尚不清楚。本文拟研究SNHG16 影响胃癌MGC-803细胞增殖、凋亡的分子机制,探寻miR-16-5p在此过程中的作用。
1 材料与方法
1.1材料 人胃癌细胞株MGC-803和人正常胃上皮细胞株GES-1购自ATCC;高糖DMEM培养基和胎牛血清(FBS)购自Gibco公司,牛血清白蛋白(BSA)、胰蛋白酶Trypsin、四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)购自Sigma-Aldrich公司;miR-16-5p mimics(miR-16-5p)、inhibitor(anti-miR-16-5p)、si-SNHG16购自广州锐博生物;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司;Trizol试剂、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)、Lipofectamine 2000转染试剂购自美国Invitrogen公司;流式细胞仪和试剂盒购自美国BD公司;光学显微镜、全自动酶标仪及real-time PCR仪购自美国Bio-Rad公司。
1.2细胞培养 MGC-803细胞用高糖DMEM培养液培养,培养液中添加10% FBS+100 U/ml青霉素+100 μg/ml链霉素,在37℃ 5% CO2培养箱中培养,湿度95%。待细胞生长至对数生长期时,洗涤消化收集细胞进行后续实验。
1.3细胞转染 将培养至对数生长期的MGC-803细胞,用培养液稀释细胞浓度至1×106个/mL,将稀释细胞以200 μl/孔接种于6孔板中,细胞培养至融合度达到80%~90% 时进行转染。用无血清OptiMEM培养液稀释Lipofectamine 2000、si-NC、si-SNHG16、miR-NC、miR-16-5p、pcDNA、pcDNA-SNHG16、si-SNHG16+anti-miR-NC、si-SNHG16+anti-miR-16-5p、WT-SNHG16+miR-NC、WT-SNHG16+miR-16-5p、MUT-SNHG16+miR-NC和MUT-SNHG16+miR-16-5p的载体,之后取等体积原生质体与等体积各组载体混合,轻柔混匀后室温孵育20 min,加入培养好的细胞孔板中,混匀后继续培养,6 h后换成完全培养基,转染48 h后收集细胞进行后续实验。
1.4Real-time PCR检测mRNA表达 将各组转染后的MGC-803细胞培养48 h(si-NC组、si-SNHG16组、miR-NC组、miR-16-5p组、pcDNA组和pcDNA-SNHG16组),Trizol提取总RNA,保存于-80℃。然后按照反转录PCR试剂盒说明书合成cDNA,反应程序为16℃ 30 min、42℃ 45 min、72℃ 5 min;4℃放置10 min,合成的cDNA测定浓度和纯度后-80℃保存。按照 real-time PCR说明书取cDNA进行反应,反应程序为:95℃ 10 min;95℃ 42 s、58℃ 35 s、72℃ 45 s,42个循环;72℃ 10 min。引物如下:miR-16-5p上游:5′-TAGCAGCACGTAAATATTGGCG-3′,下游:5′-TGCGTGTCGTGGAGTC-3′;miR-16-5p mimics(miR-16-5p)序列:5′-UAGCAGCACGUAAAUAUUGGCG-3′,anti-miR-16-5p序列:5′-CACCAAUAUUUACGUGCUGCUA-3′;SNHG16上游:5′-TGTTCGTCATGGGTGTGAAC-3′,下游:5′-ATGGCATGGACTGTGGTCAT-3′;si-SNHG16序列:5′-GGAAUGAA GCAACUGAGAUUU-3′。运用IQ5TM系统(Bio-Rad)进行数据分析。
1.5MTT实验测定细胞活性 转染48 h后,收集MGC-803细胞,Trypsin消化细胞,用培养液调整细胞浓度为1×104个/ml,2×103个细胞/孔接种于96微孔板中,继续培养,分别在24、48、72 h进行 MTT 实验,每孔加入 20 μl(5 mg/ml)MTT,继续培养4 h,弃上清,每孔加入150 μl DMSO,室温振荡5 min,酶标仪测定OD490 nm 处的吸光度(A)值。
1.6流式细胞术检测细胞凋亡率 将转染后的各组MGC-803细胞(si-NC组、miR-16-5p组、si-NC组、si-SNHG16组、miR-16-5p+pcDNA组和miR-16-5p+pcDNA-SNHG16组)培养至对数生长期,接种于6孔板中,继续培养48 h,收集细胞磷酸盐缓冲液(PBS)洗涤2次,根据膜联蛋白V/碘化丙啶(Annexin V/PI)kit说明书操作,用100 μl标记缓冲液重悬细胞,然后加入5 μlAnnexin V-FITC和10 μl PI,室温避光15 min,用流式细胞仪检测分析细胞凋亡率。
1.7双萤光素酶报告系统实验 胰蛋白酶消化转染48 h后的MGC-803细胞,计数,以1×104个细胞/孔接种于24孔板中,继续培养24 h,观察若细胞融合为一层,则进行转染,分别构建SNHG16的野生型(WT-SNHG16)和突变型(MUT-SNHG16)双荧光素酶报告载体,然后分别共转染miR-NC或miR-16-5p,转染后培养48 h,收集细胞,加入裂解缓冲液,室温裂解20 min,离心收集上清,加入荧光素酶底物,发光仪检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
1.8统计学处理 采用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1lncRNA SNHG16和miR-16-5p在胃癌MGC-803细胞和胃上皮GES-1细胞中的表达 qRT-PCR结果表明,与人正常胃上皮细胞GES-1组(0.98±0.09、1.29±0.11)相比,在胃癌细胞MGC-803组中SNHG16的表达量(2.04±0.17)显著升高(P<0.05),而miR-16-5p的表达量(0.56±0.06)显著下降(P<0.05)。
2.2抑制SNHG16表达可抑制胃癌MGC-803细胞增殖 qRT-PCR结果表明,与si-NC组(1.92±0.18)相比,si-SNHG16组SNHG16表达量(0.63±0.09)显著下降(P<0.05)。MTT实验结果表明,与si-NC组相比,si-SNHG16组细胞活性(OD 490 nm)在48 h、72 h均显著下降(P<0.05),见图1。
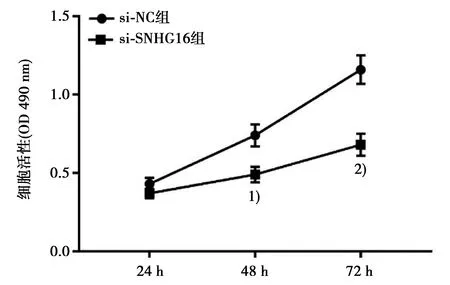
与si-NC组比较:1)P<0.05,2)P<0.01
2.3抑制SNHG16表达可促进胃癌MGC-803细胞凋亡 流式细胞术结果表明,与si-NC组(7.61%±1.13%)相比,si-SNHG16组MGC-803细胞凋亡率(22.49%±2.01%)显著增加(P<0.05),见图2。
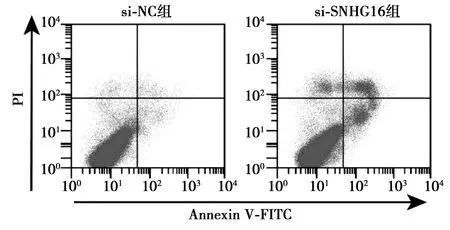
图2 抑制SNHG16表达对胃癌MGC-803细胞凋亡的影响
2.4SNHG16靶向调控miR-16-5p的表达 Targetscan软件预测结果显示,SNHG16的序列中含有与miR-16-5p互补的核苷酸序列,见图3。双荧光素酶报告系统结果显示,与miR-NC组(1.01±0.09,0.98±0.08)相比,miR-16-5p组野生型WT-SNHG16(0.41±0.06)显著下降(P<0.05),而突变型MUT-SNHG16的萤火虫荧光素酶相对活性(1.03±0.09)没有明显变化(P>0.05)。qRT-PCR结果发现,与pcDNA组(0.54±0.05)相比,pcDNA-SNHG16组miR-16-5p 表达量(0.23±0.02)显著下降(P<0.05);与si-NC组(0.51±0.06)相比,si-SNHG16组miR-16-5p 表达量(1.13±0.08)显著上升(P<0.05)。
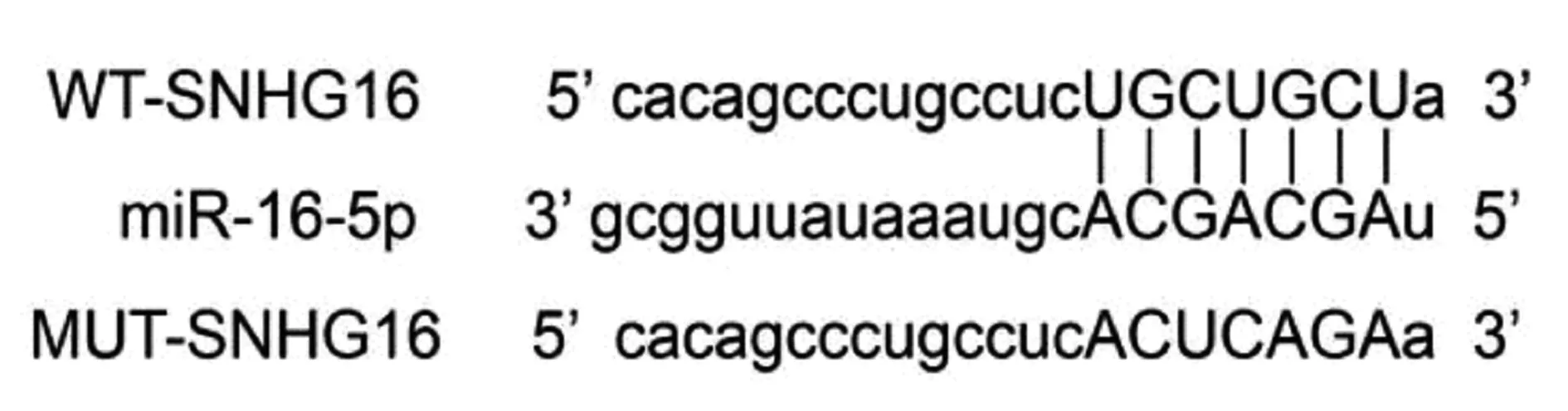
图3 核苷酸序列
2.5miR-16-5p过表达可抑制胃癌MGC-803细胞增殖、促进细胞凋亡 qRT-PCR结果表明,与miR-NC组(0.57±0.07)相比,miR-16-5p组miR-16-5p RNA表达量(1.23±0.11)显著升高(P<0.05)。MTT结果显示,在48 h和72 h时,与miR-NC组相比,miR-16-5p组MGC-803细胞活性显著下降(P<0.05),见图4。流式细胞术结果显示,与miR-NC组(8.13%±0.09%)相比,miR-16-5p组MGC-803凋亡率(19.46%±2.04%)显著升高(P<0.05)。
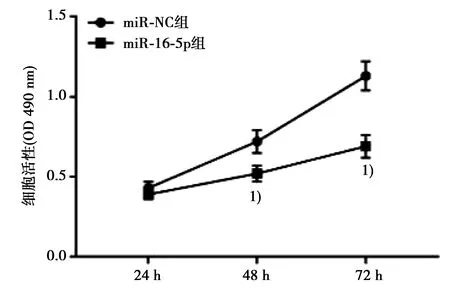
与miR-NC组比较:1)P<0.05
2.6抑制miR-16-5p表达逆转了抑制SNHG16表达对胃癌MGC-803细胞增殖、凋亡的作用 MTT结果显示,在48 h和72 h时,与si-NC组相比,si-SNHG16组MGC-803细胞活性显著下降(P<0.05);与si-SNHG16+anti-miR-NC组相比,si-SNHG16+anti-miR-16-5p组MGC-803细胞活性显著上升(P<0.05),见图5。流式细胞术结果显示,与si-NC组(7.68%±0.83%)相比,si-SNHG16组MGC-803细胞凋亡率(21.49%±2.13%)显著上升(P<0.05);与si-SNHG16+anti-miR-NC组(23.26%±2.11%)相比,si-SNHG16+anti-miR-16-5p组MGC-803细胞凋亡(13.76%±1.57%)率显著下降(P<0.05)。
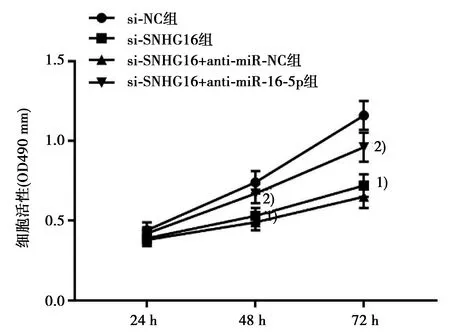
与si-NC组比较:1)P<0.05;与si-SNHG16+anti-miR-NC组比较:2)P<0.05
3 讨 论
胃癌是世界常见的第二大恶性肿瘤,全球每年因胃癌死亡约73万例,超过50%的新发病例发生在发展中国家,中国作为一个人口大国约占40%,癌细胞的转移导致胃癌患者5年生存率低于50%,在欧洲国家,生存率只有10%~30%,只有日本因早期检查和诊断技术的发展胃癌5年生存率达到90%〔14,15〕。因此,研究胃癌的发病和发展机制,为胃癌的诊断和治疗提供新的方向具有重要意义。
研究表明,lncRNA参与多种肿瘤的发生和发展过程,多个lncRNA参与调控胃癌的转移〔16〕。SNHG16于2009年被首次发现于人神经母细胞瘤,在结直肠癌、非小细胞肺癌、乳腺癌等多种肿瘤组织和细胞中出现异常表达,与肿瘤细胞增殖、迁移、侵袭和凋亡等过程关系密切〔17~19〕。Lian等〔20〕研究发现,SNHG16在胃癌组织中表达上调,与侵袭深度、淋巴结转移、TNM分期和组织分化显著相关,抑制SNHG16可抑制胃癌细胞的增殖,减弱其侵袭和迁移,增强细胞凋亡。刘娟娟〔21〕研究表明,下调SNHG16可抑制胃癌AGS细胞增殖、迁移和侵袭,过表达SNHG16则促进胃癌AGS细胞的增殖。本研究结果表明,抑制SNHG16表达可抑制胃癌MGC-803细胞增殖,促进MGC-803细胞凋亡,与相关研究结论一致〔20,21〕。
miR-16-5p是miR-16家族成员之一,miR-16在肿瘤中有抑癌或促癌作用。Zhu等〔22〕发现,褪黑素可通过上调miR-16-5p抑制胃癌细胞的增殖。Ren等〔23〕研究发现,在胃癌组织中,miR-16高表达说明预后良好,具有较长的生存期。本研究结果发现,miR-16-5p在胃癌MGC-803细胞中表达下调,过表达miR-16-5p可抑制胃癌MGC-803细胞增殖,促进细胞凋亡,与上述结果呼应。
本研究发现,SNHG16的序列中含有与miR-16-5p互补的核苷酸序列,预示SNHG16与miR-16-5p之间可能存在结合位点或调控关系。通过双荧光素酶报告系统进一步发现,SNHG16靶向负调控miR-16-5p的表达;抑制miR-16-5p表达则会逆转下调SNHG16表达对MGC-803细胞增殖、凋亡的作用,验证了两者在胃癌中的调控关系。
本研究首次阐述了SNHG16在胃癌MGC-803细胞靶向调控miR-16-5p的表达,影响MGC-803细胞增殖和凋亡,过表达miR-16-5p和抑制SNHG16表达均可抑制MGC-803细胞增殖、促进细胞凋亡,SNHG16有望作为胃癌分子诊断治疗的新靶点。

