长期增施有机肥对土壤不同组分有机磷含量及微生物丰度的影响
王 静,王 磊,张爱君,张 辉,张永春②
(1.江苏省农业科学院农业资源与环境研究所/ 农业农村部江苏耕地保育科学观测站,江苏 南京 210014;2.南京农业大学资源与环境科学学院,江苏 南京 210095;3.江苏徐淮地区徐州农业科学研究所,江苏 徐州 221131)
磷是植物生长所必需的大量营养元素之一。土壤矿物的固定或微生物的固持作用导致植物可直接利用的磷很少。土壤有机磷(Po)是土壤总磷库的主要存在形式,占土壤总磷的30%~80%[1]。但大量有机形态磷如肌醇磷酸盐、磷脂和核酸等不能被直接利用[2],需经过相关微生物矿化分解成无机磷才能被植物吸收。依据Bowman-Cole对有机磷分级体系的改进[3],将土壤有机磷分为活性有机磷、中度活性有机磷、中稳性有机磷和高稳性有机磷。大量研究表明,施肥能影响土壤各组分有机磷含量及其在有机磷中所占比例,施用化肥可促进中稳性和高稳性有机磷向活性和中度活性有机磷转化;而施有机肥显著提高土壤各组分有机磷的初始含量,减少土壤对磷素的固定,从而活化土壤中难溶性有机磷化合物[4]。
微生物在土壤磷素转化过程中发挥着非常重要的作用。已有研究表明,在土壤高C/P比值和N/P比值条件下微生物表现出高度灵活性,并当磷利用率非常低时通过获取和利用有机形态磷供其生长繁殖[5-6]。施用有机肥是提高土壤有机碳和恢复土壤微生物活性和多样性的重要管理措施[7]。有研究表明,土壤微生物在有机磷转化分解过程中对碳的需求高于磷,在充足碳源供给条件下可加快土壤有机磷矿化速率[8-9]。CELESTINA等[10]研究表明,有机肥和无机肥配合施用会改变细菌和真菌的相对丰度,如变形菌门、放线菌门和子囊菌门等。WEI等[11]研究表明,长期增施有机肥显著改变潮土真菌和细菌的相对丰度。也有研究表明某些功能微生物丰度也受施肥措施的影响,LUO等[12]研究发现长期施用有机无机肥能显著增加土壤中携带编码碱性磷酸酶基因的微生物(简称phoD微生物)丰度,而施用无机肥则产生相反的结果。SAKURAI等[13]研究也表明土壤有机碳或外源添加有机物料能影响phoD微生物基因功能的表达。phoD微生物在面临土壤磷素匮乏时,通过诱导上调编码磷酸酶的基因、加强高亲和力的磷酸盐运输器及增加与磷酸盐吸收相关的酶途径,使它们共同构成了磷素胁迫的调节子[14-15],从而影响土壤有机磷的转化过程。而环境因子如气候、土壤类型、pH、土地利用和养分浓度直接影响phoD微生物的丰度、多样性和群落结构[12]。此外,外源有机碳的输入也间接影响phoD微生物丰度[16]。
由于土壤环境因子不同,施肥对土壤phoD微生物和碱性磷酸酶(ALP)的影响尚不明确,目前关于草原土壤或水稻土的研究较多,而对旱-旱轮作体系的研究还鲜见报道。因此,通过小麦-甘薯轮作的田间定位试验,探究不同施肥模式对土壤不同组分有机磷、碱性磷酸酶及微生物的影响,旨在筛选高效转化土壤有机磷的施肥模式,为提高土壤磷的有效性及农业可持续发展提供理论依据。
1 材料与方法
1.1 研究区概况
供试地点位于徐州市农业科学院(34°17′ N,117°09′ E)内的长期肥料定位试验地,海拔为42 m,属温带季风气候区,年均气温为14 ℃,年降水量为800~930 mm,无霜期约为210 d,年日照时数为2 284~2 495 h。土壤类型为黄潮土,质地为砂壤。试验前耕层(0~20 cm)土壤w(有机质)为10.8 g·kg-1,w(全氮)为0.66 g·kg-1,w(全磷)为0.74 g·kg-1,w(速效磷)为12.0 mg·kg-1,w(缓效钾)为738.5 mg·kg-1,pH为8.01,w〔物理性黏粒(< 0.01 mm)〕为141.1 mg·kg-1,w〔黏粒(< 0.02 mm)〕为59.8 mg·kg-1,阳离子交换量为20.4 cmol·kg-1。
1.2 试验设计
长期施肥定位试验始于1980年,1981—2001年种植模式为小麦-玉米轮作,2002年以后改为小麦-甘薯轮作。试验采用单因素随机区组设计,设4次重复,所设5个处理分别为不施肥(CK)、氮钾肥(NK)、氮磷钾肥(NPK)、单施有机肥(M)和氮磷钾肥+有机肥(NPKM);小区面积为33.6 m2(7 m×4.8 m),人工翻地(20 cm深)。氮、磷、钾肥每年施用量为纯N 300 kg·hm-2,P2O5150 kg·hm-2,K2O 225 kg·hm-2。有机肥为猪粪堆积制腐的厩肥,1981—1985年每年施用量(鲜基)为75 000 kg·hm-2,1985年之后为37 500 kg·hm-2,有机肥平均N含量为6.3 g·kg-1,P2O5含量为5.14 g·kg-1,K2O含量为7.93 g·kg-1,C/N比值为20.3。
1.3 土壤DNA的提取及土壤细菌、真菌和phoD微生物的荧光定量PCR分析
土壤DNA提取利用强力土壤DNA提取试剂盒(QIAGEN laboratories,Carlsbad,CA, Germany)参照其操作说明分别提取土壤样品的总DNA,并通过Nanodrop2000测定A260/A280和A230/A260比值,对提取的DNA进行质量控制后,于超低温(-80 ℃)冰箱中保存。
提取大肠杆菌的DNA作为模板,细菌采用通用引物338F/518R(338F: 5′-ACTCCTACGGGAGGCAGCAG-3′;518R:5′-ATTACCGCGGCTGCTGG-3′);真菌采用通用引物ITS1F/5.8S(ITS1F:5′-TCCGTAGGTGAACCTGCGG-3′;5.8S: 5′-CGCTGCGTTCTTCATCG-3′);phoD微生物采用引物phoD-F733/phoD-R1083(5′-TGGGAYGATCAYGARGT-3′;5′-CTGSGCSAKSACRTTCCA-3′)分别进行PCR扩增[17-18]。随后将PCR产物转化到大肠杆菌中,经蓝白斑筛选后,提取阳性克隆中的质粒构建标准曲线。以TB green为荧光染料使用ABI7500型定量PCR系统(Applied Biosystems,America)进行荧光定量PCR。DNA样品用双蒸水稀释至10 ng·mL-1,每个反应都在96孔PCR板上进行,每个板上都设有3个重复的标线样品、阴性对照和待测样品。标准曲线以目标基因克隆体培养后提取质粒,并依次由108copies·mL-1浓度逐步稀释到10copies·mL-1。定量PCR反应体系为25 μL(TliRNaseH Plus)(TaKaRa):TB©Premix Ex Taq(2×)10 μL,ROX reference Dye Ⅱ(50×)0.5 μL,前端引物1 μL,末端引物1 μL,DNA模板 2.0 μL,ddH2O 10.5 μL。反应步骤如下:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,返回第2步,40个循环;95 ℃ 30 s。扩增产物特异性表现为单一的熔融峰,并且ρ=20 g·L-1的凝胶电泳检测仅为1条条带。根据细菌、真菌和phoD微生物的标准曲线,计算得到土壤样品中细菌、真菌和phoD微生物丰度。
1.4 测定项目与方法
土壤全磷含量采用H2SO4-HClO4消煮-钼锑抗比色法测定[19];土壤有效磷含量采用经0.5 mol·L-1NaHCO3浸提-钼锑抗比色法测定;土壤有机磷含量采用经马福炉高温灼烧后用H2SO4浸提-钼锑抗比色法测定,灼烧与未灼烧差值即为有机磷含量[20]77-78;土壤有机磷(Po)分组采用Bowman-Cole有机磷分组方法[21]测定;土壤碱性磷酸酶(ALP)活性采用磷酸苯二钠比色法测定[22];土壤全氮含量采用半微量开氏法测定;土壤速效钾含量采用1 mol·L-1NH4OAc浸提-火焰光度法测定;有机质含量采用重铬酸钾氧化法测定[20]36-38;土壤pH采用pH计测定,V(水)∶m(土)为5∶1。
1.5 数据处理与统计分析
采用SPSS 20软件分析试验数据。单因素方差分析(one-way ANOVA)配合Duncan检验各处理间均值差异的显著性。
2 结果与分析
2.1 不同施肥处理对土壤理化性质的影响
2018年小麦-甘薯轮作体系中甘薯季不同施肥处理土壤理化性质见表1。

表1 5个处理土壤基本理化性质
与CK处理相比,NPK、M和NPKM处理显著提高土壤全氮、全磷、有机质和速效钾含量(P<0.05),M和NPKM处理显著提高土壤有效磷含量(P<0.05)。其中,全氮、全磷和有机质含量以NPKM处理为最高,有效磷含量以M处理为最高,而速效钾含量以NK处理为最高。与CK处理相比,NPK、M和NPKM处理土壤全氮含量分别增加54.5%、77.9%和109.1%;全磷含量分别增加46.2%、102.6%和166.7%;有机质含量分别提高31.8%、78.5%和103.0%。与CK处理相比,NPK、M和NPKM处理土壤pH显著降低(P<0.05),其降幅分别为0.30、0.35和0.54。
2.2 不同施肥处理对土壤有机磷、有效磷含量和ALP活性的影响
如表2所示,与CK和NK处理相比,M和NPKM处理显著增加土壤有机磷、有效磷含量和ALP活性(P<0.05),且M和NPKM处理有机磷、有效磷含量和ALP活性较高。与CK处理相比,M和NPKM处理土壤有机磷含量分别提高52.3%和34.7%;与NK处理相比,M和NPKM处理土壤有机磷含量分别提高47.8%和30.6%。M和NPKM处理土壤有效磷含量分别为CK处理的34.2和25.3倍,分别为NK处理的31.0和23.0倍。NPK处理土壤有机磷含量低于CK和NK处理,但差异未达显著水平;NPK处理土壤ALP活性显著高于CK和NK处理(P<0.05)。

表2 不同处理土壤有机磷、有效磷含量及碱性磷酸酶活性
2.3 不同施肥处理对土壤不同组分有机磷的影响
如表3所示,中度活性Po是含量最高的土壤有机磷形态,其后依次为高稳性Po、活性Po和中稳性Po。与CK和NK处理相比,NPK、M和NPKM处理土壤活性Po、中度活性Po和高稳性Po含量显著增加,且以M和NPKM处理为较高。与CK处理相比,NPK处理活性Po、中度活性Po、中稳性Po和高稳性Po含量分别提高90.1%、10.6%、5.8%和56.7%,M处理活性Po、中度活性Po、中稳性Po和高稳性Po含量分别提高226.7%、17.9%、55.5%和271.0%;NPKM处理活性Po、中度活性Po、中稳性Po和高稳性Po含量分别提高95.2%、19.2%、84.5%和204.7%。
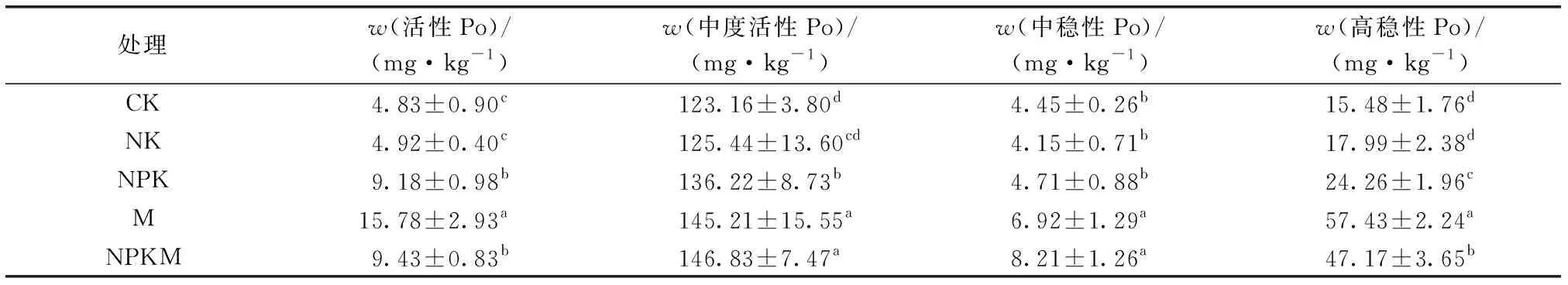
表3 不同施肥处理土壤不同组分有机磷含量
2.4 不同施肥处理对细菌、真菌和phoD微生物丰度的影响
如表4所示,土壤细菌16S rRNA基因、真菌18S rRNA基因和phoD基因丰度变化范围分别为4.1×109~2.3×1010、3.5×106~2.1×107和6.8×107~5.8×108copies·g-1。与CK处理相比,NK、NPK、M和NPKM处理土壤细菌和真菌丰度显著增加,其丰度以M和NPKM处理为较高。M和NPKM处理phoD微生物丰度显著高于CK、NK和NPK处理,其中,CK处理显著高于NK处理,但与NPK处理之间差异未达显著水平。因此,施肥能显著改变土壤细菌、真菌和phoD微生物丰度,尤其是施用有机肥。
2.5 土壤有机磷、有效磷含量、ALP活性和phoD微生物丰度的相关性
土壤有机磷、有效磷含量,ALP活性和phoD微生物丰度的关系见图1,土壤有效磷含量与phoD微生物丰度呈显著正相关(R2=0.854,P<0.05),ALP活性与土壤有机磷含量呈显著正相关(R2=0.680,P<0.05),phoD微生物丰度与ALP活性呈显著正相关(R2=0.559,P<0.05)。
2.6 phoD微生物丰度、ALP活性与不同组分有机磷的相关性
相关性分析结果(图2)表明phoD微生物丰度与活性Po、中度活性Po、中稳性Po和高稳性Po含量呈显著正相关(P<0.05),不同组分有机磷受phoD微生物丰度影响程度由大到小依次为高稳性Po(R2=0.815)、活性Po(R2=0.671)、中稳性Po(R2=0.628)和中度活性Po(R2=0.529)。
ALP活性与活性Po、中稳性Po和高稳性Po含量呈显著正相关(P<0.05),不同组分有机磷受ALP活性影响程度由大到小依次为高稳性Po(R2=0.858)、活性Po(R2=0.750)、中稳性Po(R2=0.727)和中度活性Po(R2=0.271)。由此可知土壤不同组分有机磷变化与phoD微生物丰度和ALP活性密切相关。

表4 不同处理土壤细菌、真菌和phoD微生物丰度

图1 碱性磷酸酶(ALP)活性、phoD微生物丰度、有机磷和有效磷含量的相关性

C为phoD微生物丰度。
2.7 土壤理化性质与微生物丰度和ALP活性的关系
相关分析结果(表5)表明土壤有机质、全氮、有效磷、有机磷和pH是影响phoD微生物丰度和ALP活性的主要因素。其中,土壤有机质、全氮、有效磷和有机磷含量与细菌、真菌、phoD微生物丰度和ALP活性呈显著正相关(P<0.05或P<0.01);而pH与细菌、真菌丰度和ALP活性呈显著负相关(P<0.05),与phoD微生物丰度相关性未达显著水平。
3 讨论
笔者研究发现增施有机肥显著增加土壤中不同组分有机磷含量,且增加幅度均高于单施化肥。与不施肥处理相比,增施有机肥的土壤活性Po和高稳性Po增幅较大,其后依次为中稳性Po和中度活性Po。尹岩等[23]研究表明施用有机肥显著增加水稻土不同组分有机磷含量,且施用有机肥对其影响程度由大到小依次为高稳性Po、活性Po、中稳性Po和中度活性Po。但AHMED等[24]研究表明水稻土施用有机肥显著增加土壤活性Po、中度活性Po和非活性Po含量,其中,中度活性Po增幅最大。李和生等[25]研究表明,冬小麦根际土壤施用有机肥明显提高土壤有机磷含量,主要提高了中度活性Po和活性Po含量,而非根际土壤主要提高活性Po含量。上述结果不同的原因可能是中度活性Po作为土壤中含量最高的有机磷组分,其转化过程受phoD微生物丰度的影响。土壤增施有机肥有利于中度活性Po向活性Po和稳定性Po转化,其转化速率相对较快,所以土壤活性Po和高稳性Po含量增加量不同。笔者研究中,M处理活性Po含量高于NPKM处理,原因可能是NPKM处理作物产量较高,作物收获后带走较多的有效磷,加速了活性Po的转化,从而导致土壤有效磷含量与M处理相比显著降低。此外,NPKM处理ALP活性明显提高,这有利于土壤活性Po进一步向有效磷转化,所以NPKM处理土壤活性Po积累量较少。笔者研究还发现NPKM处理高稳性Po含量虽显著低于M处理,但NPKM处理土壤中稳性Po和中度活性Po含量却明显提高。这可能是在phoD微生物和酶的共同调控下,NPKM处理高稳性Po向中稳性Po和中度活性Po转化的速率高于M处理,从而导致高稳性Po含量有所下降。综合上述2点结果,NPKM处理土壤活性Po和高稳性Po含量均低于M处理,这也可能是导致NPKM处理土壤总有机磷含量下降的原因。谢林花等[4]研究表明施化肥有利于土壤中稳性Po和高稳性Po向活性Po和中度活性Po转化,而笔者研究表明单施化肥可使部分中稳性Po和中度活性Po向活性Po转化,同时有部分中稳性Po和中度活性Po向高稳性Po累积。以上结果的不同可能是因为单施化肥后phoD微生物丰度下降,而高稳性Po受phoD微生物的影响较大,在phoD微生物丰度降低的条件下不利于高稳性Po转化,进而增加了其累积量。
笔者研究发现土壤增施有机肥可显著增加土壤细菌、真菌、phoD微生物丰度和ALP活性。已有研究表明草地根际土壤中phoD微生物主要来源于细菌,少部分来源于真菌,ALP主要是土壤细菌和真菌的代谢产物[26]。笔者研究发现缺磷处理phoD微生物丰度显著低于不施肥处理,而ALP活性却显著提高,原因可能是在土壤可利用磷含量较低条件下,phoD微生物为获得更多的磷素致使其类群间的竞争更激烈,从而加速其编码蛋白。与不施肥处理相比,土壤施用无机磷肥后phoD微生物丰度虽略有下降,但差异并不显著,这说明添加无机磷肥是影响土壤phoD微生物丰度的因素之一。TAN等[27]研究表明,在草原土壤中长期施用无机磷肥显著增加phoD微生物群落多样性。也有研究表明,草地土壤施用无机磷肥可改变phoD微生物的群落组成[28]。笔者研究发现土壤施用无机磷肥显著增加活性Po、中度活性Po和高稳性Po含量,且不同组分有机磷与phoD微生物丰度呈显著正相关。但与不施肥处理相比,施用无机磷肥处理phoD微生物基因拷贝数有所下降,原因可能是添加无机磷肥在一定程度上可抑制phoD微生物丰度。此外,phoD微生物也受其他因素影响,例如土壤中有机碳含量或外源添加有机物料等,且phoD微生物对碳的需求高于磷。所以在施用无机磷肥土壤中,虽然不同组分有机磷含量显著增加,但施用无机磷肥的土壤phoD微生物丰度并未增加。袁佳慧等[29]研究表明ALP在生物释磷过程中发挥重要作用,而笔者研究也发现活性Po、中稳性Po和高稳性Po含量与ALP活性呈显著正相关。不同组分有机磷受phoD微生物丰度和ALP活性的影响程度由大到小依次均为高稳性Po、活性Po、中稳性Po和中度活性Po。当土壤phoD微生物丰度较高时,更有利于活性Po的转化;当phoD微生物丰度较低时,则有利于高稳性Po的积累。综上所述,一方面,增施有机肥通过增加土壤不同组分有机磷含量,促进土壤总有机磷的积累;另一方面,增施有机肥在不同程度上影响土壤ALP活性和phoD微生物丰度,从而影响各组分有机磷的分配。
笔者研究中增施有机肥显著提高了土壤有效磷含量,且土壤有效磷含量与phoD微生物丰度、ALP活性与有机磷含量以及phoD微生物丰度与ALP活性之间均呈显著正相关。而CHEN等[30]研究发现玉米地土壤施用有机肥后土壤有效磷含量分别与phoD微生物丰度和ALP活性呈显著负相关。出现此结果的原因可能是增施有机肥显著提高土壤有机碳含量,有研究表明phoD微生物在碳源供给充足的情况下有利于增强其繁殖能力,从而加速编码ALP。同时,ALP活性的提高不同程度地影响各组分有机磷含量,有利于土壤活性有机磷向有效磷的转化从而提高土壤有效磷含量。另外,笔者研究发现与单施有机肥处理相比,有机和无机肥配合施用明显提高土壤细菌和真菌丰度,但对phoD微生物丰度存在抑制作用。这可能是由于无机肥料施入土壤后,在养分供应充足的条件下其影响其他微生物的增殖,却抑制了phoD微生物丰度。有研究也发现长期输入无机氮肥增加了土壤养分含量进而抑制phoD微生物丰度和多样性[31]。
许多研究表明土壤理化性质显著影响土壤微生物丰度和酶活性。笔者研究发现土壤有机质含量、pH和全氮含量与细菌、真菌、phoD微生物丰度和ALP活性密切相关。RAGOT等[28]研究表明全氮和pH是细菌、真菌及phoD微生物丰度和群落结构的环境驱动因子。在缺磷条件下向土壤中施氮肥显著增加土壤全氮含量,但显著降低细菌、phoD微生物丰度和ALP活性,并导致土壤酸化。过酸或过碱的土壤均不利于土壤微生物的生长与繁殖,而通过合理的农业措施能有效缓解这种状况。化党领等[32]研究表明与单施化肥处理相比,石灰性土壤施用有机肥会加速土壤pH下降,这有利于改善土壤养分状况,特别是提高磷的有效性,笔者研究结果与之一致。有机肥含有大量有机酸,土壤增施有机肥后更有利于改善石灰性土壤的酸碱度,同时也为微生物提供大量碳源,为微生物参与土壤养分循环过程提供良好条件。
4 结论
在小麦-甘薯轮作土壤中,长期增施有机肥可改善土壤酸碱度和养分状况,提高土壤细菌、真菌、phoD微生物丰度和ALP活性。长期增施有机肥通过提高土壤有机磷和不同组分有机磷含量,增加了土壤有机磷库。土壤不同组分有机磷含量与土壤phoD微生物丰度和ALP活性密切相关,phoD微生物丰度和ALP活性共同调控土壤磷的有效性及有机磷的分配。因此,长期增施有机肥是维持土壤供磷能力和加速土壤有机磷循环转化的土壤管理措施。

