肠功能障碍时间联合感染可能性评分对胰腺坏死组织感染预测价值
杨加鹏,何静妮,张明杰,陈建嘉,田 忠
1.中国医科大学附属盛京医院 第十普通外科,辽宁 沈阳 110000;2.辽阳市中心医院新城医院 普外一科,辽宁 辽阳 111000
急性坏死性胰腺炎(acute necrotizing pancreatitis,ANP)为急性胰腺炎的常见类型,大多可进展为重症急性胰腺炎,特别是在继发胰腺或胰周坏死组织感染(infected pancreatic necrosis,IPN)后,其病死率可达30%[1]。ANP继发IPN的治疗较复杂,与患者的预后密切相关[2]。因此,明确ANP继发感染的高危因素,早期干预,已成为临床工作的重点。感染可能性评分(infection probability sore,IPS)是评价感染的量化指标,可有效地评价患者感染的可能性[3]。有研究显示,早期的肠功能障碍与ANP继发感染有关[4]。因此,本研究旨在探讨持续肠功能障碍时间联合入院时IPS对ANP继发IPN的早期预测作用。现报道如下。
1 资料与方法
1.1 一般资料 选取自2013年1月至2015年12月中国医科大学附属盛京医院收治的132例ANP患者为研究对象。其中,女性41例,男性91例。纳入标准:符合中华医学会外科学分会胰腺外科学组制定的急性胰腺炎诊治指南(2014版)中关于ANP的定义与诊断标准[5]。排除标准:(1)入院即存在腹腔感染者;(2)合并严重的呼吸循环系统疾病;(3)临床资料不全者。
1.2 治疗方法 所有患者经详细检查,对人体重要脏器功能进行评估,充分补液以维持水电解质平衡。胃肠减压、禁食水,应用生长抑素等;予以广谱抗生素治疗,并根据细菌培养药敏结果调整用药方案;在肠外营养的基础上,早期启动肠内营养治疗;对于感染及全身炎症反应进行性加重者行腹腔穿刺引流、连续肾脏替代疗法(continous renal replacement therapy,CRRT)、血液灌流及手术治疗。
1.3 观察指标 (1)一般情况及既往史:年龄、性别、烟酒史、糖尿病及高血压史;(2)实验室检查指标:入院时血常规、肝肾功能及血气分析检查;(3)观察入院时患者的体温、心率、呼吸频率、白细胞计数、CRP等,依据IPS标准[3]分别赋值,计算IPS。见表1。
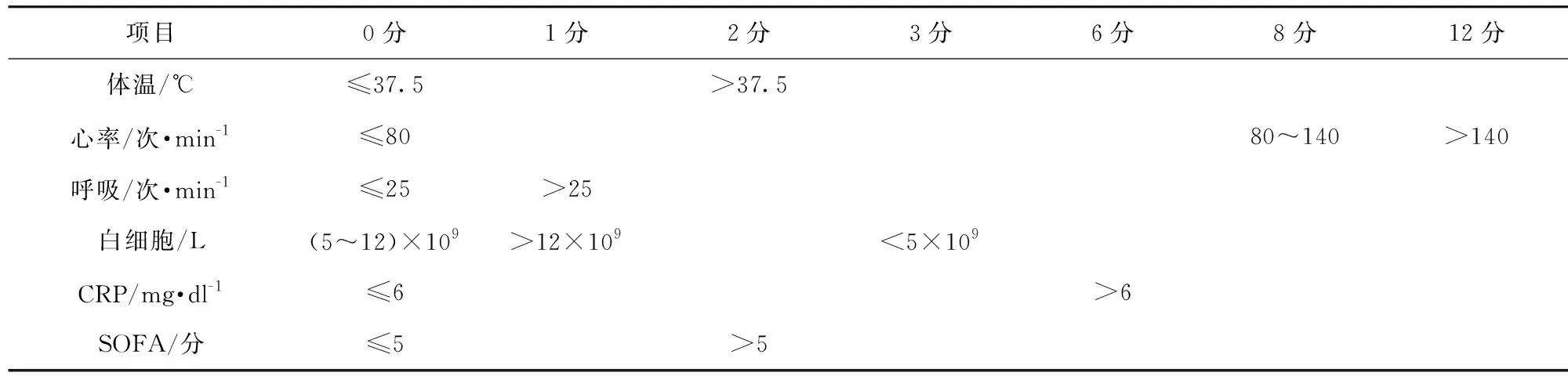
表1 IPS标准
1.4 IPN诊断标准及分组与肠功能障碍的判断 IPN的诊断标准符合以下3项其中2项:(1)腹部增强CT表现为胰腺或胰周坏死区域内存在气体(CT值约为-1 000 HU),即气泡征,根据液体及气体的多少,可形成或不形成气液平[6];(2)腹腔穿刺证实病原菌培养结果阳性;(3)排除泌尿系统、呼吸系统以及胆系感染等其他原因的不明发热(温度>38.5℃)者[7]。根据上述标准将患者分为感染组(n=42)与非感染组(n=90)。肠功能障碍:腹胀、排气排便停止持续时间>24 h者,且符合欧洲危重病协会关于急性胃肠功能损伤的定义[8]。为方便统计,本研究将持续时间≤12 h的部分按0.5 d计算,12 h<时间<1 d的部分按1 d计算。

2 结果
本研究共纳入132例ANP患者。其中,42例继发IPN,其发生率为31.8%(42/132)。在感染的病例中,11例为多重菌感染,其中,7例的血培养和(或)引流液培养中同时见革兰阴性杆菌及阳性球菌;另外4例为革兰阴性杆菌合并真菌感染。而单独感染革兰阴性杆菌和阳性球菌的患者数分别为15例和16例。可见,革兰阴性杆菌仍是ANP患者感染的主要致病菌(26/42),以大肠埃希菌较常见(13/26)。在合并革兰阳性球菌感染的患者中,以屎肠球菌较常见(10/23)。
2.1 ANP继发IPN的单因素分析 将感染患者纳入感染组(n=42),未合并感染患者纳入未感染组(n=90),比较两组患者的一般资料、实验室检查结果、入院时IPS及持续肠功能障碍时间,分析影响ANP继发IPN的危险因素。ANP合并IPN的发生与患者入院时的白细胞、血糖、血钙、AST水平、IPS以及入院后持续肠功能障碍时间密切相关。见表2~3。

表2 两组患者的一般情况比较/例(百分率/%)
2.2 ANP继发IPN的多因素分析 进一步将入院时白细胞、血糖、血钙、AST值、IPS评分以及入院后持续肠功能障碍时间6项指标纳入多因素logistic分析。因上述指标为连续计量资料,取总样本的均值并行适当取整后分层,分别赋值为0和1。结果显示,入院时高IPS评分及入院后持续长时间的肠功能障碍是ANP继发IPN的独立危险因素。见表4。

表4 ANP继发IPN的多因素logistic回归分析
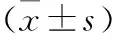
表3 两组患者的实验室检查结果比较
2.3 ROC曲线评价IPS评分、持续肠功能障碍时间及联合因子对ANP继发IPN的预测价值及最佳诊断值获取 通过绘制并分析ROC曲线发现,入院时IPS评分、持续肠功能障碍时间对ANP合并IPN的发生有较好的预测价值,其曲线下面积分别为0.76、0.66,约登指数最大所对应的最佳诊断值分别为12.5、4.75。由此可知,当入院时IPS评分≥13分、入院后持续肠功能障碍时间≥5 d时,ANP继发IPN的可能性最大。而入院时IPS评分联合持续肠功能障碍时间对ANP继发IPN的预测价值更佳,其曲线下面积为0.80。见图1。
3 讨论
ANP病情复杂、个体化差异较大,且起病急、进展快,可合并多种并发症,如IPN及其继发的其他并发症,如腹腔出血、消化道瘘、腹腔脓肿等,病死率可达15%~35%[9]。在赵玉沛院士牵头制定了《急性胰腺炎诊治指南(2014)》[5]后,经过了多中心的研究与实践,对于ANP合并腹腔感染的治疗不再局限在液体复苏、营养支持、生长抑素及质子泵抑制剂等药物治疗,对IPN的外科干预已成为重要的治疗策略[10-12]。针对坏死感染组织的延期外科干预,使治疗效果有了明显改善,但病死率仍可达5%~20%[13-17]。IPN作为ANP后期重要的并发症,是影响预后的主要因素,因此,早期临床识别与干预,对改善预后具有关键作用。
在ANP继发感染的患者中,血源性、胆源性、十二指肠源性及有创操作等均可能是IPN的发生途径[18-20]。ANP患者常存在大量腹腔积液,这种积液有别于急性胰周液体积聚,被称为胰腺炎相关腹腔积液(pancreatitis associated ascitic fluid,PAAF)[21]。这种积液一方面增加腹腔压力形成腹腔内高压(intra-abdominal pressure,IAH)[22],甚至合并腹腔间隔室综合征;另一方面激活炎症因子,参与全身炎症反应[23]。ANP并发IAH时,由于肠道内高压、肠管缺血再灌注损伤及炎症因子的释放,使肠黏膜缺血损伤、肠壁通透性增高,引起肠道屏障功能障碍及肠道运动功能障碍,进而导致肠道菌群异位,增加感染的风险[24-25]。本研究结果显示,入院后持续肠功能障碍时间≥5 d时,ANP继发IPN的可能性最大。因此,在ANP的发病早期应重点关注患者的肠道功能。通过对PAAF引流,减轻腹腔压力,缓解肠管水肿及麻痹性肠梗阻[26];同时,还可以下调炎症因子水平,减轻炎症反应[27]。早期的肠内营养支持可促进胃肠道蠕动,保护肠黏膜屏障[28-30]。此外,益生菌对肠道屏障功能保护的作用亦备受关注,其通过抑制炎症反应、调节肠道微生态等实现对肠道稳态的维护[31-33]。IPS评分是由Peres等[3]根据重症患者的临床资料,筛查出可能的感染性指标而建立的评分系统,近年来多被外科用于预测术后感染等[34-35]。此外,IPS评分所纳入的指标皆为入院常规检查的指标,具有简便、不额外增加检查及患者负担等特点。本研究结果显示,持续肠功能障碍时间联合IPS评分预测ANP继发IPN的效能更佳。ANP常合并多重耐药菌感染,增加治疗难度的同时,延长住院时间,提高病死率,广泛地应用抗生素是其可能的原因之一。因此,早期筛查出感染低风险的患者,可避免联合应用抗生素及长疗程用药[36-37];而对于感染高风险的患者,在明确病原菌后,及时调整治疗方案,逐渐降阶梯用药[38]。
综上所述,持续肠功能障碍时间联合IPS评分对ANP继发IPN有一定的预测作用。但本研究作为回顾性研究是存在局限性的,仅采集患者入院时数据,缺乏连续性,未来将结合患者入院后IPS评分与入院时相比较的动态变化趋势进行分析,以期在病情出现恶化的早期进行预防。另外,本研究为单中心研究,样本量较少,今后要进行多中心的前瞻性研究,以期获得更合适的诊断值,建立更有效的感染早期评估系统。

