免标记比色核酸适配体传感器同步快速检测孔雀石绿和无色孔雀石绿
吴文伟, 王 翌, 刘可鑫, 李天松*, 杨咏洁*
(1. 延边大学农学院, 吉林 延吉 133002; 2. 北华大学理学院, 吉林 吉林 132001)
孔雀石绿(malachite green, MG)属于三苯甲烷类染料。它既是染料,也是杀菌剂,具有较强的抗真菌、抗寄生虫和防腐的功效,曾被广泛用于水产养殖业[1]。然而,MG具有潜在的致畸、致癌和致突变作用[2],现已被世界各国列为水产品养殖禁用药物[3]。无色孔雀石绿(leucomalachite green, LMG)是MG在生物体内的主要代谢还原产物。与MG相比,LMG在体内残留的半衰期更长、毒性更强[4],可作为MG残留检测的主要标志物[5]。然而,MG防霉效果显著,价格低廉,用量少,易得到,致使MG残留的食品安全事件频频发生,这不仅给消费者健康带来了极大的安全隐患,也给我国水产品出口贸易造成了极大的经济损失。
截至目前,MG或LMG的检测方法主要有两大类。一类是仪器分析检测法,包括高效液相色谱法(HPLC)[6]和液相色谱-串联质谱法(LC-MS/MS)[7]。这些方法灵敏且可靠,但样品制备烦琐耗时,仪器昂贵且需要专业的仪器操作人员,难以满足基层现场快速筛查的要求。另一类是快速检测分析法,常见的有酶联免疫吸附法(ELISA)[8]、表面增强拉曼散射免疫测定[9]、胶体金免疫层析法(GICA)[10]和化学发光免疫分析法[11]等。这些方法虽然操作简便,快速,但多数以单克隆抗体为检测探针。单克隆抗体存在制备烦琐、价格昂贵、稳定性差、难以保存和运输等缺点[12]。而且,单克隆抗体只能检测单一指标,无法实现对MG和LMG的同时快速检测。因此,针对该问题,本课题组前期筛选获得了能够同时识别MG和LMG的双特异性核酸适配体aptamer3(A3)。
纳米金(AuNPs)比色核酸适配体传感技术具有操作简单、便携、快速、可视化、无须特殊设备等优点,在食品安全、疾病诊断和环境监测等领域具有广阔的应用前景[13]。目前,该技术已广泛应用于食源性致病菌[14,15]、金属离子[16]、蛋白质[17]和小分子[18]等目标物的快速检测中,但鲜有用于水产品中MG和LMG同步快速检测的研究报道。因此,本研究拟采用核酸适配体A3作为传感探针,以AuNPs为指示载体、NaCl溶液为聚集诱导剂,利用AuNPs的光学特性及核酸适配体的双特异性识别特性,初步构建了一种免标记的AuNPs比色核酸适配体传感器,以期实现水产品中MG和LMG的同步、快速、可视化检测。
1 实验部分
1.1 仪器、试剂与材料
Epoch多功能酶标仪(美国BioTek仪器有限公司); AL104电子分析天平(感量0.01 mg)(瑞士Moettler Toledo公司); TWJR-B调温磁力搅拌器(巩义市科瑞仪器有限公司); VORTEX-5涡旋混合器(海门市其林贝尔仪器有限公司); FS-100T超声波细胞破壁处理器(上海生析超声仪器有限公司); Microfuge 20R低温高速离心机(美国Beckman Coulter仪器有限公司); JEM-1011型透射电镜(TEM,日本JEOL公司)。
MG、LMG、磺胺嘧啶(sulfadiazine, SDZ)、硝基呋喃妥因(nitrofurantoin, NFT)和四氯金酸三水合物(HAuCl4·3H2O)(色谱纯,美国Sigma-Aldrich公司);柠檬酸三钠和制备杜氏磷酸盐缓冲液(DPBS)的药品(分析纯,国药集团化学试剂上海有限公司);核酸适配体序列为本实验室筛选A3∶5′-ATTGGCACTCCACGCATAGGGACGCGAATAG-CGGACCTATGTGTGGTGTGTTACGGCGAGCCTA-TGCGTGCTACCGTGAA-3′(南京金斯瑞生物技术有限公司合成并纯化);实验用鲫鱼为吉林市超市购买;实验用水均为超纯水(电阻率≥18.2 MΩ·cm)。
1.2 AuNPs的合成
采用柠檬酸三钠还原法[13,19]制备纳米金(AuNPs)溶液。用王水浸泡所用玻璃容器过夜,超纯水充分清洗,鼓风干燥箱烘干备用[20,21]。将100 mL 1 mmol/L的HAuCl4·3H2O加入锥形瓶中,在磁力搅拌下维持600 r/min的转速不变。当溶液开始沸腾时,加入10 mL 38.8 mmol/L柠檬酸三钠溶液,当溶液变成酒红色后且颜色不再变化时,继续加热煮沸5 min。冷却后将制备好的AuNPs溶液存放于棕色磨砂瓶中,于4 ℃冰箱内保存。利用多功能酶标仪对所得AuNPs溶液进行光谱扫描,通过透射电镜(TEM)对AuNPs的单分散尺寸的颗粒粒径大小及微观形貌进行表征。
1.3 样品前处理及检测方法
样品的制备参照国家标准[22]和Stead等[23]发表的文献。称取市售鲫鱼5 g,分别与5 mL不同终浓度的MG和LMG标准溶液混合,组织匀浆。然后,利用超声波细胞破壁处理器辅助提取2 min,以8 000 r/min的转速匀浆提取30 s,以4 000 r/min离心5 min,收集上清液,过0.22 μm过滤器,待用。
分别取150 μL AuNPs(终浓度1.25 nmol/L)与50 μL核酸适配体(终浓度150 nmol/L)混合,于室温孵育6 min。随后,取50 μL待测样品加入到检测体系中,继续孵育30 min。最后,再加入50 μL NaCl溶液(终浓度150 mmol/L),室温孵育4 min。观察溶液颜色变化,分别检测MG和LMG在650 nm和520 nm波长处的吸光度(A),并计算吸光度比值A650nm/A520nm[24-27]。
2 结果与讨论
2.1 检测原理
AuNPs比色核酸适配体传感器的检测原理见图1。裸露的AuNPs可被高盐溶液诱导而发生团聚,溶液颜色由红色变蓝色(见图1a)。核酸适配体为单链DNA(ssDNA),可通过静电作用吸附到AuNPs表面,保护AuNPs抑制高盐溶液诱导的聚集,使AuNPs溶液颜色不变(见图1b)。当加入靶标MG、LMG或二者混合物后,核酸适配体能够与靶标特异性结合,并从AuNPs表面解离,AuNPs失去保护作用而在高盐溶液诱导下发生聚集,溶液颜色由红变蓝;而加入非靶标物质时,高盐溶液不会引发颜色变化(见图1c)。
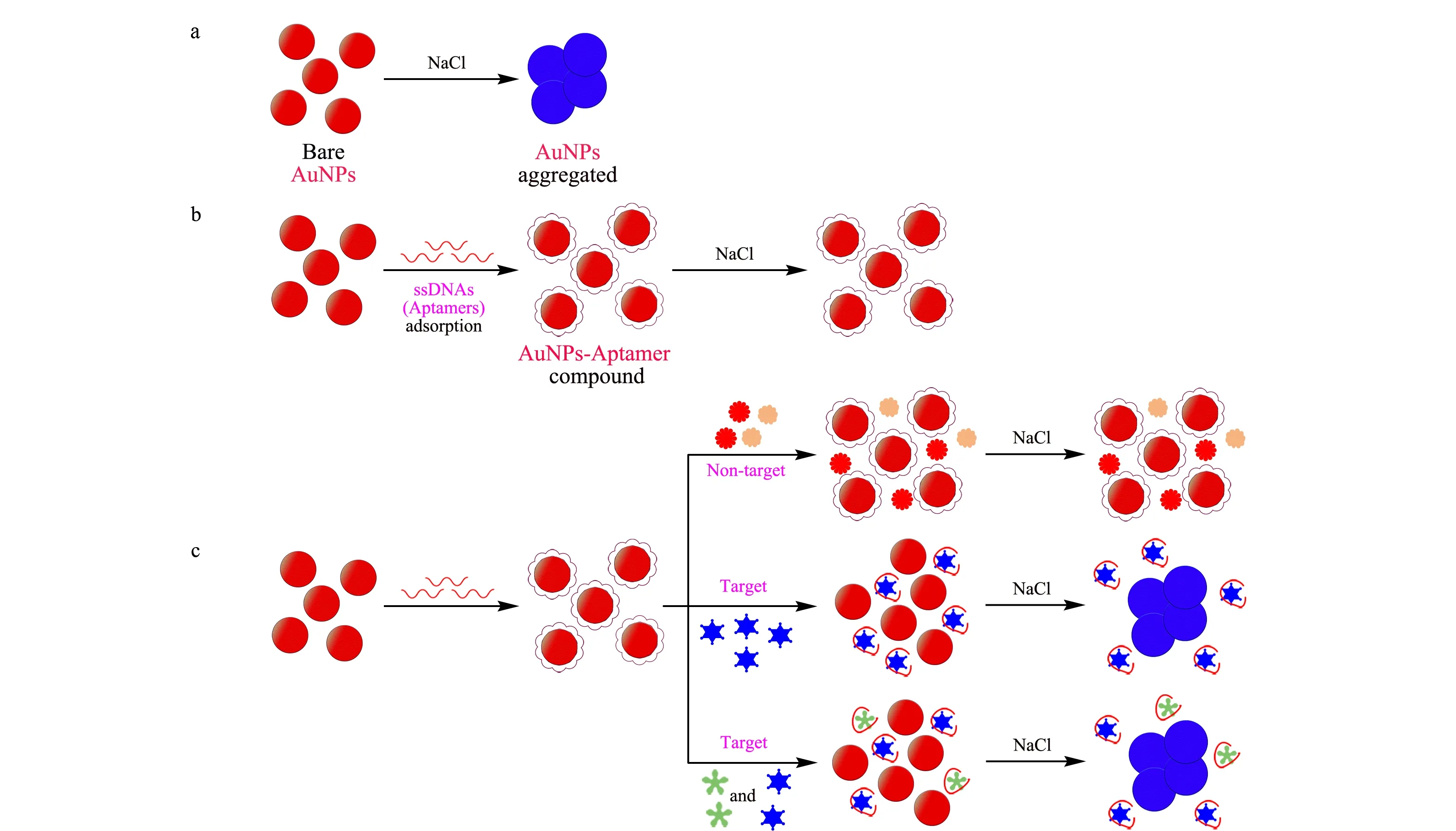
图 1 AuNPs比色核酸适配体传感器检测原理图Fig. 1 Detection schematic illustration of gold nanoparticles (AuNPs) colorimetric aptasensor
2.2 AuNPs的表征
利用紫外可见光谱及透射电镜扫描图谱对AuNPs进行表征,结果见图2。AuNPs溶液呈现稳定的红色且久置无沉淀现象,520 nm波长处有最大吸收峰,吸收峰单一且尖锐(见图2a),表明制备的AuNPs溶液均匀、稳定且粒径均一。利用紫外-可见吸收光谱法(UV-Vis),参考Haiss等[28]发表的文献,测定AuNPs的浓度为2.5 nmol/L。利用TEM扫描AuNPs溶液,结果表明,金纳米颗粒呈球形,大小均一(见图2b),说明制备的AuNPs分散良好。不同的金纳米颗粒对应不同的最大吸收波长,而520 nm波长处对应的金纳米颗粒直径为13 nm[29]。
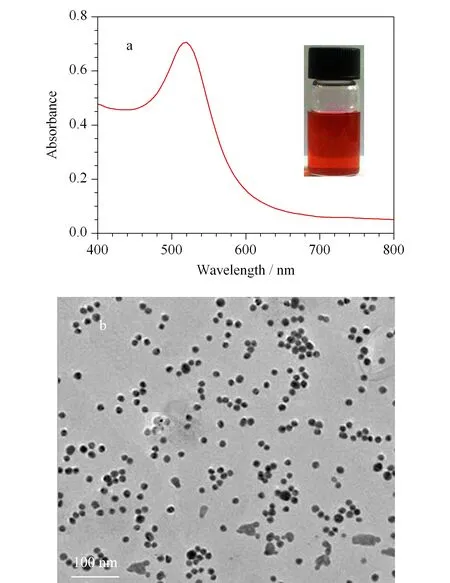
图 2 AuNPs(a)吸收光谱图和(b)TEM扫描照片Fig. 2 (a) Absorption spectrum and (b) transmission electron microscopy (TEM) scanning photo of AuNPs
2.3 AuNPs比色核酸适配体传感器性能的优化
2.3.1NaCl浓度的优化
NaCl溶液作为AuNPs的聚集诱导剂,其用量对AuNPs聚集效果有较大影响。若NaCl浓度过低,则不能使AuNPs完全聚集;若NaCl浓度过高,即使AuNPs表面附着核酸适配体,高浓度的盐也可使AuNPs发生聚集,因此需要优化NaCl溶液的浓度。
分别取50 μL不同浓度的NaCl溶液(终浓度各为0、90、105、120、130、140、150、160、170、180、190、200和210 mmol/L)与150 μL的AuNPs(终浓度1.25 nmol/L)混合,室温孵育4 min,分别扫描400~800 nm波长范围内的吸收光谱,测量650 nm和520 nm的吸光度值,实验平行重复3次。以A650nm/A520nm为纵坐标,以NaCl浓度为横坐标,绘制饱和度曲线图,选择NaCl溶液最佳使用浓度,结果见图3。随着NaCl浓度的增加,AuNPs在520 nm波长处的吸光度值逐渐减小,而在650 nm波长处吸光度值逐渐升高。AuNPs的颜色也由红色逐渐变为紫色甚至灰色(见图3a),表明NaCl引发了AuNPs的聚集,且随着NaCl浓度的增加,AuNPs的聚集程度逐渐增强。因此,选择使AuNPs完全聚集的最低NaCl浓度为最佳使用浓度。由图3b所示,随着NaCl浓度的增加,A650nm/A520nm比值逐渐增高。当NaCl浓度为150 mmol/L时,比值达到最大,之后开始趋于平稳,表明AuNPs聚集完全。因此,选择NaCl最佳使用浓度为150 mmol/L。
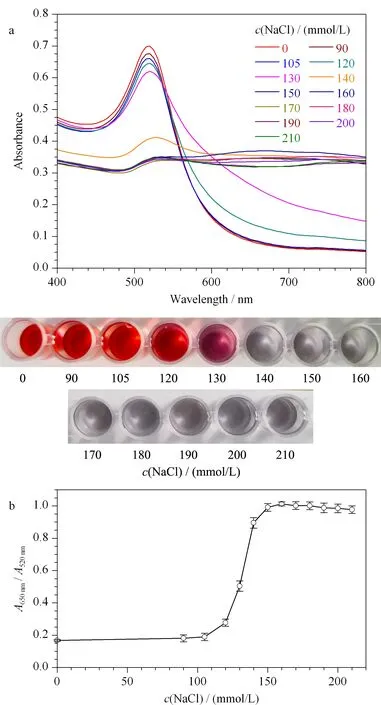
图 3 不同NaCl浓度下AuNPs的(a)吸收光谱图和(b)A650nm/A520nm比值饱和曲线图(n=3)Fig. 3 (a) Absorption spectra and (b) A650nm/A520nmratio saturation curve of AuNPs at the different NaCl concentrations (n=3)
2.3.2核酸适配体浓度的优化
核酸适配体作为靶标的识别元件,其用量对检测结果有很大影响。当核酸适配体浓度过低时,不能完全抑制AuNPs的聚集。因此,无论靶标存在与否,在NaCl作用下均会使AuNPs发生聚集,易产生假阳性结果。当核酸适配体浓度过高时,溶液中游离的核酸适配体先与靶标充分结合,致使吸附在AuNPs表面的核酸适配体无法完全解吸附,导致AuNPs仍被核酸适配体保护而无法聚集,易产生假阴性结果[30]。因此,需要优化核酸适配体使用浓度。
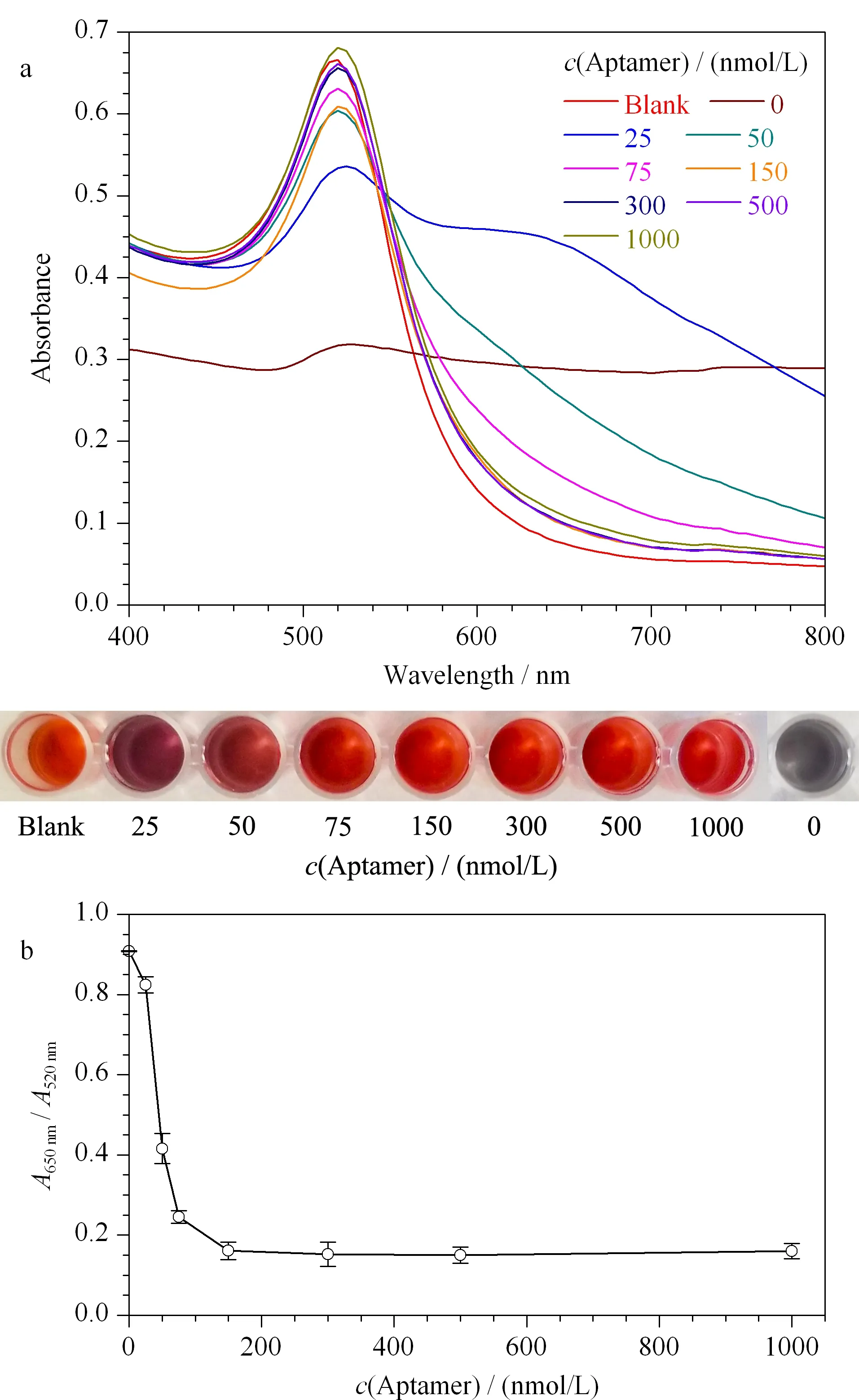
图 4 不同核酸适配体浓度下AuNPs的(a)吸收光谱图和(b)A650nm/A520nm比值饱和曲线图(n=3)Fig. 4 (a) Absorption spectra and (b) A650nm/A520nmratio saturation curve of AuNPs at the different aptamer concentrations (n=3)
分别取50 μL不同浓度的核酸适配体溶液(终浓度各为0、25、50、75、150、300、500和1 000 nmol/L)与150 μL的AuNPs(终浓度1.25 nmol/L)混合,室温孵育6 min。随后,分别加入50 μL NaCl溶液(终浓度150 mmol/L),继续室温孵育4 min。最后,分别扫描400~800 nm波长范围内的吸收光谱,测量650 nm和520 nm的吸光度值,实验平行重复3次。以A650nm/A520nm为纵坐标,以核酸适配体浓度为横坐标,绘制饱和度曲线图,选择核酸适配体最佳使用浓度,结果见图4。随着核酸适配体浓度逐渐增加,AuNPs溶液在520 nm波长处的吸光度值逐渐升高,而在650 nm波长处吸光度值逐渐减小。AuNPs溶液的颜色由紫色逐渐变为红色至不再变化(见图4a)。表明随着核酸适配体浓度的增加,AuNPs的聚集被逐渐抑制。因此,选择AuNPs聚集被完全抑制的最低核酸适配体浓度为最佳使用浓度。由图4b所示,随着核酸适配体浓度的增加,A650nm/A520nm值逐渐减小。当核酸适配体浓度为150 nmol/L时,比值达到最小,之后曲线趋于平稳,表明AuNPs的聚集被完全抑制。因此,选择核酸适配体的最佳使用浓度为150 nmol/L。
2.4 AuNPs比色核酸适配体传感器特异性验证
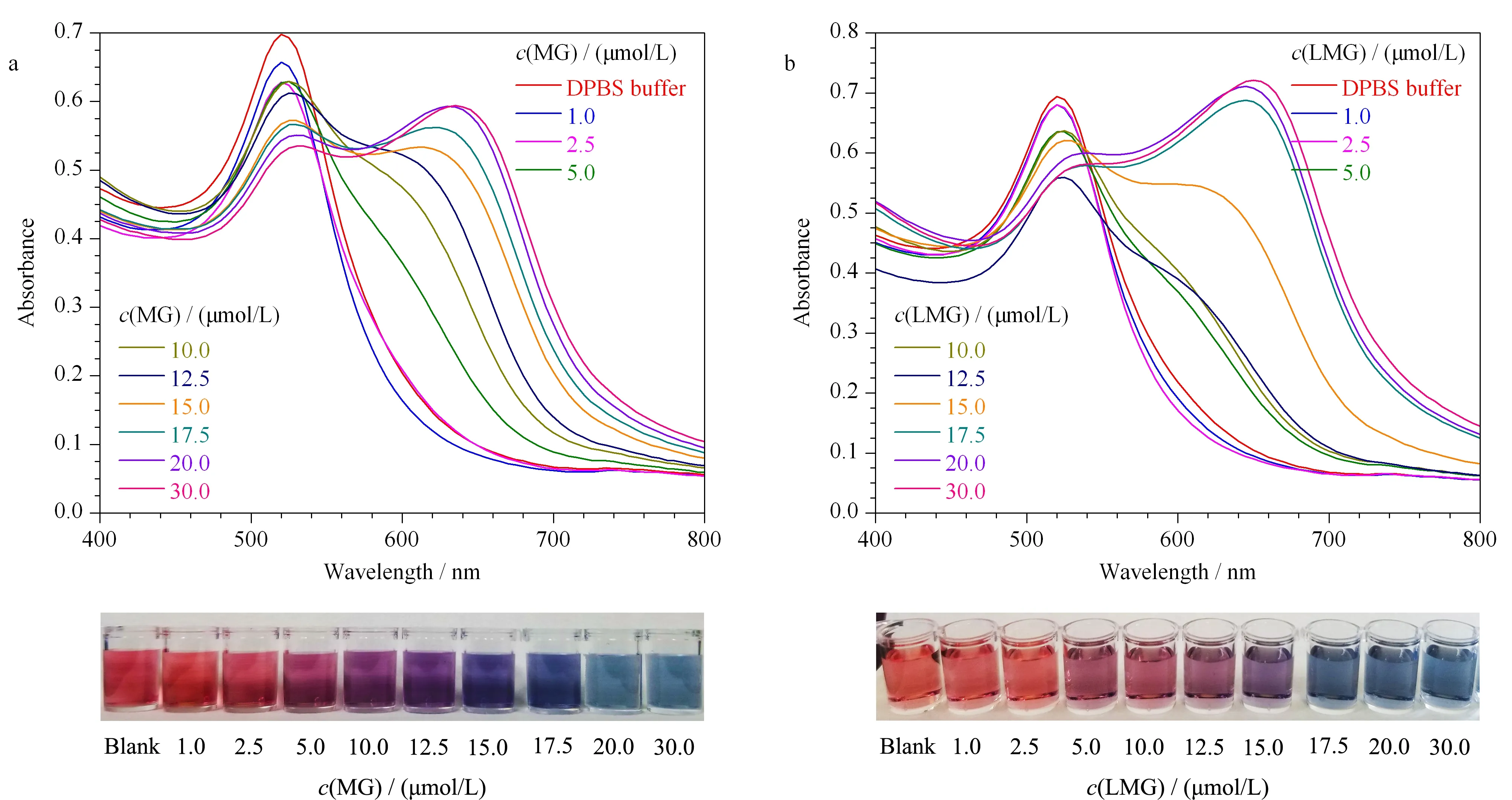
图 6 不同(a)MG和(b)LMG浓度下AuNPs溶液的吸收光谱图Fig. 6 Absorption spectra of AuNPs at different (a) MG or (b) LMG concentrations
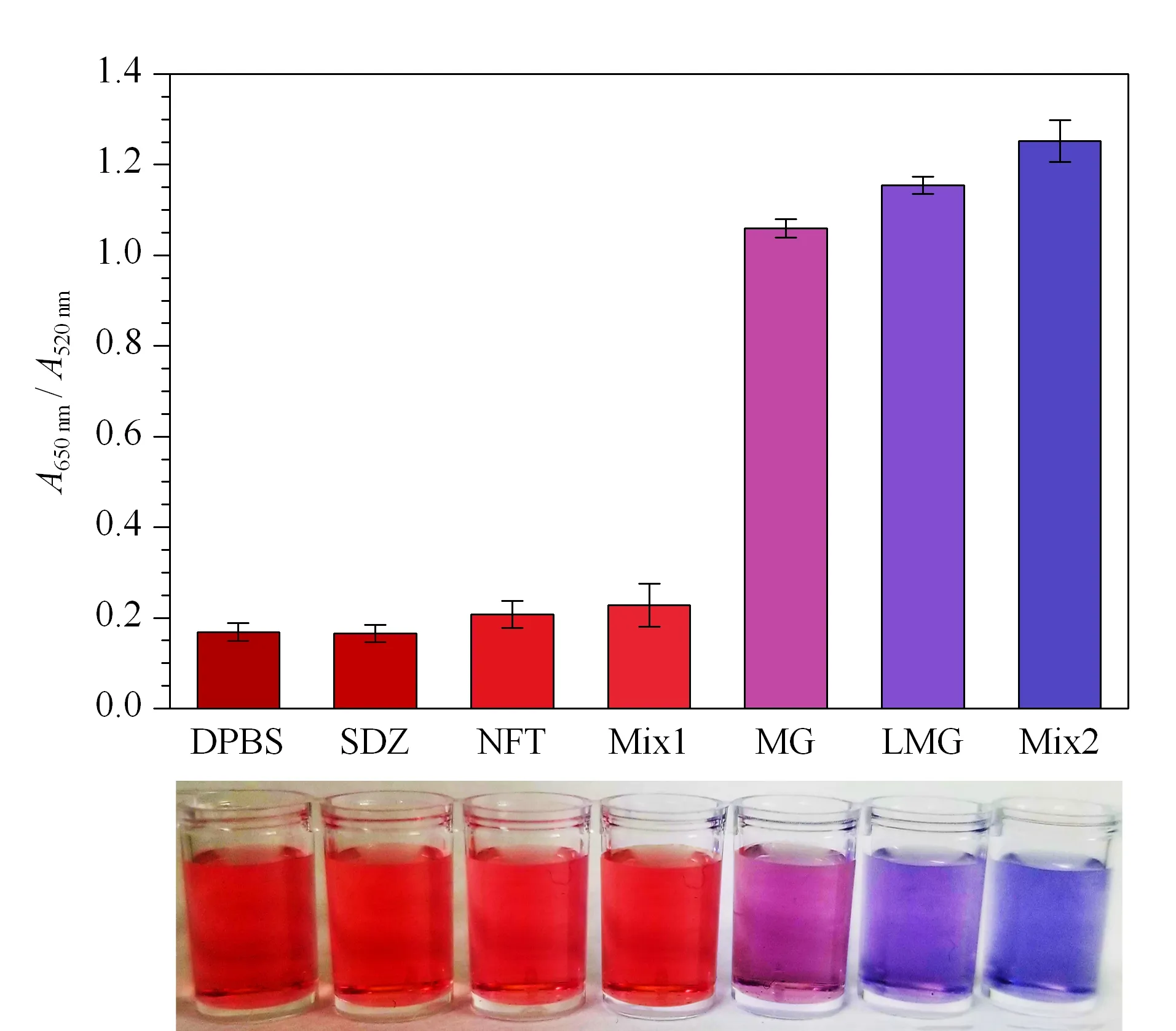
图 5 AuNPs比色核酸适配体传感器特异性检测(n=3)Fig. 5 Specificity tests by AuNPs based colorimetric aptasensor (n=3) DPBS: dulbecco’s phosphate buffered saline (blank group); SDZ: sulfadiazine; NFT: nitrofurantoin; Mix1: SDZ-NFT (1∶1, v/v); MG: malachite green; LMG: leucomalachite green; Mix2: MG-LMG (1∶1, v/v).
考虑到目前水产品养殖中,抗生素滥用情况比较普遍,可能会干扰实际样品的检测。因此,选择水产养殖中两种滥用情况比较普遍的抗生素SDZ和NFT进行特异性验证。同时,分别设置两组混合靶标:Mix1(SDZ-NFT(1∶1, v/v))和Mix2(MG-LMG(1∶1, v/v)),分析靶标或非靶标物质共存时,AuNPs比色核酸适配体传感器的检测性能。即在最优反应条件下,以不同的检测靶标(SDZ、NFT、Mix1、MG、LMG、Mix2)为变量,靶标终浓度均为17.5 μmol/L,考察方法的特异性。结果如图5所示,加入MG或LMG或Mix2时,溶液的颜色由红色变为紫色和蓝色。A650nm/A520nm均明显高于对照组(SDZ、NFT和Mix1)和空白组(DPBS),而空白组和对照组的溶液颜色几乎没有变化。说明该核酸适配体传感器能特异性识别MG和LMG,而对SDZ、NFT及二者混合物没有识别作用。
2.5 AuNPs比色核酸适配体传感器灵敏度测试
在最优反应条件下,以靶标MG、LMG的用量为变量,分别考察其不同终浓度(1.0、2.5、5.0、10.0、12.5、15.0、17.5、20.0、30.0 μmol/L)对AuNPs比色核酸适配体传感器性能的影响。结果如图6a和6b所示,随着MG、LMG浓度的增加,AuNPs溶液颜色均由红色逐渐变成紫色,再变成稳定的蓝色。同时,AuNPs溶液的吸收光谱也发生变化,A650nm值逐渐增加,而A520nm值逐渐降低。这表明随着MG、LMG浓度的增加,吸附在AuNPs表面的核酸适配体逐渐被解吸附,致使AuNPs逐渐失去保护作用而发生聚集。由图7所示,当MG和LMG的浓度在0~17.5 μmol/L范围内,靶标浓度与吸光度比值呈现良好的线性关系,相关系数(R2)分别为0.993 8和0.971 5,线性回归方程分别为y=0.049 65x+0.172 6和y=0.053 96x+0.141 3(y:A650nm/A520nm,x:靶标浓度, μmol/L)。参考已发表文献[24,25,31],根据公式3δ/slope(δ为9个平行空白的标准偏差,slope为线性方程的斜率)确定了MG和LMG最低检出限分别为6.93和6.38 nmol/L,表明该比色核酸适配体传感器对MG和LMG具有较好的检测灵敏度。
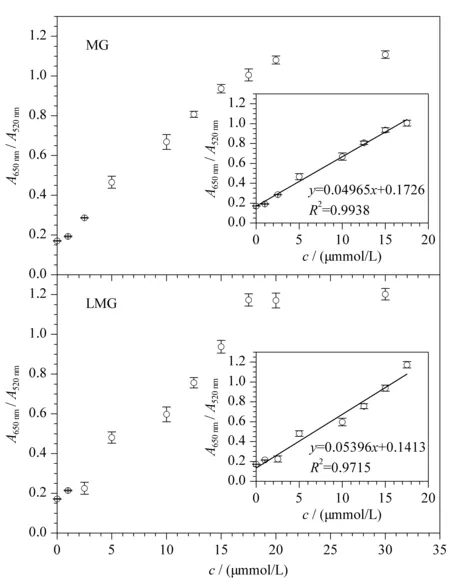
图 7 不同MG和LMG浓度下AuNPs溶液的A650nm/A520nm比值饱和曲线图(n=3)Fig. 7 A650nm/A520nm ratio saturation curves of AuNPs at the different MG or LMG concentrations (n=3)
2.6 加标回收率及精密度
为了评估方法的准确度及精密度,选择鲫鱼样品进行加标回收试验。在鲫鱼样品空白基质中,分别添加3个不同水平的MG及LMG(终浓度5、10和20 μmol/L),每个水平做3次重复,得到的加标回收率及精密度结果见表1。在低、中、高3个不同添加水平下,MG的加标回收率和RSD分别为88.60%~93.30%和2.27%~3.55%; LMG的加标回收率和RSD分别为101.80%~107.00%和2.62%~3.75%。表明该方法的准确度及精密度良好。
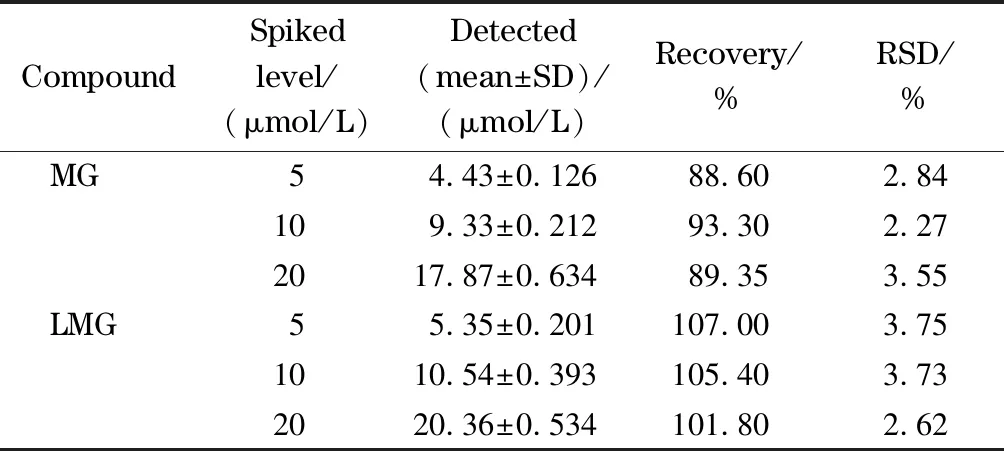
表 1 鲫鱼样品中MG和LMG的加标回收率和RSD(n=3)
Zhao等[32]建立了基于MG-RNA-AuNPs检测水样中MG的方法,其线性范围为0~15 μmol/L,平均回收率为92%~108%,检出限为4 nmol/L。而本研究建立的方法,虽然MG检出限上略高,但能够同时识别MG和LMG,避免了样品前处理中LMG转化为MG的过程,可以大大简化操作步骤。Jia等[33]建立了基于MG-RNA-AuNPs检测鱼样中MG的方法,其线性范围为0~300 nmol/L,平均回收率为96.00%~104.81%,检出限为15.95 nmol/L。而本研究建立的方法,具有更低的检出限和更宽的线性范围。
3 结论
本文采用MG和LMG双特异性核酸适配体作为识别元件,NaCl溶液作为聚集诱导剂,AuNPs作为指示剂,初步建立了一种免标记的比色核酸适配体传感器,可实现水产样品中MG和LMG的同步、快速、可视化检测。该方法能够特异性检出MG和LMG,而对SDZ和NFT无交叉反应。此外,该AuNPs核酸适配体传感器可用于鲫鱼样品中MG和LMG的快速检测,准确度及精密度良好,可为水产品中MG和LMG的同步快速检测提供一种新方法。