lncRNA MAGI2-AS3下调miR-31-5p抑制肺腺癌细胞的增殖、迁移、侵袭并促进凋亡
肺癌是世界上死亡率最高的癌症,是全球公共卫生的主要威胁[1]。过去三十年,中国肺癌的发病率和死亡率上升迅速[2]。大多肺癌确诊时已是晚期,通常采用放化疗等癌症控制方法,但预后较差,近年来靶向治疗的分子抑制剂也在进行临床试验[3]。肺癌的分子抑制靶点,是肺癌分子诊断治疗的研究重点和热点。
长链非编码RNA(long non-coding RNAs,lncRNAs)在肺癌发生、癌细胞增殖、侵袭、转移和预后中具有重要的作用[4],micro RNA(miRNA)的异常表达与肺癌的发生、发展和预后及耐药性密切相关[5]。lncRNA MAGI2-AS3(MAGI2 antisense RNA 3)在乳腺癌和膀胱癌组织中表达下调,与肿瘤的增殖、迁移和侵袭有关[6-7]。研究表明,MAGI2-AS3在非小细胞肺癌肿瘤发生过程中表达水平降低[8],但是对细胞生物行为的作用机制尚不清楚。miR-31-5p在结直肠癌、肝细胞癌、肺癌、膀胱癌和胃癌等癌组织中的表达异常,miR-31可能参与肺癌的发生、发展并与肺癌肿块的大小相关[9]。miR-31在非小细胞肺癌患者血清中表达上调,与肺癌临床诊断和预后有关[10]。本研究的生物信息学预测发现,MAGI2-AS3和miR-31-5p含有互补结合序列。但两者在肿瘤中的关系尚不清楚,而两者作用机制和在肺癌中的关系也不清楚。本研究以人肺癌细胞系A549为研究对象,研究MAGI2-AS3对肺癌的影响,以及miR-31-5p在此机制中的作用。
材料与方法
一、材料
人肺癌细胞株A549和人正常肺细胞株HBE(美国ATCC公司);F12K培养基、牛血清白蛋白(bovine serun albumin,BSA)、胰蛋白酶Trypsin、二甲基亚矾(dimethyl sulfoxide,DMSO)和四氮唑蓝(methyl thiazolyl tetrazolium,MTT)(美国Sigma-Aldrich公司);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);Transwell板(美国Corning公司);双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)(美国Promega公司);Lipofectamine 2000 转染试剂、RNA 提取试剂Trizol、实时荧光定量PCR(qRT-PCR)试剂盒、反转录试剂盒(RTPCR)(美国Invitrogen公司);双染色流式法细胞凋亡检测试剂盒、流式细胞仪(美国BD公司);显微镜、酶标仪及PCR仪(美国Bio-Rad公司)。
二、方法
1.细胞培养:将A549细胞培养于含10﹪FBS、1﹪青-链霉素的F12K培养基中;培养条件:37℃ 5﹪ CO2培养箱,湿度95﹪。将细胞生长至对数生长期,消化传代。
2.细胞转染和分组:将传代后对数生长期的A549细胞稀释为1~2×l06个细胞/mL,以2×l05个细胞/孔的密度接种于6孔板中,培养细胞至融合为一层,进行转染。首先,用无血清培养液分别稀释脂质体Lipofectamine 2000、待转染载体,取等体积脂质体和各组载体混合,室温孵育20 min,加入到培养好的细胞孔板中,继续培养6 h,弃培养液,换成完全培养基,转染48 h,收集细胞。根据转染载体不同分为pcDNA3.1组(转染pcDNA3.1)、pcDNA3.1-MAGI2-AS3组(转染pcDNA3.1-MAGI2-AS3)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-31-5p组(转染anti-miR-31-5p)、pcDNA3.1-MAGI2-AS3+miR-NC组(共转染pcDNA3.1-MAGI2-AS3和miR-NC)、pcDNA3.1-MAGI2-AS3+miR-31-5p组(共转染pcDNA3.1-MAGI2-AS3和miR-31-5p mimics)。按照下述实验方法检测A549细胞的增殖、迁移和侵袭能力。
3.qRT-PCR检测lncRNA MAGI2-AS3和miR-31-5p的表达:收集各组细胞,Trizol试剂提取细胞总RNA,根据反转录试剂盒说明书合成cDNA,5×gDNA Eraser Buffer 2 μL,gDNA Eraser 2 μL,RNA 1 g,补水至10 μL;然后在42℃孵育2 min;再加入5×Prime Script Buffer 24 μL,Prime Script RT Enzyme MixⅠ1 μL,RT Prime mix 1 μL,补水至20 μL;37℃ 15 min、85℃ 5 s、4℃保存备用。取cDNA按照qRT-PCR的说明书进行反应,反应体系:2 μL反转录产物、10 μL SYBR Green Mix、Dye Ⅱ 0.5 μL,上下游引物各0.5 μL,补水至20 μL;反应程序为:94℃ 4 min;94℃ 30 s、58℃ 30 s、72℃ 30 s,40个循环;72℃ 5 min。引物序列和扩增长度见表1。分别以GAPDH和U6为内参,运用Bio-Rad PCR系统分析MAGI2-AS3和miR-31-5p相对表达水平。

表1 引物序列信息
4.MTT实验检测细胞增殖:收集细胞,胰蛋白酶消化,用培养液稀释细胞,以2×103个/孔接种于96孔板中,继续培养,当培养至24、48、72 h 时进行MTT实验,每孔加入 20 μL(5 mg/mL)MTT,培养4 h,弃上清,加入150 μL DMSO,室温振荡5 min,酶标仪测定490 nm 吸光度(OD)值。实验重复3次。
5.Transwell 实验检测细胞迁移和侵袭:(1)迁移实验:收集对数生长期的细胞,加入含10 g/L BSA的无血清F12K培养基,稀释细胞为2×105个/mL。Transwell下层培养孔加入500 μL10﹪FBS培养基作为迁移趋化物,上层小室中加入100 μL细胞,将上层小室放入下层培养孔培养48 h,取出,棉签拭去基质胶和上层小室的细胞,4﹪多聚甲醛固定细胞,0.1﹪结晶紫染色,显微镜随机选取3个视野进行拍照和计数。实验重复3次。(2)侵袭实验:以4℃无血清F12K培养基1:3比例稀释Matrigel,加入上层Transwell 小室,烘干,以下步骤同迁移实验,培养48 h,固定细胞,染色,计数。
6.双荧光素酶报告实验:收集转染后A549细胞接种于24孔板中(1×104个细胞/孔),继续培养,观察若细胞融合为一层,进行转染,分别构建MAGI2-AS3的野生型(WT-MAGI2-AS3)和突变型(MUT-MAGI2-AS3)双荧光素酶报告载体,分别共转染miR-NC 或miR-31-5p,转染后48 h,收集细胞,RIPA 裂解液室温裂解20 min,离心收集上清,加入荧光素酶底物,发光仪检测活性。以海肾荧光素酶活性为内参照,计算相对荧火虫荧光素酶活性。为证实MAGI2-AS3是通过调控miR-31-5p进而在肺癌中发挥作用,将si-NC、si-MAGI2-AS3、pcDNA3.1、pcDNA3.1-MAGI2-AS3分别转染A549细胞,依次记为si-NC组、si-MAGI2-AS3组、pcDNA3.1组、pcDNA3.1-MAGI2-AS3组。转染48 h后,按照qRT-PCR步骤检测miR-31-5p表达水平。si-MAGI2-AS3序列为5'-CCTTCACACTTCCTGCTAT-3',si-NC序列为5'-UUCUCCGAACGUGUCACGU-3'。实验重复3次。
7.流式细胞术测定细胞凋亡率:收集各组A549细胞,稀释,以1×104个/孔接种于6孔板,继续培养72 h,Trypsin 消化,收集细胞,按照凋亡试剂盒说明书进行操作,加入5 μL Annexin V-FITC和5 μL 碘化丙啶(PI)混匀,室温避光20 min,流式细胞仪检测分析细胞凋亡率。实验重复3次。
8.流式细胞术测定细胞周期:收集各组A549细胞,用预冷的PBS洗涤3次,离心沉淀细胞,弃上清;然后重悬细胞,加入预冷的80﹪乙醇,4℃固定过夜;用PBS洗涤细胞3次,加入核糖核酸酶A(RNase A),37℃孵育30 min,加入碘化啶(PI)染色液,4℃染色15 min,上机检测激发波长488 nm处红色荧光,用流式细胞仪和DNA细胞周期分析软件对细胞周期进行分析。
三、统计学分析方法
采用 SPSS21.0 统计软件进行数据分析,MAGI2-AS3、miR-31-5p表达、细胞增殖、周期、凋亡、迁移、侵袭、荧光素酶活性数据均采用±s表示。两组间比较采用独立样本t检验进行分析;多组间比较采用单因素方差分析,组内多重比较采用SNK-q检验。以P< 0.05为差异有统计学意义。
结 果
一、lncRNA MAGI2-AS3和miR-31-5p在肺癌细胞A549和正常肺细胞HBE中的表达
qRT-PCR 结果表明,与HBE组相比,A549组的MAGI2-AS3表达量降低,miR-31-5p表达量升高,差异有统计学意义(P均< 0.05,表2)。
表2 MAGI2-AS3和miR-31-5p在细胞A549和HBE中的表达(±s,n= 3)

表2 MAGI2-AS3和miR-31-5p在细胞A549和HBE中的表达(±s,n= 3)
注:n为实验重复次数
分组 MAGI2-AS3 miR-31-5p HBE组 1.29±0.06 0.25±0.02 A549组 0.48±0.03 1.01±0.05 t值 20.914 24.444 P值 < 0.001 < 0.001
二、过表达MAGI2-AS3抑制A549细胞增殖、促进细胞凋亡
qRT-PCR结果表明,与pcDNA3.1组相比,pcDNA3.1-MAGI2-AS3组的MAGI2-AS3的表达量上升(P< 0.05,表3)。MTT、流式细胞术结果显示,与pcDNA3.1组相比,pcDNA3.1-MAGI2-AS3组的细胞活性(OD 490 nm)在48、72 h均下降,细胞凋亡率上升,差异具有统计学意义(P< 0.05,表3、图1)。流式细胞术结果显示,与pcDNA3.1组相比,pcDNA3.1-MAGI2-AS3组G0-G1期细胞所占比例升高,S期细胞所占比例降低(P< 0.05,表4)。
三、过表达MAGI2-AS3抑制肺癌细胞A549 迁移和侵袭
Transwell结果显示,与pcDNA3.1组相比,pcDNA3.1-MAGI2-AS3组的A549细胞迁移细胞数和侵袭细胞数均下降(P< 0.05,表5、图2)。
四、抑制miR-31-5p对肺癌细胞A549增殖、凋亡、迁移和侵袭的影响
qRT-PCR 结果表明,与anti-miR-NC组相比,anti-miR-31-5p组的miR-31-5p的表达量下降(P<0.05,表6)。MTT、流式细胞术、Transwell 结果显示,与anti-miR-NC组相比,anti-miR-31-5p组48、72 h时A549细胞活性(OD 490 nm)、迁移细胞数和侵袭细胞数均下降,细胞凋亡率上升,G0-G1期细胞所占比例升高,S期细胞所占比例降低(P< 0.05,表6~7,图3~4)。
表3 过表达MAGI2-AS3对细胞 A549增殖凋亡的影响(±s,n= 3)
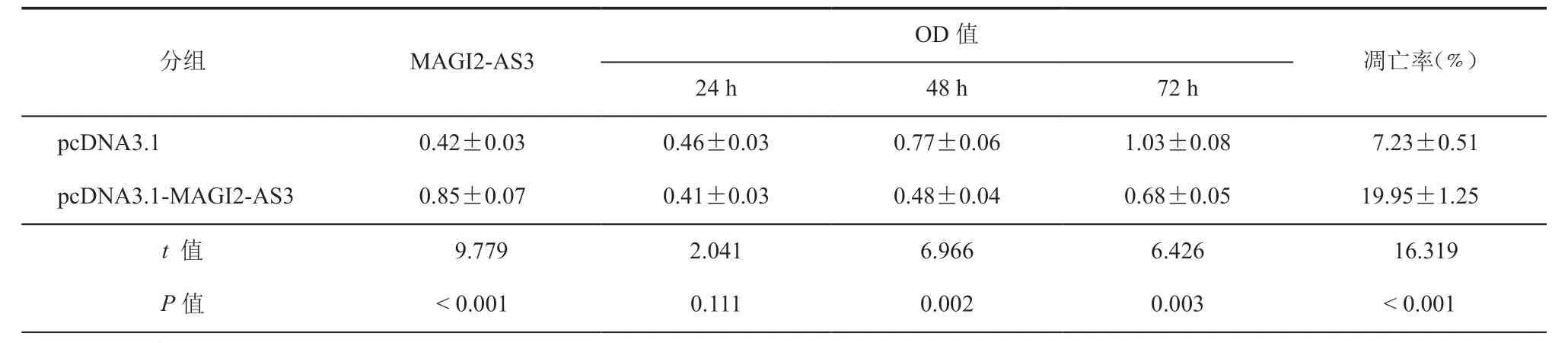
表3 过表达MAGI2-AS3对细胞 A549增殖凋亡的影响(±s,n= 3)
注:n为实验重复次数
分组 MAGI2-AS3 OD值凋亡率(﹪)24 h 48 h 72 h pcDNA3.1 0.42±0.03 0.46±0.03 0.77±0.06 1.03±0.08 7.23±0.51 pcDNA3.1-MAGI2-AS3 0.85±0.07 0.41±0.03 0.48±0.04 0.68±0.05 19.95±1.25 t值 9.779 2.041 6.966 6.426 16.319 P值 < 0.001 0.111 0.002 0.003 < 0.001

图1 流式细胞仪检测过表达MAGI2-AS3对细胞 A549 凋亡的影响
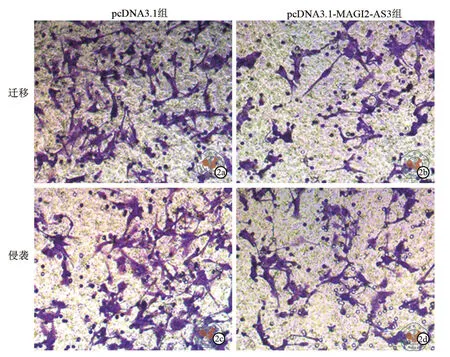
图2 光学显微镜下观察过表达MAGI2-AS3对细胞A549 迁移、侵袭细胞数的影响(结晶紫染色,×200)。 pcDNA3.1-MAGI2-AS3组(2b图)细胞迁移数目较pcDNA3.1组(2a图)减少;pcDNA3.1-MAGI2-AS3组(2d图)细胞侵袭数目录较pcDNA3.1组(2c图)减少
表4 过表达MAGI2-AS3对细胞 A549细胞周期的影响(﹪,±s,n= 3)

表4 过表达MAGI2-AS3对细胞 A549细胞周期的影响(﹪,±s,n= 3)
注:n为实验重复次数
分组 G0-G1 S G2-M pcDNA3.1 33.56±1.23 32.95±1.06 33.49±1.61 pcDNA3.1-MAGI2-AS3 43.58±2.15 23.01±1.00 33.41±1.60 t值 7.007 11.814 0.061 P值 0.002 < 0.001 0.954
表5 过表达MAGI2-AS3对细胞A549 迁移、侵袭的影响(个,±s,n= 3)

表5 过表达MAGI2-AS3对细胞A549 迁移、侵袭的影响(个,±s,n= 3)
注:n为实验重复次数
分组 迁移细胞数 侵袭细胞数pcDNA3.1 124.33±3.09 53.00±3.27 pcDNA3.1-MAGI2-AS3 81.33±2.87 32.00±2.83 t值 17.660 8.411 P值 < 0.001 0.001
五、lncRNA MAGI2-AS3靶向调控miR-31-5p的表达
Targetscan 软件预测结果显示,MAGI2-AS3序列中含有与miR-31-5p互补的核苷酸序列(图5)。双荧光素酶报告系统结果如表8所示,与miR-NC组相比,miR-31-5p组野生型WT-MAGI2-AS3的荧光素酶相对活性下降(P< 0.05);而突变型MUTMAGI2-AS3的荧光素酶相对活性没有明显变化。qRT-PCR 结果表明,与pcDNA3.1组(0.94±0.08)相比,pcDNA3.1-MAGI2-AS3组的miR-31-5p表达量(0.34±0.03)下降(t= 12.163,P< 0.001);与si-NC组(0.96±0.08)相比,si-MAGI2-AS3组的miR-31-5p表达量(1.56±0.12)上升(t= 7.206,P=0.002)。
表6 抑制miR-31-5p对细胞A549增殖、凋亡的影响(±s,n= 3)

表6 抑制miR-31-5p对细胞A549增殖、凋亡的影响(±s,n= 3)
注:n为实验重复次数
分组 miR-31-5p OD值凋亡率(﹪)24 h 48 h 72 h anti-miR-NC组 1.02±0.06 0.47±0.03 0.78±0.06 1.05±0.08 7.29±0.51 anti-miR-31-5p组 0.48±0.03 0.42±0.03 0.53±0.04 0.76±0.06 18.21±1.24 t值 13.943 2.041 6.005 5.023 14.107 P值 < 0.001 0.111 0.004 0.007 < 0.001
表7 抑制miR-31-5p对细胞A549 迁移、侵袭及细胞周期的影响(±s,n= 3)

表7 抑制miR-31-5p对细胞A549 迁移、侵袭及细胞周期的影响(±s,n= 3)
注:n为实验重复次数
分组 G0-G1(﹪)S(﹪)G2-M(﹪)迁移细胞数(个)侵袭细胞数(个)anti-miR-NC组 33.53±1.27 32.91±1.08 33.56±1.68 108.33±2.87 42.33±2.05 anti-miR-31-5p组 41.56±2.19 24.43±1.13 34.01±1.23 76.00±3.74 30.00±1.63 t值 5.494 9.397 0.374 11.878 8.154 P值 0.005 0.001 0.727 < 0.001 0.001

图3 流式细胞仪检测抑制miR-31-5p对细胞A549 凋亡的影响

图4 光学显微镜下观察抑制miR-31-5p对A549细胞迁移和侵袭的影响(结晶紫染色,×200)。anti-miR-31-5p组(4b图)细胞迁移数目较anti-miR-NC组(4a图)减少;anti-miR-31-5p组(4d图)细胞侵袭数目较anti-miR-NC组(4c图)减少
六、过表达miR-31-5p可逆转上调MAGI2-AS3对细胞A549增殖、迁移、侵袭的抑制作用和凋亡促进作用
MTT、Transwell、流式细胞术结果(表9,图6~7)显示,与pcDNA3.1组相比,pcDNA3.1-MAGI2-AS3组48、72 h的A549细胞活性(OD 490 nm)、迁移细胞数和侵袭细胞数均下降,细胞凋亡率上升(P均< 0.05);与pcDNA3.1-MAGI2-AS3组、pcDNA3.1-MAGI2-AS3+miR-NC组相比,pcDNA3.1-MAGI2-AS3+miR-31-5p组48、72 h的A549细胞活性(OD 490 nm)在48、72 h均上升,迁移细胞数和侵袭细胞数均上升,细胞凋亡率下降(P均< 0.05)。说明过表达miR-31-5p可逆转上调MAGI2-AS3对A549细胞增殖、迁移和侵袭的抑制作用和凋亡促进作用。
表8 双荧光素酶报告实验(±s,n= 3)

表8 双荧光素酶报告实验(±s,n= 3)
注:n为实验重复次数
分组 WT-MAGI2-AS3 MUT-MAGI2-AS3 miR-NC组 1.01±0.06 1.01±0.05 miR-31-5p组 0.23±0.02 1.00±0.05 t值 21.361 0.245 P值 <0.001 0.819

图5 MAGI2-AS3 靶向miR-31-5p
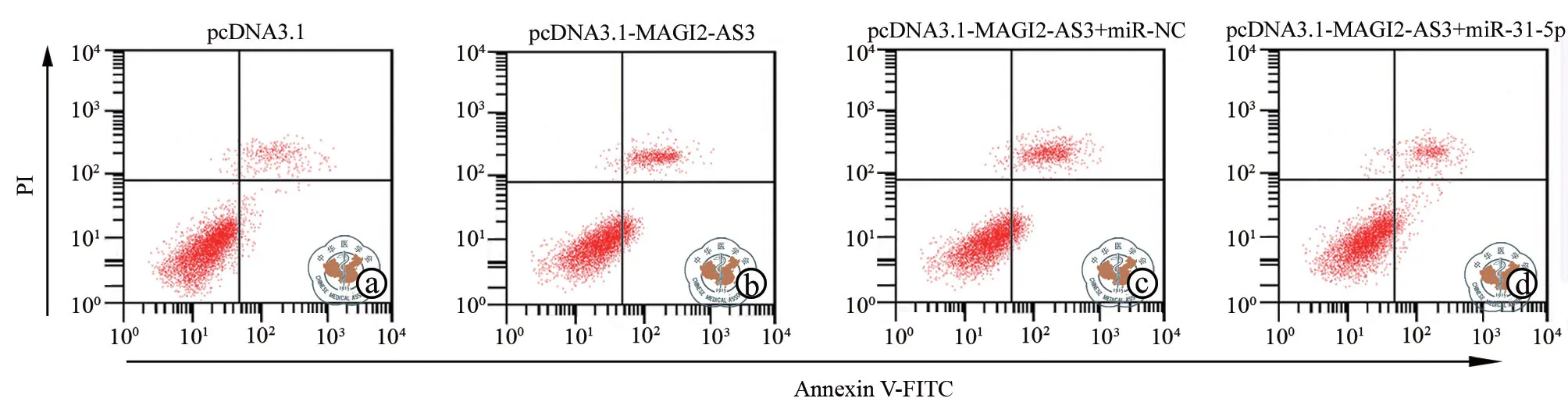
图6 流式细胞仪检测过表达miR-31-5p 能逆转MAGI2-AS3对细胞A549的凋亡影响

图7 光学显微镜下观察过表达miR-31-5p能逆转MAGI2-AS3对细胞A549迁移、侵袭的影响(结晶紫染色,×200)
表9 过表达miR-31-5p 能逆转lncRNA MAGI2-AS3对细胞A549的凋亡、增殖及迁移、侵袭的影响(±s,n= 3)

表9 过表达miR-31-5p 能逆转lncRNA MAGI2-AS3对细胞A549的凋亡、增殖及迁移、侵袭的影响(±s,n= 3)
注:与pcDNA3.1组比较,aP< 0.05;与pcDNA3.1-MAGI2-AS3组比较,bP< 0.05;与pcDNA3.1-MAGI2-AS3+miR-NC组比较,cP< 0.05;n为实验重复次数
分组 miR-31-5p OD值凋亡率(﹪)迁移细胞数 侵袭细胞数24 h 48 h 72 h pcDNA3.1组 1.02±0.08 0.47±0.04 0.76±0.07 1.04±0.09 7.23±0.51 125.00±2.16 81.67±2.49 pcDNA3.1-MAGI2-AS3组 0.34±0.02a 0.42±0.04 0.49±0.04a 0.69±0.05a 20.59±1.11a 53.33±2.87a 32.33±2.35a pcDNA3.1-MAGI2-AS3+miR-NC组 0.35±0.02a 0.43±0.04 0.50±0.04a 0.71±0.05a 21.11±1.14a 52.67±2.62a 31.67±4.03a pcDNA3.1-MAGI2-AS3+miR-31-5p组 0.78±0.06abc 0.44±0.04 0.68±0.06abc 0.95±0.07abc 10.59±1.01abc 91.00±1.63abc 62.67±2.49abc F值 558.665 2.625 55.256 60.850 155.664 642.749 207.998 P值 < 0.001 0.067 < 0.001 < 0.001 < 0.001 < 0.001 < 0.001
讨 论
肺癌是全世界最大的癌症杀手,吸烟是肺癌的主要原因[11]。2015年我国的肺癌新发病例约55万例,死亡约49.5万例[12]。现阶段,研究肺癌的分子抑制机制,是肺癌精准治疗的关键。
现有研究表明,lncRNA与miRNA可通过相互调控作用促进或抑制肿瘤的形成、进展[13]。多个lncRNA和miRNA对肺癌的增殖、侵袭、转移、预后及诊断等起重要作用[14-15]。Yin 等[16]研究发现,MAGI2-AS3在肝癌组织中的表达下调,并且与一些临床特征(肿瘤大小、淋巴结转移和肿瘤坏死因子分期)和较差的总生存率密切相关,MAGI2-AS3 通过靶向miR-374b-5p/SMG1 信号通路抑制肝癌细胞增殖和迁移。Du 等[17]研究发现,MAGI2-AS3在乳腺癌组织中的表达下调,过表达MAGI2-AS3可通过靶向miR-374a/PTEN 通路抑制乳腺癌细胞迁移和侵袭。Luo 等[18]研究表明,非小细胞肺癌患者血浆和血小板中MAGI2-AS3的水平明显低于健康对照组,MAGI2-AS3水平与肿瘤转移(TNM)分期、淋巴结转移、远处转移有相关性。Hao 等[19]最新研究发现,MAGI2-AS3在NSCLC中表达下调,过表达MAGI2-AS3 通过miRNA-23a-3p/PTEN 轴抑制NSCLC的增殖和侵袭能力。本研究发现,MAGI2-AS3在肺癌细胞A549中表达量降低,过表达MAGI2-AS3可以抑制A549细胞增殖、迁移和侵袭,促进细胞凋亡,与上述结果一致,且过表达MAGI2-AS3 还可阻滞细胞周期,说明MAGI2-AS3在肺癌的进展中发挥重要作用[19]。
miR-31-5p在多种肿瘤组织中表达异常,与肿瘤增殖、进展和预后有关。Yi-Hsuan 等[20]发现,miR-31-5p在口腔鳞状细胞癌(OSCC)组织中表达上调,其通过靶向ACOX1 改变脂质代谢,从而导致细胞内信号改变增强细胞的运动,调控癌细胞迁移和侵袭。Fu 等[21]研究发现,miRNA-31-5p 过表达降低了细胞周期蛋白A2(Cyclin A2)的水平,并抑制人精原干细胞的增殖。Zhao 等[22]miR-31-5p 过表达抑制肝癌细胞的生长,迁移和侵袭,且降低了细胞周期蛋白D1(Cyclin D1)的表达。Yan 等[23]发现在肺腺癌组织中,miR-31-5p表达量上升,高表达水平的患者具有较长的生存期。Zhu 等[24]研究表明,miR-31-5p在肺癌H1299和A549细胞系中表达量上调,过表达miR-31-5p可通过靶向FIH 增强Warburg 效应,上调有氧糖酵解基因维持能量平衡,增强糖酵解和ATP的产生,促进细胞增殖。本研究结果发现,miR-31-5p在肺癌细胞A549中表达量上调,与Yan 等[23]和Zhu 等[24]结果一致;抑制miR-31-5p可抑制A549细胞增殖、迁移和侵袭,阻滞细胞周期,促进细胞凋亡,证实了miR-31-5p在肺癌中具有重要作用。
通过对两者序列进行生物信息学分析,本研究发现,MAGI2-AS3序列中含有与miR-31-5p互补的核苷酸序列,预示MAGI2-AS3与miR-31-5p之间可能存在结合位点或者调控关系。通过进一步双荧光素酶报告系统实验结果发现,MAGI2-AS3靶向负调控miR-31-5p的表达。本研究证实了,在肺癌A549细胞中MAGI2-AS3和miR-31-5p之间的调控关系。
本研究首次阐述了,在肺癌A549细胞中,上调MAGI2-AS3可靶向抑制miR-31-5p的表达,进而抑制A549细胞增殖、迁移和侵袭,促进细胞凋亡。MAGI2-AS3是肺癌的潜在分子靶点,为肺癌的分子靶向治疗提供了新的方向。本研究仅在肺癌细胞A549中探讨了MAGI2-AS3的生物学功能,至于其具体的功能和机制仍需在多种肺癌细胞系中验证。

