小龙虾(Procambarus clarkii)加工前后优势腐败菌的分离与鉴定
邓 灵,赵 康,夏 开,圣莎丽,解华东,毕旺来,*
(1.武汉轻工大学生物与制药工程学院,湖北武汉 430023;2.重庆市畜牧科学院,重庆 400039)
小龙虾学名克氏原螯虾(Procambarusclarkii),是淡水螯虾的一种。小龙虾是高蛋白、低脂肪、低胆固醇的高营养水产品,蛋白质含量17.7%,脂肪含量0.1%,必需氨基酸种类齐全,富含多种不饱和脂肪酸,微量元素比例合理,对人体健康具有极大好处[1]。小龙虾熟制后肉质细嫩、口味独特,备受消费者青睐。然而由于虾类含有较高的蛋白质、水分及高活性多酚氧化酶,在捕捞、运输、加工及贮藏过程中,虾体易受微生物的污染,微生物快速繁殖极易引发虾肉腐败变质[2-3]。微生物繁殖的同时分解营养物质,生成胺、硫化物、醇、醛、酮和有机酸等具有不良风味的代谢产物[4]。在食品生产过程中,由于原料来源、加工、杀菌、流通和储藏方法等存在较大的差异,造成了不同虾产品有着不同的菌相组成,优势腐败菌可能也有所不同[5]。
目前国内外南美对虾等腐败微生物种类及消长动态变化的研究较深入[6-8],但小龙虾的相关研究还较少。近年来,有关小龙虾优势腐败菌的研究开始引起了科研人员的重视。于晓慧等人对常温保藏的即食小龙虾优势腐败菌进行了分离鉴定,证实为柠檬酸杆菌[9]。江杨阳等人采用常规平板分离和高通量测序相结合的方法,发现冷藏小龙虾的优势腐败菌有希瓦氏菌、肉食杆菌、环丝菌属、嗜冷菌属、漫游球菌属、不动杆菌属、气单胞菌、束毛球菌属等[10]。周涛等人鉴别了不同温度储存条件下即食小龙虾的微生物种群多样性。他们发现随着贮藏时间的延长,小龙虾微生物多样性逐渐降低。4 ℃贮藏末期,优势菌群为海洋杆菌属和希瓦氏菌属;25 ℃贮藏末期,优势菌群为哈撒韦氏菌属、芽孢杆菌属和狭义梭菌属[11]。张永进等利用16S rDNA测序技术,鉴定出巴氏杀菌的即食小龙虾腐败菌为苏云金芽孢杆菌和希瓦氏菌[12]。
近年来,我国小龙虾产业飞速发展,消费者对小龙虾即食产品的需求量越来越大,但即食小龙虾普遍存在微生物繁殖过快、货架期短的问题,造成小龙虾即食产品生产成本高,风味成分流失快,食品安全风险大。优势腐败菌是导致虾产品腐败变质的主要因素[13]。本文采用传统平板分离纯化和分子生物学相结合的方法,鉴别生鲜原料小龙虾和卤制即食小龙虾优势腐败菌,为企业后续研发适宜的杀菌和防腐保鲜工艺提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
原料小龙虾和即食小龙虾 原料小龙虾为活虾,即食小龙虾为锁鲜装,均由湖北省内某企业提供;其中即食小龙虾已在15 ℃冷链条件下储存3 d;PCA、MRS培养基 青岛海博生物科技有限公司;限制性内切酶(MspⅠ)、细菌核酸提取试剂盒、PCR纯化试剂盒 宝生物工程(大连)有限公司;引物合成 上海生工生物有限公司。
水浴锅 金坛市医疗仪器厂;DYY-10C电泳仪 北京六一仪器厂;恒温培养箱 上海新苗医疗器械制造有限公司;梯度PCR仪 德国Biometra公司;台式高速冷冻离心机 德国Eppendorf公司;GBox-HR-E-M凝胶图像系统 英国Syngene公司。
1.2 平板菌落计数和细菌分离纯化
挑选鲜活原料小龙虾和即食小龙虾,无菌操作,将小龙虾去头去壳。称取虾肉(带虾线)10 g,剪碎后置于无菌均质袋,再加入90 mL 0.9%无菌生理盐水,拍打2 min(速度为7次/s)以获得10倍稀释的虾匀浆。然后将虾匀浆用无菌生理盐水按十倍进行梯度稀释。每个梯度取100 μL稀释液分别涂布PCA和MRS平板,37 ℃恒温培养,培养48 h后,按照国家标准进行细菌计数[14]。同时挑取平板上形态不同的典型单菌落,进行革兰氏染色,油镜(100×)观察细胞形态。根据菌落形态观察和革兰氏染色结果,进行菌株初步分类。将分类不同的代表菌株划线分离(重复3次划线纯化),直至获得纯培养物,斜面保存。
1.3 细菌基因组DNA提取
将纯化后的菌株用LB培养基37 ℃过夜振荡培养,采用TaKaRa MiniBEST细菌基因组DNA提取试剂盒提取DNA。1.0%琼脂糖凝胶电泳检测细菌DNA的提取质量。
1.4 16S rDNA序列扩增
采用16S通用引物27F:5′-AGAGTTTGATC MTGGCTCAG-3′,1525R:5′-AAGGAGGTGWTCC ARCC-3′,对提取的细菌基因组DNA进行PCR扩增。PCR体系为:10×buffer 2.5 μL,2.5 mmol/L dNTP 2 μL,10 μmmol/L上下游引物各1.0 μL,模板1.0 μL,TaqDNA聚合酶0.15 μL,ddH2O 18.35 μL。PCR反应条件:94 ℃预变性5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,循环扩增25次;72 ℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳分析。
1.5 限制性内切酶消化分析
PCR产物用PCR纯化试剂盒纯化后,用1.0%琼脂糖凝胶电泳检测纯化效果。取10 μL纯化后的PCR产物,加入限制性内切酶Msp Ⅰ 1 μL,10×T Buffer 2 μL,0.1% BSA 2 μL,ddH2O 5 μL。37 ℃酶切2 h,再加入2 μL 10×Loading Buffer终止反应。用2.0%琼脂糖凝胶电泳检查酶切后的DNA片段。按照酶切电泳谱型将对应菌株进行归类。
1.6 系统进化树构建
选取代表菌株,即将革兰氏染色结果、菌落外形、酶切电泳谱型相同的分成同类型,每种类型随机挑选菌株进行16S rDNA PCR,将PCR产物纯化后送至上海生工生物有限公司进行双向测序。将拼接后的16S rDNA输入NCBI数据库进行Blast比对,并用MEGA 5.0软件使用邻接法(Neighbor Joining,NJ)构建系统进化树,对未知菌种定属。
2 结果与分析
2.1 平板菌落计数和优势腐败菌分离
原料小龙虾肉和即食小龙虾肉经过匀浆、梯度稀释涂布平板后,37 ℃培养48 h,进行菌落计数。PCA平板上活菌平板菌落计数原料小龙虾为2.52×104CFU/g,即食小龙虾为2.25×104CFU/g。因即食小龙虾已经冷链储存3 d,开始腐败,所以微生物繁殖数目较高。MRS平板上鲜有活菌生长,表明原料小龙虾和即食小龙虾优势腐败菌中乳酸菌很少见。观察平板上的所有单菌落外形颜色,挑选典型菌落接种PCA平板保存,同时对典型菌株进行革兰氏染色和镜检观察,按革兰氏染色和镜检结果将菌株进行初步分类。即将革兰氏染色结果和菌落外形不同的分成不同种类。原料小龙虾平板分离得到5类细菌,形态以杆菌居多,染色结果有革兰氏阳性菌也有革兰氏阴性菌,也有少量革兰氏阴性球菌。即食小龙虾平板分离得到1类细菌,均为革兰氏阳性杆菌。图1所示为其中2株典型菌株的革兰氏染色和镜检观察结果,1A为来源于原料小龙虾中的革兰氏染色红色杆菌,1B为来源于即食小龙虾中的革兰氏染色紫色杆菌。

图1 革兰氏染色镜检结果Fig.1 Gram staining photomicrographs
2.2 16S rDNA PCR扩增
从原料小龙虾样本中分离出来的5类细菌中挑选并纯化了29株菌株,即食小龙虾样本中分离出来的1类细菌中分离纯化了10株菌株。将这些菌株过夜培养,采用商业试剂盒提取DNA。1%琼脂糖凝胶检测DNA提取质量。从原料小龙虾和即食小龙虾分离的细菌基因组DNA均呈现明亮单一的条带,DNA片段大小约为12000 bp,说明核酸提取完好。图2列举了原料小龙虾分离的部分细菌DNA电泳结果。采用细菌通用引物(27F与1525R)对原料小龙虾和即食小龙虾分离的细菌进行16S rDNA PCR扩增,1.5%琼脂糖凝胶检测,PCR产物大小约为1500 bp,和预期PCR产物大小一致。图3列举了原料小龙虾分离的部分细菌PCR检测结果。

图2 原料小龙虾部分细菌基因组DNA琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of genomic DNA from representative strains isolated from raw crayfish

图3 原料小龙虾部分细菌16S rDNAPCR产物琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of 16S rDNA PCR products from representative strains isolated from raw crayfish
2.3 限制性内切酶酶切分析
将PCR产物用商业试剂盒纯化,经限制性内切酶MspⅠ酶切后,PCR产物呈现不同的带型。用2.0%琼脂糖凝胶电泳检测酶切后的电泳条带。来源于原料小龙虾的菌株PCR产物经酶切后呈现5种不同带型。如图4所示,泳道1、2、3、4和6代表不同酶切带型,泳道2和5酶切带型相同。来源于即食小龙虾的细菌PCR产物经酶切后仅呈现1种带型(图5)。因此判断原料小龙虾分离的29株细菌分属5种优势菌型,而即食小龙虾来源的10株细菌同属一种优势菌型。原料小龙虾和即食小龙虾随机挑选5株菌株,培养过夜后提取DNA,并做16S rDNA PCR扩增,将PCR产物纯化后双向测序。
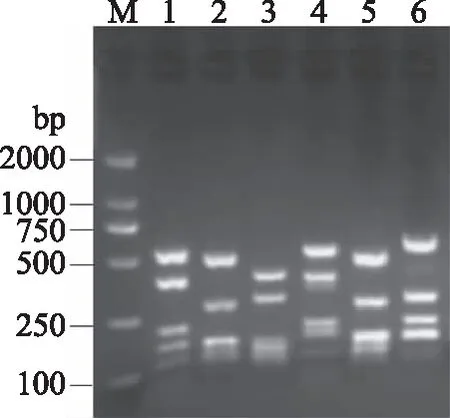
图4 原料小龙虾细菌PCR产物酶切图Fig.4 Restriction endonuclease digestion of PCR products from strains isolated from raw crayfish
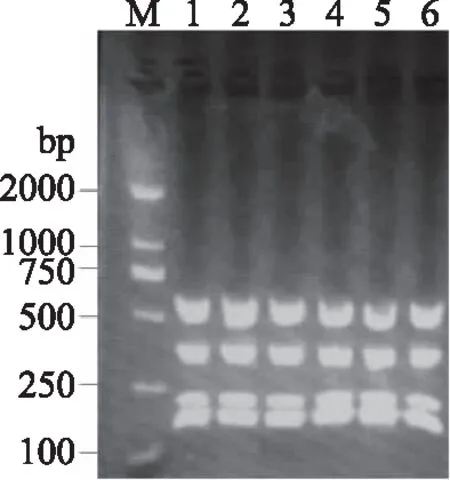
图5 即食小龙虾细菌PCR产物酶切图Fig.5 Restriction endonuclease digestion of PCR products from strains isolated from ready-to-eat crayfish
2.4 16S rDNA测序与系统进化树构建
将代表菌株16S rDNA测序拼接后的序列,输入NCBI网站进行BLAST序列比对,选取Max ident与测序序列最接近的参比序列,多序列比对后用MEGA5.0软件构建系统进化树,对未知菌种定种属。原料小龙虾测序菌株编号为2、3、5、6、19。即食小龙虾测序菌株编号为P1、P3、P4、P6、M1。原料小龙虾优势腐败菌种类为阴沟肠杆菌(Enterobactercloacae)、溶酪巨球菌(Macrococcuscaseolyticus)、嗜水气单胞菌(Aeromonashydrophilia)、微小杆菌(Exiguobacteriumindicum)和芽胞杆菌属(Bacillusspp.)(图6)。即食小龙虾优势腐败菌种类为蜡样芽孢杆菌(Bacilluscereus)与苏云金芽孢杆菌(Bacillusthuringiensis)(图7)。原料小龙虾和即食小龙虾优势腐败菌以杆菌为主,这一结果也和细菌革兰氏镜检结果吻合。原料小龙虾腐败菌菌相与养殖生态环境和物流环境条件有关。研究发现,在有氧冷藏过程中,水产品腐败菌多为假单胞菌或者腐败希瓦氏菌;如果水产品来源于受污染的水中,腐败菌多为肠杆细菌[15]。张永进等鉴定出巴氏杀菌的即食小龙虾腐败菌为苏云金芽孢杆菌和希瓦氏菌[12]。本文研究结果也发现原料小龙虾中芽孢杆菌为主要优势菌型。经过卤制高温工艺后,原料小龙虾中其他类型的腐败菌被灭活,仅耐热的芽孢杆菌留存。因此即食小龙虾中仅能检测到蜡样芽孢杆菌和地衣芽孢杆菌。

图6 原料小龙虾分离株系统进化树分析Fig.6 Phylogenic tree of strains isolated from raw crayfish

图7 即食小龙虾分离株系统进化树分析Fig.7 Phylogenic tree of strains isolated from ready-to-eat crayfish
3 讨论与结论
近年来研究水产品腐败菌种群分布和消长动态的报道很多。各种方法各有优缺点。采用宏基因组方法虽然能得到比较全面的微生物菌相信息,但该方法耗时费力,价格昂贵,而且高通量测序得到的很多菌群可能属于不可培养微生物(Uncultivated Microorganisms)[16]。由于水产品养殖水域、品种、储藏方式不同,各种文献报道的虾类腐败菌种类差异甚大。虽然水产品中微生物种类繁多,但随着储存时间延长,通常只有一种或几种优势腐败菌取得生长优势,抑制其他微生物生长,并最终导致产品腐败。因此对企业来说,并不一定需要阐明水产品腐败菌菌相的全貌,了解导致产品腐败的优势腐败菌种类,并针对性采取杀菌措施最为关键。因此,本文采取了传统平板分离法、限制性内切酶消化PCR 产物和16S rDNA测序相结合的方法,研究原料小龙虾和即食小龙虾的优势腐败菌种类。相较高通量测序,本文采用的方法成本低廉,能在短时间内查明主要优势腐败菌。
汤纯等人运用Illumina MiSeq宏基因组测序方法分析新鲜泗洪小龙虾不同部位的菌群组成[17],发现小龙虾3个部位的初始菌群组成有一定差别,整虾和虾表面微生物组成相似,菌群以黄杆菌属、不动细菌属、金黄杆菌属为主;虾肉的菌群与虾整体、表面差别较大,主要由气单胞菌属、黄杆菌属、假单胞菌属和希瓦氏菌属组成。这说明整虾和虾表面微生物来源与环境等因素关联更大,而虾肉微生物主要来源于虾肠道,微生物多样性更低,也是导致食品安全潜在风险的主要原因。由于虾肉是可食部位,本文仅以虾肉作为研究对象,从原料小龙虾和即食小龙虾中均检出芽孢杆菌,结果表明,即便经过高温蒸煮工艺,即食小龙虾中的蜡样芽孢杆菌与苏云金芽孢杆菌仍难以除灭;苏云金芽孢杆菌和蜡样芽孢杆菌都是可以产芽孢的耐热菌,巴氏杀菌方法很难将芽孢杀灭。小龙虾的肉质特点使得冷藏期间芽孢大量繁殖,严重缩短了货架期,造成商业损失。此外,从进化角度上看,苏云金芽孢杆菌与蜡样芽胞杆菌高度同源,DNA序列只有个别碱基的差异,相似程度非常高,在学术界二者曾一度被公认为是同一种菌[18]。蜡样芽胞杆菌可以引起严重的食物中毒[19-20],而对于苏云金芽孢杆菌,其潜在的食品安全性问题也同样应该引起足够重视。
国内外有利用含壳聚糖、肉桂精油等抗菌剂的胶原蛋白膜保存对虾的报道[21-22],小龙虾防腐保鲜的相关研究还很滞后。针对小龙虾优势腐败菌群特点,研发合理的杀菌工艺和防腐配方,有助于延长小龙虾产品的保质期,推动小龙虾产业进一步发展壮大。

