降解展青霉素的乳酸菌的筛选鉴定及其降解特性研究
郑香峰,陈夕飞,孙 琰,魏皖宁,杨振泉
(扬州大学食品科学与工程学院,江苏扬州 225127)
展青霉素又称棒曲霉素,是由曲霉属、青霉属、丝衣霉属等属内多种真菌代谢产生的次级代谢产物[1-2]。最初,文献报道展青霉素是一种潜在的广谱抗生素[3],能抑制超过75种不同的细菌。但之后的研究发现,展青霉素不仅抑制细菌,其对真菌、高等植物、动物等也均表现出一定的毒性。展青霉素是一种对人体具有严重危害的真菌毒素,可引起机体的多种毒性,包括急性毒性、慢性毒性和细胞毒性[4-5]。
鉴于展青霉素的毒性,许多国家和地区对食品中展青霉素含量施行了限量标准。根据我国相关标准规定,苹果、山楂及其制成的饮料、酒类产品中展青霉素最大限量为50 μg/kg[6]。但是,展青霉素易溶于水并在酸性条件下稳定,且易从水果腐烂组织转移到健康组织中,而去掉腐烂组织的水果又常被用作生产果汁、果酱等产品[7-8],从而造成展青霉素在上述产品中的残留和污染[8-9]。因此,展青霉素在食品中的污染较为严重,其防治至关重要。
展青霉素的防治主要有物理方法、化学方法和生物方法。物理方法是指通过物理手段减少水果在贮藏期间感染致病霉菌的风险或降低展青霉素的含量,其主要手段有人工采选、冲洗、冷藏等[9-10]。但是,物理方法需要大量的人力物力,且容易导致展青霉素进入环境。化学方法主要使用咪鲜胺、抑霉唑、噻菌灵、克菌丹、臭氧等化学杀菌剂来处理。但是化学试剂处理会造成药剂残留、食品品质的破坏,且有些化学试剂的安全性尚不明确[9]。生物方法是指使用微生物的拮抗作用抑制毒素的产生或者通过自身的降解作用将已经产生的展青霉素进行脱毒的方法。Zheng等[11]研究了Pichiacaribbica酵母对培养基中的展青霉素的降解作用。在7 d之内,Pichiacaribbica将浓度为60 μg/mL的展青霉素被完全降解。进一步研究发现,酵母的胞内酶和胞外酶是降解展青霉素的主要物质[11-12]。另外一些研究发现酵母细胞壁上的多糖和蛋白质在降解展青霉素的过程中也发挥了重要作用[13-14]。目前,已有许多酵母生物降解展青霉素的报道[15-16]。有研究表明乳酸菌对展青霉素具有一定的去除能力。Hatab等[17]发现了一株鼠李糖乳杆菌,该乳杆菌的活菌和死菌对展青霉素的去除率分别达到了51.1%和52%,推断鼠李糖乳杆菌主要通过菌体表面的吸附作用去除展青霉素。2013年,Hawar等[18]发现乳酸菌可以将展青霉素降解为hydroascladiol,但具体作用机制不明。乳酸菌降解展青霉素的研究相对较少,已发现的能够去清除展青霉素的乳酸菌种类或菌株数量有限,亟需筛选一批对展青霉素降解能力强的乳酸菌并研究其降解机理。乳酸菌对人体健康具有多种益生功效,筛选可高效降解展青霉素的乳酸菌并研究其降解展青霉素的机理对食品中展青霉素的防治有重要实用价值。
本研究将从传统发酵食品青海泡菜中分离得到的2株乳酸菌中筛选能够高效降解展青霉素的菌株,并对其进行形态学和分子生物学鉴定,分别研究其活菌、胞内物质、胞外代谢物及细胞壁对展青霉素的降解作用,探究该菌株对展青霉素的降解特性。
1 材料与方法
1.1 材料与仪器
乳酸菌菌株 2株,分离自青海泡菜;葡萄糖、蛋白胨、无水乙酸钠、柠檬酸三铵、磷酸氢二钾、硫酸镁、硫酸锰、吐温-80、牛肉膏、酵母膏、琼脂、磷酸二氢钠、磷酸氢二钠、氯化钠 国药集团化学试剂有限公司;甲醇(色谱纯,Tedia)、乙腈(色谱纯,Tedia) 扬州华明仪器设备有限公司;展青霉素标准品(纯度≥99%,CAS:149-29-1,产品编号:MSS1021) 青岛普瑞邦生物工程有限公司。
HC-2066离心机 安徽中科中佳科学仪器有限公司;ZEALWAY高压灭菌锅 致微(厦门)仪器有限公司;BSA223S-CW天平 赛多利斯科学仪器(北京)有限公司;GNP-9270BS-Ⅲ隔水式恒温培养箱 上海新苗医疗器械制造有限公司;SW-CJ-1F无菌工作台 苏州净化设备有限公司;(ZORBAX SB-C18,4.6×50 mm,5 um)色谱柱、1260安捷伦高效液相色谱仪 安捷伦科技有限公司;VCX150PB超声破碎仪 美国索尼克斯公司。
1.2 实验方法
1.2.1 菌株的培养与筛选 菌株活化:将实验室中冷冻保存的两株乳酸菌接种至MRS固体培养基。在37 ℃培养箱中培养24~48 h,待长出单菌落,挑取单菌落至新鲜MRS液体培养基,37 ℃培养箱中培养24~48 h,至对数期。清除展青霉素能力的测定:将2株活化好的乳酸菌按2%接种量分别接入新鲜MRS培养基,并添加10.9 μg/mL的展青霉素,放置于37 ℃培养箱,每隔24 h取样,测定样品中剩余的展青霉素含量,筛选对展青霉素具有较强降解作用的菌株。
1.2.2 展青霉素的含量测定 将10 mg展青霉素标准品完全溶解于10 mL甲醇中,使用0.22 μm微孔滤膜过滤后,贮存在-20 ℃,得到浓度为10 mg/mL的展青霉素贮存液,根据后续工作需要配制相应浓度的展青霉素工作液。采用高效液相色谱(High Performance Liquid Chromatography,HPLC)测定展青霉素的含量。展青霉素的检测参考Zheng等[11]的方法,检测条件为:流动相10%乙腈,流速1 mL/min,进样量为20 μL,检测波长为276 nm。所有样品检测前均经过0.22 μm膜过滤。配制浓度为0、0.2、0.4、0.6、0.8、1、5、10、15 μg/mL的展青霉素标准品。利用HPLC对其进行检测,展青霉素标准品峰保留时间在6.4 min。以不同浓度展青霉素标准品的保留峰面积与浓度梯度的对应关系建立标准曲线,得到标准曲线方程为y=77.282x-10.217(R2=0.9997)(y为峰面积,x为展青霉素浓度)。
1.2.3 降解展青霉素的乳酸菌的鉴定
1.2.3.1 降解展青霉素的乳酸菌的16S rDNA测序 乳酸菌活化后,送至上海生工生物公司对乳酸菌的16S rDNA进行测序,所用测序引物为通用引物27F/1492R。
1.2.3.2 乳酸菌分类鉴定 将测序得到的乳酸菌16S rDNA序列,在NCBI数据库利用Blast在线比对软件进行相似性比对,得到与其同源的菌株及它们的16S rDNA序列。利用MEAG7.0构建乳酸菌的16S rDNA的进化树,从而确定乳酸菌的进化分类地位。
1.2.4 乳酸菌活菌清除展青霉素能力的测定 将活化好的YZU02菌株以2%接种量接种至新鲜MRS液体培养基中,其中添加终浓度为10.9 μg/mL的展青霉素标准品。只添加终浓度为10.9 μg/mL展青霉素的MRS液体培养基作为对照,标记为CK。上述2组样品放入37 ℃培养箱中培养。在0、9、18、27、36、45、54、63 h时取样,样品经0.22 μm滤膜过滤后,利用高效液相色谱法测定展青霉素含量。每个处理设置3个重复,实验重复2次。
1.2.5 乳酸菌胞内物质清除展青霉素能力的测定 参考Zheng等[19]的方法,研究乳酸菌胞内物质对展青霉素的降解作用。将活化好的L.plantarumYZU02以2%接种量分别接种至新鲜5 mL MRS液体培养基,以及含有终浓度为10.9 μg/mL的展青霉素的5 mL MRS液体培养基,分别记为L.plantarumYZU02、L.plantarumYZU02+Patulin。上述样品置于37 ℃培养箱中培养36 h后,将培养物收集至10 mL离心管,在10000 r/min转速下离心5 min,弃上清,取沉淀,加入5 mL磷酸盐缓冲液(PBS),悬浮清洗菌体。然后10000 r/min离心2 min,弃去上清。再往菌体中添加5 mL PBS,进行超声破碎(300 W,间隔2 s,工作4 s,300次)。超声结束后10000 r/min离心5 min,收集上清,得到胞内物质溶液。添加展青霉素至上述胞内物溶液使其终浓度为10.9 μg/mL,只添加终浓度为10.9 μg/mL展青霉素的PBS缓冲液作为对照,标记为CK。置于37 ℃培养箱培养,每隔9 h取样,经高效液相色谱测定展青霉素含量。每个处理设置3个重复,实验重复2次。
1.2.6 乳酸菌胞外代谢物清除展青霉素能力的测定 参考Zheng等[19]的方法,研究乳酸菌胞外代谢物对展青霉素的清除能力。取活化好的菌液按2%接种量接种到含有5 mL MRS培养基的离心管,同时添加展青霉素至终浓度为10.9 μg/mL,转移至37 ℃培养箱中,培养9 h后,取样留作检测展青霉素含量,剩余样品继续培养至12 h。12 h时取出样品并收集到已灭菌的10 mL离心管,经10000 r/min离心5 min,弃菌体,取培养液。培养液经0.22 μm滤膜过滤除菌后,重新放置到37 ℃培养箱中继续培养。每隔9 h取样,检测展青霉素含量。以只含有10.9 μg/mL展青霉素的MRS培养液作为对照,标记为CK。每个处理设置3个重复,实验重复2次。
1.2.7 细胞壁清除展青霉素能力的测定 参考Zheng等[19]的方法,研究乳酸菌细胞壁对展青霉素的吸附作用。取活化好的菌液按2%接种量接种到含有5 mL MRS培养基的离心管,置于37 ℃培养箱中恒温培养48 h。收集菌液至已灭菌的10 mL离心管,经10000 r/min离心5 min,弃上清留菌体。菌体用4 mL PBS悬浮,并通过100 ℃高温加热10 min致死处理。致死后的样品中用PBS定容至5 mL,同时添加终浓度为10.9 μg/mL的展青霉素,置于37 ℃培养箱中培养,每隔9 h取样,利用高效液相色谱测定展青霉素含量。只添加终浓度为10.9 μg/mL展青霉素的PBS缓冲液作为对照,标记为CK。每个处理设置3个重复,实验重复2次。
1.3 数据处理
所有数据均平行测定3次,数据进行t检验取平均值±标准差表示,所有数据用SPSS 20.0软件进行分析,显著性采用ANOVA进行邓肯氏多重差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 清除展青霉素的乳酸菌的筛选
将YZU01、YZU02两株乳酸菌分别接种至含有10.9 μg/mL展青霉素的MRS培养基中,每24 h检测其中展青霉素的含量。结果如图1所示,YZU01菌株在24 h内没有明显降低展青霉素含量,在48 h时将展青霉素含量由10.9 μg/mL降至6.26 μg/mL。而YZU02菌株在24 h时就将展青霉素含量降至4.5 μg/mL,对展青霉素的清除率达到58.72%。在48 h时将展青霉素的含量降低至3.1 μg/mL,对展青霉素的清除率达到71.6%。可以看出菌株YZU02对展青霉素的降解作用较强,YZU01的降解作用较弱。因此根据以上检测结果,选择YZU02菌株进行后续的研究。目前,利用乳酸菌清除展青霉素的研究正处于起步阶段,报道的能够清除展青霉素的乳酸菌数量较少。Topcu等[20]筛选到一株屎肠球菌,将其与浓度为1 μg/mL的展青霉素作用48 h后,展青霉素的去除率只有45.3%。Hatab等[17]筛选到一株鼠李糖乳杆菌,在24 h内只能将浓度为1 μg/mL的展青霉素含量降低51.1%。龚雪筛选到一株对展青霉素具有高效降解作用的菌株LB-11,其在24 h内对浓度为1 μg/mL的展青霉素的降解率可达到90%[21]。而本研究所使用的展青霉素浓度高达10.9 μg/mL,是上述研究中所用展青霉素浓度的10倍以上,表明YZU02对展青霉素具有高效的清除作用。
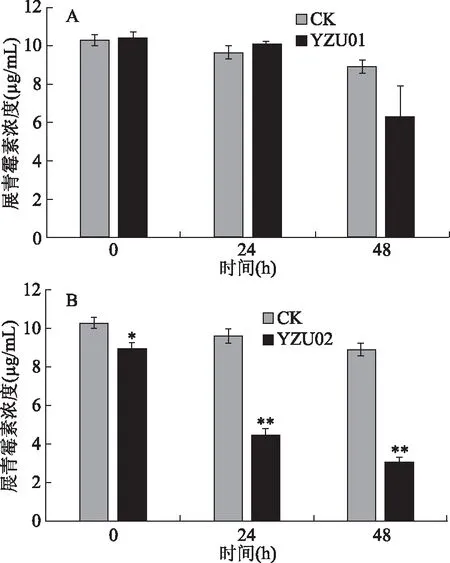
图1 两株乳酸菌对展青霉素的降解作用Fig.1 Patulin degradation effect of two LAB strains注:A、B:分别代表菌株YZU01、YZU02对展青霉素的降解结果;*代表与相同时间点的对照组(CK)相比差异显著(P<0.05),**代表与相同时间点的对照组CK相比差异极其显著(P<0.01)。
2.2 YZU02菌株的鉴定
取出-20 ℃保存的YZU02菌株,在MRS固体培养基平板上划线,在37 ℃条件下培养48 h,菌株的生长状况良好。如图2A所示,YZU02菌株的菌落大小均匀,表面凸起,颜色为白色,表面湿润,边缘整齐,菌落呈圆形,符合乳杆菌属菌落形态特征。利用革兰氏染色观察YZU02菌株,结果如图2B所示,YZU02菌株为革兰氏阳性菌,它的细菌形态为为杆状,无鞭毛。对菌株YZU02的16S rDNA基因进行测序,将YZU02的16S rDNA基因序列在NCBI数据库进行Blast比对,结果表明YZU02菌株的16S rDNA与植物乳杆菌(Lactobacillusplantarum)16S rDNA相似度高达99%。对YZU02菌株的16S rDNA的进化关系进行了分析,构建了其进化树,结果如图3C所示。进化树结果表明YZU02与植物乳杆菌高度同源,处于同一进化分支。从以上可以确定,YZU02为植物乳酸杆菌,将其命名为L.plantarumYZU02。

图2 YZU02菌株的鉴定Fig.2 Identification of YZU02
2.3 L. plantarum YZU02清除展青霉素的特性研究
筛选得到的L.plantarumYZU02菌株对展青霉素有高效清除作用,但其清除特性仍不明确。目前微生物清除毒素主要有2种途径:一种为微生物表面的吸附作用,另一种为微生物的生物降解作用[22]。确定L.plantarumYZU02菌株对展青霉素的清除作用是来自于细胞壁的吸附作用还是生物降解作用,对其后续实际应用具有重要指导意义。
2.3.1 活菌对展青霉素的清除作用 首先对L.plantarumYZU02在63 h内清除展青霉素的情况进行了跟踪研究,结果如图3所示。在9 h之前L.plantarumYZU02菌株处于生长迟滞期,对展青霉素的清除效果不明显。9~18 h,乳酸菌进入对数期,随着乳酸菌数量的增多展青霉素的含量急剧下降。到36 h时,展青霉素含量由10.87 μg/mL降至2.94 μg/mL,展青霉素清除率为72.95%。36 h后展青霉素含量变化不大,处于稳定状态。Fuchs等[23]筛选到一株动物双歧杆菌VM 12,培养4 h后,对浓度为1 μg/mL的展青霉素的清除率达到78%,且该动物双歧杆菌VM 12对展青霉素的去除效率依赖于有活性的完整菌体。以上结果表明,L.plantarumYZU02活菌对展青霉素清除作用显著。但是,展青霉素含量在18 h后降低幅度有限,处于稳定状态。这可能与YZU02清除展青霉素的特性相关,因此后续需要对L.plantarumYZU02清除展青霉素的特性进行进一步研究。

图3 L. plantarum YZU02对展青霉素的清除作用Fig.3 Degradation of patulin by L. plantarum YZU02注:CK:对照组(只含展青霉素);L. plantarum YZU02:L. plantarum YZU02活菌+展青霉素。
2.3.2 胞内酶对展青霉素的降解作用 对L.plantarumYZU02胞内酶对展青霉素的降解作用进行了研究,分析了L.plantarumYZU02胞内酶,以及经展青霉素刺激后的胞内酶对展青霉素的降解作用。结果如图4所示,展青霉素在不同处理、不同时间点(0、9、18、27 h)的含量均保持稳定,维持在10.9 μg/mL左右。结果说明L.plantarumYZU02的胞内酶对展青霉素几乎没有降解作用,且经展青霉素刺激后的L.plantarumYZU02的胞内酶同样对展青霉素没有降解作用。酵母菌胞内酶降解展青霉素的研究较多,比如郑香峰等[4]研究发现卡利比克毕赤酵母对展青霉素的降解作用是在可诱导的胞内酶的作用下进行的。乳杆菌胞内酶降解真菌毒素的报道少见,Megalla等[24]筛选到一株乳酸乳球菌ATCC-11454,可以生物降解黄曲霉毒素B1,但并没有说明是胞内酶降解。龚雪等[25]研究发现,乳杆菌LB-11可以生物降解展青霉素,但具体是什么物质负责降解展青霉素并未指明。此研究结果也表明L.plantarumYZU02对展青霉素的降解作用并非是胞内酶的降解作用。

图4 L. plantarum YZU02胞内酶对展青霉素的降解作用Fig.4 Degradation of patulin by intracellular enzymes of L. plantarum YZU02注:L. plantarum YZU02:L. plantarum YZU02的胞内酶;L. plantarum YZU02+Patulin:经展青霉素刺激后的胞内酶。
2.3.3 胞外代谢物对展青霉素的清除作用 对L.plantarumYZU02胞外代谢物对展青霉素的清除作用进行了研究。结果如图5所示,L.plantarumYZU02的胞外代谢产物对展青霉素清除作用非常有限,在36 h后展青霉素含量仍高达7.8 μg/mL。但是,胞外代谢物处理后,展青霉素的浓度有所下降,这可能是L.plantarumYZU02胞外代谢物种存在某些成分能够与展青霉素发生相互作用,导致展青霉素含量的下降[4]。结果可以表明L.plantarumYZU02的胞外代谢物并不能清除展青霉素。

图5 L. plantarum YZU02胞外代谢物对展青霉素的清除作用Fig.5 Degradation of patulin by extracellular metabolites of L. plantarum YZU02
2.3.4 细胞壁对展青霉素的吸附作用 有研究表明,有些乳酸菌对展青霉素的清除来自于细胞壁的吸附作用[26],因此对L.plantarumYZU02细胞壁对展青霉素的吸附作用进行了研究。结果如图6所示,在0 h刚加入展青霉素后,展青霉素含量逐渐下降,说明L.plantarumYZU02细胞壁对展青霉素有一定的吸附作用。到18 h时,展青霉素含量降低至5.32 μg/mL,63 h后降低至的5.10 μg/mL。Shaimaa Hatab研究发现,灭活的鼠李糖乳杆菌和屎肠球菌均能通过细胞壁的吸附作用将苹果汁中浓度为0.1 μg/mL的展青霉素在24内分别降低80.4%和64.5%。进一步研究发现乳酸菌细胞壁表面的多糖和蛋白质与细胞壁对展青霉素的吸附作用相关[27]。而这些蛋白质或多糖在细胞壁中的数量是固定的,当其吸附达到饱和时,游离展青霉素浓度便维持在稳定状态。本研究结果也发现,展青霉素含量在18~63 h之间基本维持稳定。由以上分析可以看出L.plantarumYZU02细胞壁对展青霉素的吸附作用,是其清除展青霉素的主要途径。

图6 L. plantarum YZU02细胞壁对展青霉素的吸附作用Fig.6 Adsorption of patulin by cell wall of L. plantarum YZU02
3 结论与展望
综合研究结果,得到以下结论:首先筛选出1株对展青霉素具有高效降解作用的乳酸菌,经鉴定为L.plantarumYZU02;L.plantarumYZU02的胞内酶、胞外代谢物对展青霉素没有降解作用;L.plantarumYZU02主要通过细胞壁的吸附作用去除展青霉素。细胞壁对毒素的吸附作用是由乳酸菌的生物量决定的。因此通过增加菌的生物量可以增强其对展青霉素的去除效果。此外,可以通过与具有生物降解作用的乳杆菌制成混合菌剂达到去除食品中展青霉素污染的作用。

