V2O5/MXene纳米复合材料制备及储能性能
黄莹莹,李庚辉,赵 博,路金林,亢淑梅,陈书文
辽宁科技大学材料与冶金学院,鞍山 114051
电化学超级电容器是连接电池和传统电容器的桥梁,具有充放电速度快、容量大、功率密度高、使用寿命长和维护成本低等优点[1−4]. 超级电容器已经被广泛应用于混合动力电动汽车、微型自动电动机器人和备用电源等系统中[5−6]. 根据不同的电荷储存机制,电化学超级电容器可分为双电层电容器和赝电容电容器. 双电层电容器主要是依赖于电极-电解液界面处的正负电荷静电吸附,其类似于传统的双电层电容器;赝电容电容器主要依赖于电极表面活性材料的快速氧化还原反应,活性材料主要包括金属氧化物和导电聚合物等[7−10]. 目前,五氧化二钒(V2O5)及其相关化合物因其具有层状结构,良好的物理化学性质,价格低廉,资源丰富,理论比电容大,而受到越来越多的关注. 它们被广泛应用于可逆锂电池、催化剂、超级电容器和激光屏蔽阴极材料等领域. 由于储能元件的电化学性能与电极材料的形貌和晶体结构密切相关,因此研究人员已经成功制备出了新型结构的V2O5,包括纳米多孔结构、薄膜、三维结构的V2O5纳米片以及V2O5纳米多孔网络等. 当V2O5作为电极材料被应用于超级电容器中时,电解质中的离子在吸附-脱附过程中使电极材料的体积膨胀直至结构崩塌,这种现象会导致V2O5电极材料具有较低的导电性和循环稳定性.
MXene是一系列二维层状金属碳化物或氮化物,具有高电导率、表面易改性、机械强度高和亲水性好等优点[11];MXene (Ti3C2Tx)本身具有导电性能优良的二维碳层结构,且其表面含有大量的羟基官能团,具有较多的氧化还原活性位点,然而MXene材料在充放电过程中易产生重新堆叠团聚的问题,这严重降低了MXene纳米片层的电化学利用率,使其电子传输和离子扩散能力下降,减小电极材料的电容量、电容器的能量密度,直接降低了超级电容器的储能性能;V2O5理论比电容大,但是在充放电过程中结构容易崩塌. 针对上述问题,本文通过水热法将纳米V2O5插入到MXene层间,将MXene与V2O5复合可以扩大MXene的层间距同时抑制其堆叠现象,而且MXene可以起到支撑作用,在充放电过程中有效缓解了V2O5的结构坍塌 ,所制备的纳米复合电极材料在1.0 mol·L−1LiNO3中表现出了较好的电化学性能.
1 实验材料及方法
1.1 实验材料
Ti粉(99%,300 目),Al粉(99%, 直径为 10 μm),C 粉(99%,直径为 6.5 μm),氢氟酸(HF),二甲基亚砜(DMSO),二水合草酸(H2C2O4·2H2O),五氧化二钒(V2O5),硫酸钠(Na2SO4),硝酸锂(LiNO3),1-甲基-2-吡咯烷酮,乙炔黑,聚偏氟乙烯(PVDF),无水乙醇和去离子水,所用试剂均为分析纯.
1.2 实验方法
1.2.1 多层 MAX 相的制备
本实验中的MAX相是通过固-液反应合成法制备的,将 Ti,Al和石墨粉末以摩尔比为3∶1.1∶1.8的比例加入到行星式球磨机中,并向其中加入无水乙醇和玛瑙球混和搅拌12 h,然后在空气中 70 °C 下干燥 8 h. 再将混合物放入石墨模具中单轴冷压成生坯. 随后,将生坯与模具一起放在高温管式炉中在氩气气氛下加热至1550 °C,并保温2 h,最后将样品自然冷却至室温.
1.2.2 MXene 的制备
在室温下,取2 g上述制备的MAX相浸入20 mL HF(6.0 mol·L−1)中 48 h 后用去离子水反复洗涤直至pH值约为4.0左右. 用超声波细胞粉碎机以脉冲模式超声处理1 h以获得悬浮液,然后将悬浮液2000 r·min−1离心 30 min 以除去大块颗粒,得到质量浓度约为 20 g·L−1的黑色 MXene 水分散液,随后向其中加入10 mL DMSO扩大MXene的层间距. 分层后的MXene被命名为D-MXene.
1.2.3 NBV/MXene 和 NSV/MXene 的制备
将0.5 g MXene,1.82 g V2O5和0.63 g H2C2O4·2H2O溶于75 mL去离子水中并在室温下磁力搅拌0.5 h.然后将上述混合物移至100 mL不锈钢高压反应釜中并升温至 180 °C 保温 48 h. 待样品冷却至室温后,用去离子水和无水乙醇将其反复洗涤几次后 75 °C 干燥 8 h. 最后将样品放置马弗炉中,空气气氛下以 5 °C·min−1速率升至 550 °C 并保温 5 h 便得到NBV/MXene.
NSV/MXene 的制备过程中需要 1.89 g H2C2O4·2H2O,其余过程与NBV/MXene的制备过程一致.NSV/MXene和NBV/MXene的制备过程示意图如图1.
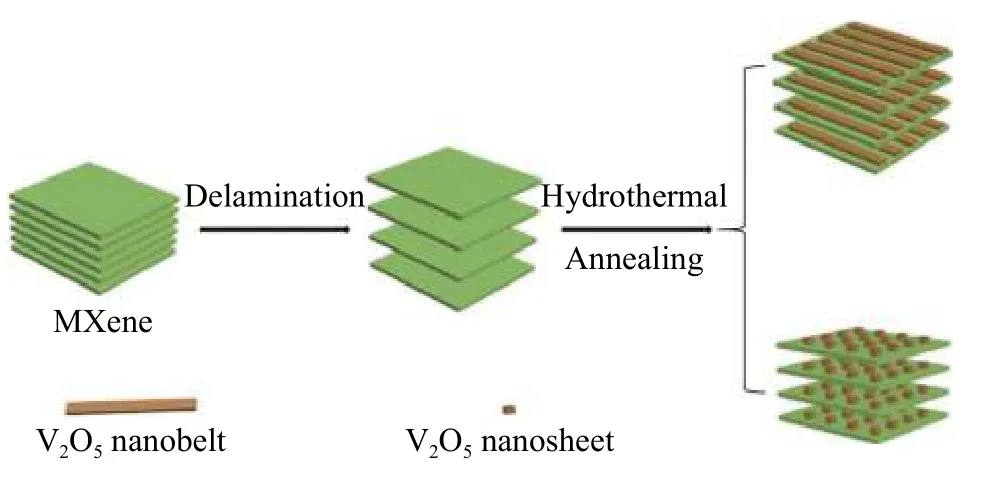
图1 NBV/MXene 和 NSV/MXene 的制备过程Fig.1 Fabrication procedure for NBV/MXene and NSV/MXene
1.3 复合材料的结构表征
采用X光衍射仪(PANANO)对样品进行晶体结构分析,Cu Kα 射线,扫描范围:10°~90°,X 射线的波长0.154060 nm;利用场发射扫描电子显微镜(FESEM,ZEISS ΣIGMA)对样品的形貌、微观结构以及能量色散进行分析;利用傅里叶红外光谱分析仪(Agilent Technologies Cary 630)对样品进行红外测试,波长范围:600~4000 cm−1;在波长为514 nm激光激发下,利用拉曼光谱分析仪(Renishaw)对样品进行分析;利用X射线光电子能谱分析仪(Al K Alpha Large Area XL)对样品的元素进行定性分析,然后使用XPS peak 41软件对曲线进行拟合;样品的比表面积测试利用比表面积分析仪(ASAP 2460)测定.
1.4 电化学性能测试
将80 mg 活性物质(NBV/MXene 和NSV/MXene),10 mg PVDF 和 10 mg 乙炔黑溶于一定量 1-甲基-2-吡咯烷酮中并磁力搅拌4 h形成浆料,将浆料涂覆在尺寸为 1.5 cm×1.5 cm的泡沫镍上,然后将涂好的泡沫镍放在真空干燥箱中 80 °C 干燥 4 h,将干燥好的泡沫镍用压片机在8 MPa下进行压片. 最后对电极片进行称量,选出活性物质质量为3~6 mg的电极片进行电化学性能测试.
以上述电极为工作电极,饱和甘汞电极(SCE)作为参比电极,铂电极作为辅助电极,组成三电极体系,利用CHI760E电化学工作站(上海辰华仪器有限公司)进行循环伏安(CV)、恒流充放电(GCD)和交流阻抗测试(EIS). 其中电解液为1.0 mol·L−1LiNO3和 1.0 mol·L−1Na2SO4,电压窗口为−0.4~0.8 V,循环伏安扫描速率取 2,5,10,20,50 和 100 mV·s−1,恒流充放电的电流密度为 1,2,3,4 和 5 A·g−1,在开路电压下测试交流阻抗,频率范围为 105~0.01 Hz.
2 结果与讨论
2.1 化学与结构分析
图2(a)是 MXene、D-MXene、NBV/MXene和NSV/MXene的X射线衍射图谱,由MXene和DMXene的图谱可以观察到被分层后的D-MXene的峰向小角度偏移并且半峰宽增加,说明其无序化和层 间距增加[12−14]. 由 NBV/MXene 和 NSV/MXene的图谱可以观察到在 2θ值为 15.4°,20.3°,21.7°,26.1°,31.1 °,32.4°,34.3°,45.5°,47.3°和 51.2°出现衍射峰,与 JCPDS (No.00 - 030 - 0820) X 射线衍射标准卡比对可知它们分别与(200),(00),(101),(110),(301),(011),(310),(411),(600)和(020)晶面相对应,可以证明有V2O5晶体的存在. 此外,在NBV/MXene和NSV/MXene图谱中可以观察到TiC、和TiO2宽峰,与MXene相比峰强被削弱,暗示着在MXene表面已经合成V2O5晶体[15−17].
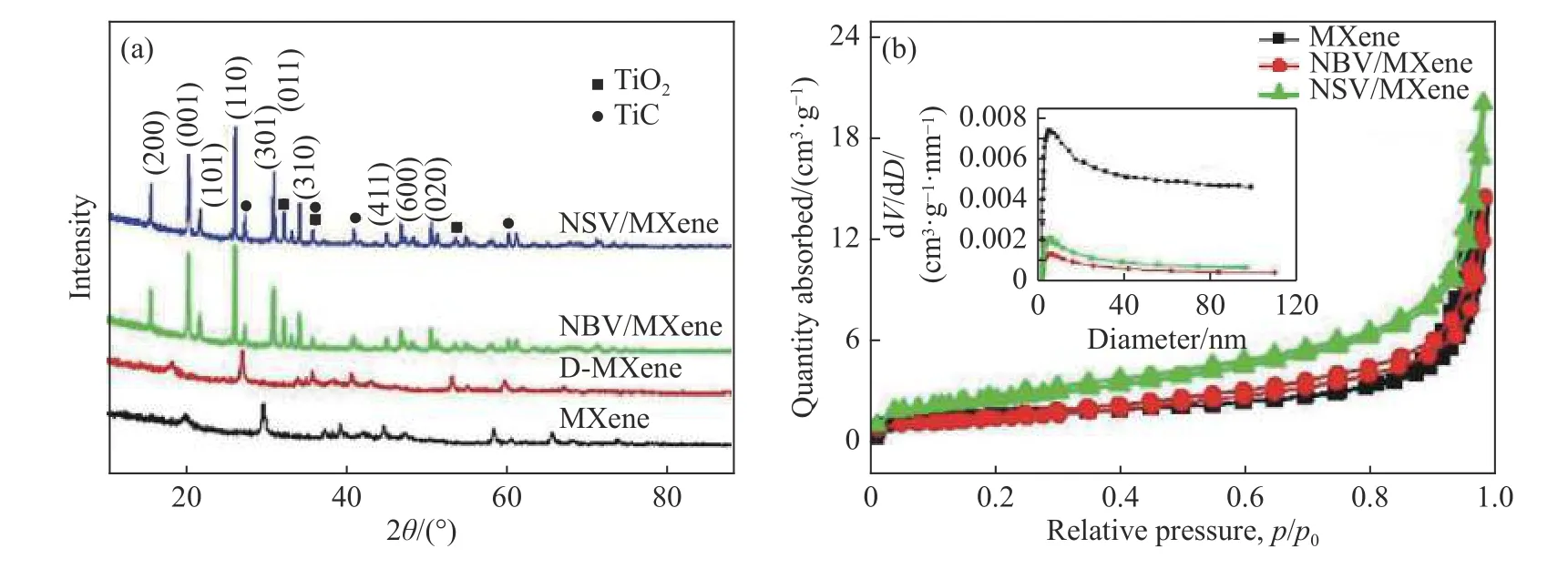
图2 试样的X射线衍射图谱(a)和氮气吸附-脱附等温曲线(b)(插图为内部孔径尺寸分布曲线)Fig.2 XRD patterns (a) and N2adsorption/desorption isotherms (b) of the different samples (inset showing the plots of pore size distribution)
图2(b)是样品氮气吸附/脱附等温曲线,其中p为吸附质分压,p0为吸附剂饱和蒸汽压,V是孔容,D是孔径. MXene、NBV/MXene和 NSV/MXene的比表面积分别为 4.3, 4.4, 8.7 和 5.5 m2·g−1. NBV/MXene和NSV/MXene的比表面积与MXene相比均有所提高,因此可以证明V2O5已经成功被负载到MXene表面.
样品的傅里叶红外光谱如图3(a)所示,NBV/MXene和NSV/MXene的红外光谱1004和1005分别出现吸收峰是由于V=O 双键伸缩振动所致,在778和840 cm−1分别出现吸收峰是由于在V=O和V-O-V之间出现耦合振动所致. 图3(b)是样品的拉曼光谱,NBV/MXene和NSV/MXene的拉曼光谱在 140, 283, 407, 478, 525, 696 和 993 cm−1处 出 现V2O5的特征峰[18]. MXene的拉曼光谱在 150 cm−1处出现特征峰,说明有TiO2锐钛矿的存在,在其它样品中其峰强减弱并且拉曼位移增加. 三种样品均在410和610 cm−1处出现特征峰是由于TiC的存在. 以上分析结果与X射线衍射的分析结果一致. MXene、NBV/MXene和 NSV/MXene的元素组成分析采用了能量散布分析仪进行测试,其测试结果如图3(c)所示,可以观察到NBV/MXene和NSV/MXene样品中均有Ti、C、V和O元素,测试结果可以说明纳米复合物中有V2O5存在,并通过计算得出NSV/MXene和NBV/MXene中V2O5的质量分数分别为72%和67%.
利用场发射扫描电子显微镜对样品的表面形貌进行了测试表征,如图4所示. 从图4(a)可以清晰地看到它是由许多片层堆叠而成的. 图4(b)显示MXene表面上有大量纳米带,长度可达几十微米,平均宽度约150 nm. 当草酸的使用量增加到1.89 g 时,NSV/MXene被合成,如图 4(c). 从场发射扫描电子显微镜图像我们可以观察到,MXene表面上的纳米粒是有许多微小的纳米薄片组成.在相同保温时间、煅烧温度的条件下,当添加草酸的质量为0.63 g时,V2O5呈带状,当草酸质量增加至1.89 g时,V2O5呈片状,可见草酸加入量是影响V2O5形貌的主要因素.
图5是样品的X射线光电子能谱图,从图5(a)中可以看出3种样品的Ti2p的结合能为464和458 eV,V2p 结合能均为 524 eV 和 517 eV,O1s的结合能均为 532 eV,C1s的结合能均为 285 eV,采用XPSPEAK软件分别对Ti和V两种元素进行分峰,使用 Shirley型背景,并选择p峰型. 从图 5(b),5(c)和 5(d)中可以看出,MXene、NBV/MXene和NSV/MXene的Ti2p1/2结合能分别为464.7,464.1和464.2 eV,Ti2p3/2的结合能为458.9, 458.3 和458.4 eV,Ti2p1/2和Ti2p3/2结合能的差值均为5.8 eV. 如图5(e)和 5(f)所示,NBV/MXene和 NSV/MXene的 V2p1/2的结合能分别为524.5和524.6 eV,V2p3/2的结合能分别为517.1和517.2 eV,V2p1/2和V2p3/2结合能差值均为7.4 eV. 此结果与文献中的Ti3C2Tx的MXene的Ti2p1/2和Ti2p3/2,V2O5的V2p1/2和V2p3/2的数据相一致,因此可以证明MXene表面已经成功负载了V2O5[10,18].
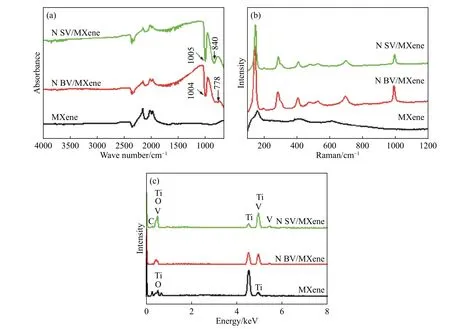
图3 试样的傅里叶红外光谱图(a),拉曼光谱曲线(b)和能量散布分析光谱(c)Fig.3 FTIR (a), Raman spectra (b), and EDS spectra (c) of samples

图4 试样的场发射扫描电子显微镜照片. (a)MXene;(b)NBV/MXene;(c)NSV/MXeneFig.4 FESEM images of samples:(a) MXene; (b) NBV/MXene; (c) NSV/MXene
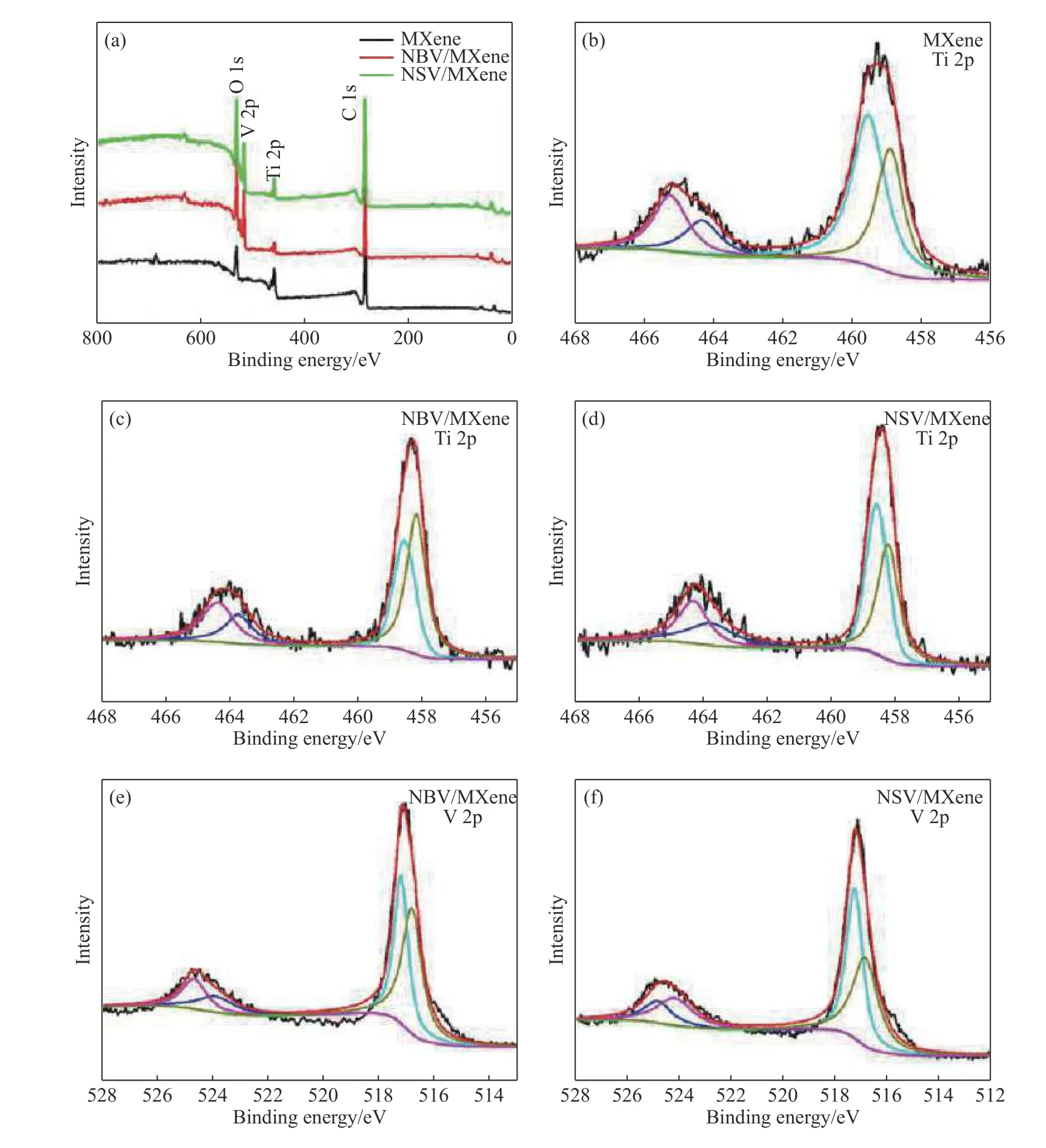
图5 试样的 X 射线光电子能谱. (a)试样的 X 射线光电子能总谱;(b~d) 3 种样品的 Ti2p 谱图;(e)NBV/MXene的 V2p 谱图;(f)NSV/MXene的V2p谱图Fig.5 XPS full survey scan spectra:(a) XPS full survey scan spectra for all samples; (b-d) deconvolution of Ti2p peaks of three samples; deconvolution of V2p peaks of NBV/MXene (e) and NSV/MXene (f)
2.2 电化学性能分析
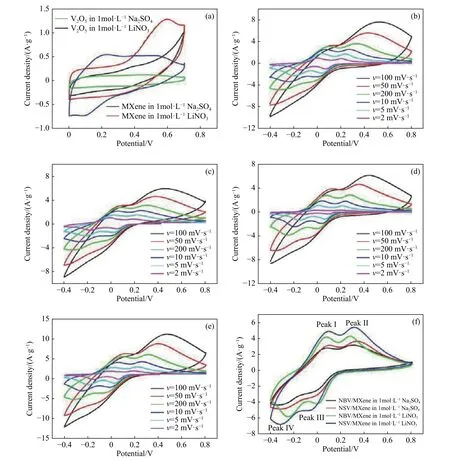
图6 循环伏安曲线. (a)MXene 和纯 V2O5电极材料在 20 mV·s−1 时;(b)NBV/MXene 在 1 mol·L−1 Na2SO4;(c)NSV/MXene 在 1 mol·L−1 Na2SO4;(d)NBV/MXene 在 1 mol·L−1 LiNO3;(e)NSV/MXene 在 1 mol·L−1 LiNO3;(f)NBV/MXene 和 NSV/MXene 在 20 mV·s−1 时Fig.6 CV curves:(a) MXene and pure V2O5at 20 mV·s−1; (b) NBV/MXene in 1 mol·L−1 Na2SO4; (c) NSV/MXene in 1 mol·L−1 Na2SO4;(d) NBV/MXene in 1 mol·L−1 LiNO3; (e) NSV/MXene in 1 mol·L−1 LiNO3; (f) NBV/MXene and NSV/MXene at 20 mV·s−1
图6是3种样品的循环伏安曲线,由图可看出,所有曲线均出现两对氧化还原峰,且当扫描速率越低氧化还原峰越明显,展现了良好的赝电容特性. 当扫描速率较高时氧化峰发生正向移动,还原峰发生负向移动且氧化还原峰间距增加,主要是因为扫描速率增大,短时间内电极上吸附了大量电解液离子,使得电极-电解液界面上的离子浓度急速下降,然而电解液中离子扩散速率相对较慢,因此界面上的离子数目不能满足电极充放电所需离子数,所以外电压即使不断上升,电极上储存电荷的速度却很慢,从而使循环伏安曲线发生倾斜. 图 6(a)是 MXene和纯 V2O5电极材料在20 mV·s−1时分别在两种电解液中的循环伏安曲线的对比图,图中可以明显的观察到无论是MXene 还是纯 V2O5电极片在 1.0 mol·L−1LiNO3的循环伏安曲线所围成的面积较大,因此两种电极片在 1.0 mol·L−1LiNO3电解液中电化学性能较好.图 6(b)和 6(c)分别为 NBV/MXene和 NSV/MXene的循环伏安曲线,电解液为 1.0 mol·L−1Na2SO4,电压窗口为−0.4~0.8 V,扫描速率为 2,5,10,20,50和 100 mV·s−1. 由图可看出,NBV/MXene 的循环伏安曲线在 0.02和 0.33 V出现两个氧化峰,在−0.05和−0.32 V 出现两个还原峰;NSV/MXene的循环伏安曲线在0.10 和0.31 V出现两个氧化峰,在 0.02 和−0.24 V 处出现两个还原峰. 图 6(d)和6(e)为 NBV/MXene和 NSV/MXene电极材料在1.0 mol·L−1LiNO3电解液中的循环伏安曲线,NBV/MXene的循环伏安曲线在0.08和0.33 V出现两个氧化峰,在−0.06和−0.32 V 出现两个还原峰;NSV/MXene的循环伏安曲线在0.1和0.33 V出现两个氧化峰,在−0.04和−0.32 V处出现两个还原峰.图 6(f)是 NBV/MXene和 NSV/MXene电极材料在扫描速率为 20 mV·s−1电解液分别为 1.0 mol·L−1Na2SO4和 1.0 mol·L−1LiNO3的循环伏安曲线对比图,由图可看出 NSV/MXene 在 1.0 mol·L−1LiNO3电解液中的循环伏安曲线所围成的面积最大,这就意味着其具有最大的比电容量[19].
在循环伏安测试中,在不同的电压扫描速率下,得到不同的峰电流值. 通过将扫描速率与所得的峰电流的对应关系来分辨电极材料在充放电过程中是扩散行为还是赝电容行为. 若是电池行为,则峰电流i随扫速v的0.5次方变化,即过程为扩散控制;若是赝电容行为,则峰电流i随扫速ν线性变化,即过程为电容控制. 因此可以通过计算公式中i=avb的b值来判断电极材料在充放电中是否有赝电容行为. 当b<0.5时,电极材料表现为电池属性;当0.5
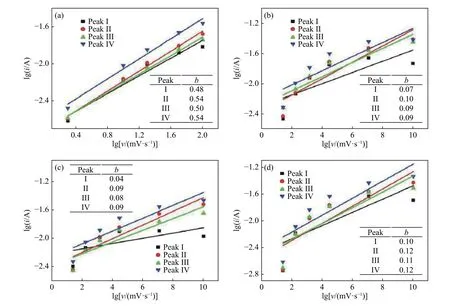
图7 不同扫速下的 lgi和 lgv线性拟合图. (a)NBV/MXene 在 1 mol·L−1 Na2SO4;(b)NSV/MXene 在 1 mol·L−1 Na2SO4;(c)NBV/MXene 在1 mol·L−1 LiNO3;(d)NSV/MXene 在 1 mol·L−1 LiNO3Fig.7 lgivslgvlinear fit at different scan rates:(a) NBV/MXene in 1 mol·L−1 Na2SO4; (b) NSV/MXene 1 mol·L−1 Na2SO4; (c) NBV/MXene in 1 mol·L−1 LiNO3; (d) NSV/MXene in 1 mol·L−1 LiNO3
在循环伏安测试中,电流与扫描速率的关系是区分电荷存储机理的有效方法. 这种评估方法的基础是双电层电容过程的电流与扫速(v)成正比,扩散过程的电流与v1/2成正比. 在循环伏安过程中,当扩散控制过程和电容控制过程同时存在时,特定电压V下的电流iV可表示为iV=k1v+k2v1/2,其中k1和k2为可以调整的参数. 此式两边除以v1/2后便可得到iV/v1/2=k1v1/2+k2,采用Origin软件对iV/v1/2和v1/2进行线性拟合进而得到k1值,每个特定的电压下都对应一个拟合的k1值. 在每个特定电压下k1v即为赝电容对电流的贡献. 将众多的特定电压与之对应的k1v通过平滑曲线连接起来,进行非线性拟合. 然后对拟合的闭合曲线积分求面积,再对特定扫速下的循环伏安曲线进行积分求面积. 将拟合曲线的面积除以循环伏安曲线面积所得的值即为特定扫速下的赝电容贡献率[21−23].如图8为NBV/MXene和NSV/MXene在不同电解液中在 50 mV·s−1下的赝电容贡献率. 经计算得NBV/MXene 和 NSV/MXene 在 1 mol·L−1Na2SO4中的赝电容贡献率分别为33.5%和40.4%,NBV/MXene和 NSV/MXene 在 1 mol·L−1LiNO3中的赝电容贡献率分别为43.2%和41.5%.
为了进一步测试样品的电化学性能,将样品进行了恒流充放电测试,图9是样品的恒流充放电曲线. 图 9(a)是 MXene和 V2O5分别在两种电解液(1.0 mol·L−1Na2SO4和 1.0 mol·L−1LiNO3)中、电流密度为1 A·g−1时的恒流充放电曲线对比图.从图中可以看出:MXene和V2O52种电极片在1.0 mol·L−1LiNO3中 明 显 比 在 1.0 mol·L−1Na2SO4电解液中放电时间长,其中 MXene 在 1.0 mol·L−1LiNO3电解液中的比电容为64.6 F·g−1而在1.0 mol·L−1Na2SO4电 解 液 中 的 比 电 容 为 8.1 F·g−1,V2O5在1.0 mol·L−1LiNO3电解液中的比电容为 46.7 F·g−1而在 1.0 mol·L−1Na2SO4电解液中的比电容为 15.7 F·g−1;说明这两种材料在 1.0 mol·L−1LiNO3电解液中的比电容更大一些. 由图9(b~e)可看出样品的恒流充放电曲线均出现两个电位平台,与循环伏安曲线中的氧化还原峰一致,这表明法拉第赝电容引起的电容远高于双电层电容. 恒流充放电曲线在高电位出现陡峭现象是由电极-电解液界面发生氧化还原反应所致. 图 9(b)和 9(c)分别是 NBV/MXene和NSV/MXene的恒流充放电曲线,电解液为 1 mol·L−1Na2SO4,电压窗口为−0.4~0.8 V,电流密度为 1,2,3,4 和 5 A·g−1. 如图 9(d)和 9(e)根据公 式Cs=I·t/(m·V)(式 中Cs(F·g-1) ,I(A),t(s),m(g)和V(V)分别代表比电容,放电电流,放电时间,活性物质质量和窗口电位)计算得出NBV/MXene 和 NSV/MXene 在 1.0 mol·L−1Na2SO4电解液中的比电容分别为 88.5 和 96.8 F·g−1,体积比电容分别为 106 和 116 F·cm−3;NBV/MXene 和 NSV/MXene 在 1.0 mol·L−1LiNO3电解液中的比电容分别为 114 和 180 F·g−1,体积比电容分别为 137 和216 F·cm−3. 图 9(g)展示了 NBV/MXene和 NSV/MXene在两种电解液中不同电流密度下的比电容的计算曲线,由图可知 NSV/MXene 在 1.0 mol·L−1LiNO3电解液中具有最高的比电容. 同时可以观察到电极材料的比电容随着电流密度的增加而降低,这是由于电解质传输的极化,粒子扩散或电荷转移所致[24−25].
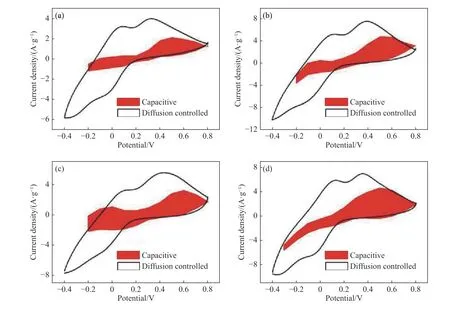
图8 扫速为 50 mV·s−1的不同试样的赝电容贡献率. (a)NBV/MXene 在 1 mol·L−1 Na2SO4;(b)NSV/MXene 在 1 mol·L−1 Na2SO4;(c)NBV/MXene 在 1 mol·L−1 LiNO3;(d)NSV/MXene 在 1 mol·L−1 LiNO3Fig.8 Pseudocapacitance contribution rate of samples at 50 mV·s−1:(a) NBV/MXene in 1 mol·L−1 Na2SO4; (b) NSV/MXene in 1 mol·L−1 Na2SO4;(c) NBV/MXene in 1 mol·L−1 LiNO3; (d) NSV/MXene in 1 mol·L−1 LiNO3
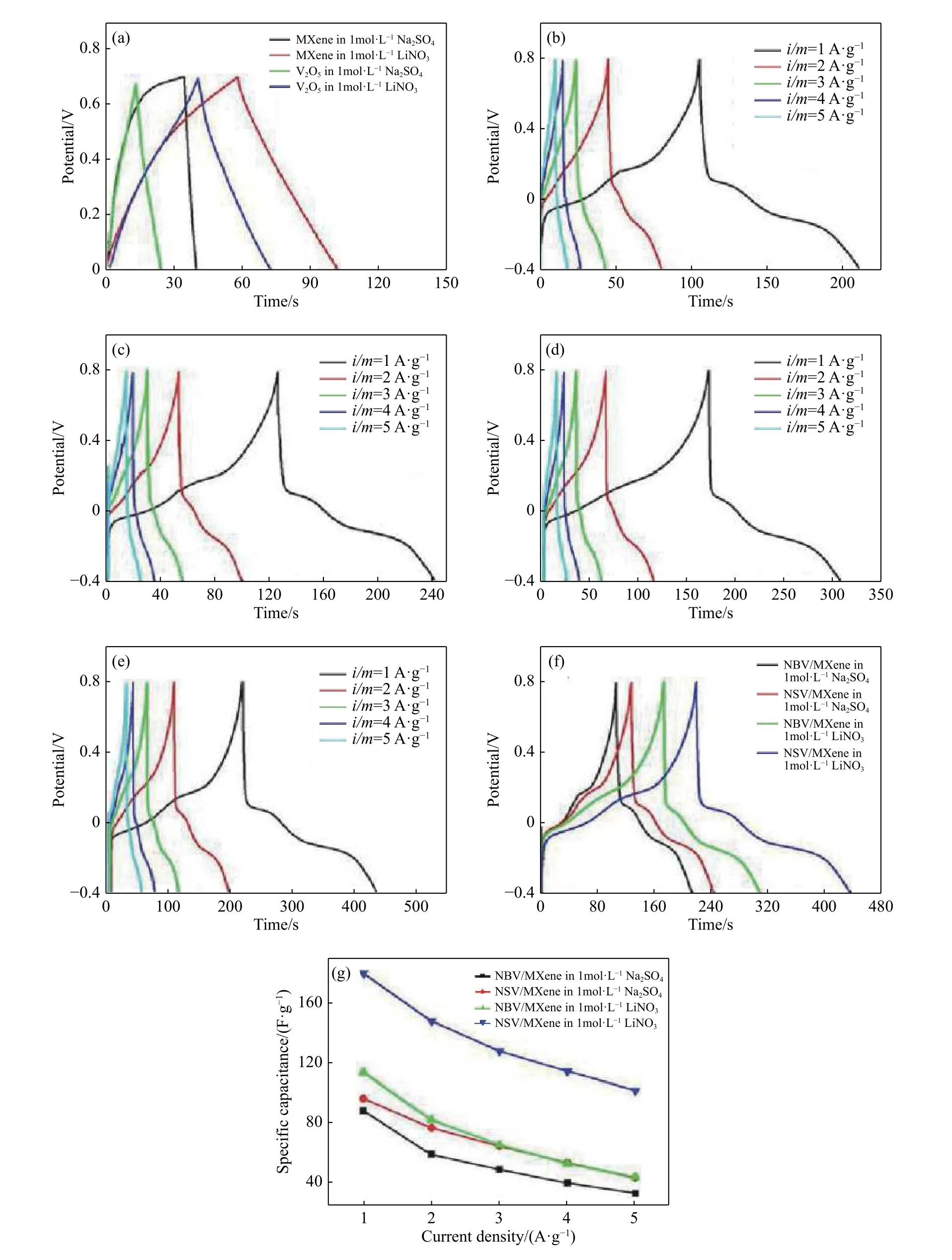
图9 (a)MXene 和纯 V2O5电极材料在 1 A·g−1时分别在两种电解液中的恒流充放电曲线对比图;(b)NBV/MXene 在 1 mol·L−1 Na2SO4,(c)NSV/MXene 在 1 mol·L−1 Na2SO4,(d)NBV/MXene 在 1 mol·L−1 LiNO3和(e)NSV/MXene 在 1 mol·L−1 LiNO3的恒流充放电曲线;(f)NBV/MXene 和 NSV/MXene 在 1 mol·L−1 Na2SO4,NBV/MXene 和 NSV/MXene 在 1 mol·L−1 LiNO3在 1 A·g−1的恒流充放电曲线对比图;(g)不同样品在不同电解液中不同电流密度电容量对比图Fig.9 (a) GCD curves of MXene and pure V2O5at 1 A·g−1 in different electrolytes; GCD curves for NBV/MXene in 1 mol·L−1 Na2SO4(b), NSV/MXene in 1 mol·L−1 Na2SO4(c), NBV/MXene in 1 mol·L−1 LiNO3(d), and NSV/MXene in 1 mol·L−1 LiNO3(e); (f) GCD curves of the electrode materials at 1 A·g−1 in different electrolytes; (g) comparison diagram of specific capacitance for different samples at different densities in different electrolytes
从图10可以看出,每条Nyquist曲线都由两部分组成:高频区域的半圆环和低频区的陡直直线[26].高频区域与X轴的截距反应了体系的等效串联电阻(Rs),主要由材料本身的内阻,电极-电解液接触电阻和电解液电阻等;圆环的直径反应了电荷转移电阻(Rct);低频区的直线反应电解液中的电荷在电极表面的扩散电阻. 由图10(a)可以看出MXene 在 1.0 mol·L−1LiNO3电解液中的Rs较低,而 V2O5在 1.0 mol·L−1Na2SO4电解液中的Rs较低,但二者 在 1.0 mol·L−1LiNO3电 解液中的Rct均较低. 由图10(b)可以得出NBV/MXene 和NSV/MXene在 1.0 mol·L−1LiNO3电 解液 中Rs分 别 为 3.86 和2.95 Ω,Rct分别为 2.84和 2.12 Ω;NBV/MXene和NSV/MXene 在 1.0 mol·L−1Na2SO4电解液的Rs分别为 2.79 和 2.69 Ω,Rct分别为 5.44 和 1.85 Ω. 由此可得出 NSV/MXene 在 1.0 mol·L−1LiNO3电解液中的Rct最低,这应归功于此电极材料的结构特征,为离子和电子提供了高效的传导途径[27−29].
3 结论
(1)通过水热法在MXene表面成功地负载了带状和片状纳米五氧化二钒颗粒. 此种方法不但扩大了MXene的层间距还使复合后的纳米材料具有更好的电化学性能.
(2)NBV/MXene和 NSV/MXene作为超级电容器电极材料在Na2SO4和LiNO3电解液中均有良好的电容特性. 尤其NSV/MXene具有较大的比表面积以及特殊的结构,使其在 1 mol·L−1LiNO3电解液中的比电容最大.
(3)以MXene作为支撑材料并采用水热法在其表面负载金属氧化物是简便易行的. 经过结构表征和电化学性能测试后说明NSV/MXene是一种很有潜力的超级电容器电极材料.

