长链非编码RNA MEF2C-AS1调控成骨细胞功能的机制研究
何洋洋,王力刚,赵玉驰
(1.南华大学附属邵阳医院 骨科,湖南 邵阳 422000;2.深圳市盐田区人民医院骨科,广东 深圳 518000)
骨质疏松症被定义为全身性、进行性骨骼疾病,其特点是骨形成与骨吸收之间的不平衡引起骨强度下降从而导致骨折风险增加。骨质疏松的治疗以药物治疗为主,根据具体治疗机制的不同,可大致分为基础补充剂、减少骨吸收剂及促进骨合成剂。近年来,人们一直探索着治疗骨质疏松的新途径,其中就包括对SOST基因的研究。SOST基因位于人类基因组的17q12-21 染色体中,其编码的骨硬化蛋白通过影响Wnt/β-catenin 信号途径对成骨细胞的骨形成起抑制作用[1]。有研究发现,肌细胞增强因子2C(myocyte enhancer factors 2C, MEF2C)是SOST基因的远端增强子ECR5 依赖性SOST 表达的主要转录调节因子[2]。并且发现MEF2C敲除小鼠表达SOST,且进行性降低了40%~70%,相比对照组小鼠骨密度增加[3]。这说明MEF2C基因是骨细胞表达骨硬化蛋白所必需的。反义长链非编码RNA(long non-coding RNA, lncRNA)作为内源性RNA,与其他转录物序列互补,可在转录及转录后水平调控靶基因的表达[4]。反义基因MEF2C-AS1与正义基因MEF2C的5'UTR 区域重叠,这意味着lncRNA MEF2C-AS1 可能在MEF2C 表达和/或翻译中起作用[5]。因此本研究拟通过成骨细胞实验,观察MEF2C-AS1 对MEF2C、SOST 的作用,揭露其对骨量的潜在作用。
1 材料与方法
1.1 细胞系及培养
人成骨细胞系hFOB1.19 购自美国ATCC 菌种保藏管理中心,采用DMEM/F12 培养基+10%FBS+0.3 mg/ml G418+1%青霉素-链霉素混合溶液,于34℃、5%二氧化碳及90%相对湿度的培养箱中培养。利用人成骨细胞系分别转染pcDNA3.1a(对照组)、pcDNA3.1a-MEF2C-AS1(过表达MEF2C-AS1组)、Smart Silencer 阴性对照(阴性对照组)、lncRNA MEF2C-AS1 Smart Silencer(沉 默MEF2C-AS1 组)、pcDNA3.1a-MEF2C(过表达MEF2C 组)、pcDNA3.1a-MEF2C-AS1+pcDNA3.1a-MEF2C( 过 表 达MEF2CAS1+MEF2C 组)。
1.2 主要仪器和试剂
Tanon 2500 全自动数码凝胶成像分析系统、Tanon 5200Multi 全自动化学发光/荧光图像分析系统购自上海天能科技有限公司,Eppendorf Centrifuge 5418R 高速台式离心机购自德国Eppendorf 公司,7900HT Fast real-time PCR 系统购自美国ABI 公司,T100TMThermal Cycler PCR 仪、高流电泳仪电源、Mini-PROTEAN®Tetra 电泳槽、大型水平电泳槽购自美国Bio-Rad 公司,碱性磷酸酶(alkaline phosphatase,ALP)(型号MK300)购自北京宝日医生物技术有限公司,MEF2C、SOST(qRT-PCR 引物)、si-MEF2CAS1 购自苏州瑞博生物技术有限公司,MEF2C、SOST(人、兔抗)购自武汉爱博泰克生物技术有限公司,超敏ECL 化学发光试剂盒、SDS-PAGE 凝胶配制试剂盒、QuickblockTM封闭液、Western 转膜液、SDSPAGE 电泳液、Western 洗涤液(10X)购自上海碧云天生物技术有限公司,Phusion High-Fidelity DNA Polymerase、PowerUp SYBR Green Master Mix购自美国ThermoFisher Scientific 公司)。
1.3 质粒构建
1.3.1 构建MEF2C-AS1 的过表达载体pcDNA3.1a-MEF2C-AS1克隆MEF2C-AS1基因的mRNA 序列,设计引物: 5'-GGGGTACCAATTATTGCCGATCCTCC CC-3'(KpnⅠ)和5'-CGGGATCCTTTTTTTTTTTTTT TTTCAGAAAG-3'(BamHⅠ),由苏州瑞博生物技术有限公司合成。MEF2C-AS1基因的mRNA 片段DNA通过PCR 从cDNA 基因文库中获得,将扩增的PCR产物在含溴化乙锭的琼脂糖凝胶上电泳分离后,获取目的片段,用胶回收试剂盒回收目的片段。然后利用BamHⅠ和KpnⅠ内切酶切下PCR 产物目的片段及切开pcDNA3.1a 载体,将目的片段用T4 连接酶连接到pcDNA3.1a 载体中进行双酶切验证。
1.3.2 构建MEF2C 基因的过表达载体克隆MEF2C基因的编码序,设计过表达引物5'-CGGGATCCATG GGGAGAAAAAAGATTCAG-3' 和5'-GGGGGGCCCT CATGTTGCCCATCCTTCAG-3',通过PCR 扩增得到MEF2C的编码序列。目的基因片段从人源的cDNA中获得,PCR 扩增后回收DNA,通过限制性内切酶修饰目的片段和载体,连接转化。然后再进行双酶切验证。
1.3.3 沉默lncRNA由瑞博生物技术有限公司设计合成LncRNA MEF2C-AS1 的Smart Silencer(编号: lnc3190628021353),Smart Silencer 可以在核内和细胞质中全方位抑制LncRNA,且抑制效率高。
1.4 细胞转染
在6 孔板中培养hFOB1.19(人SV40 转染成骨细胞)至80%汇集,将质粒DNA/siRNA 按实验方案用脂质体转染试剂盒转入hFOB1.19 细胞中。
1.5 总RNA 提取及逆转录
取部分转染后的hFOB1.19 细胞,于转染48 h 后用PBS 清洗2 遍,每孔加入1 ml Trizol 试剂,按照Trizol 试剂说明书提取hFOB1.19 细胞总RNA。并按照基因组DNA 逆转录试剂盒说明书操作,将RNA 逆转录为cDNA,样本置于-20℃保存。
1.6 碱性磷酸酶成骨活性测定
收集转染3 d 的成骨细胞,采用Triton X-100 的缓冲液裂解细胞。使用ALP检测试剂盒测量ALP活性。采用ALP 染色试剂盒进行ALP 染色。
1.7 qRT-PCR
qRT-PCR检测MEF2C正向引物: 5'-GTATAGATG CTTGGACAGACCC-3',反向引物: 5'-GCAGGTTTGTG AGCATTCTTG-3',产物长度97 bp。qRT-PCR 检测SOST正向引物: 5'-TTCCGAAGAGAAGTGAAAGG TTC-3',反向引物: 5'-GTGCTGGTCTGTGAGTTTGT GAT-3',产物长度81 bp。qRT-PCR 检测18S rRNA正向引物: 5'-CGGCGACGACCCATTCGAAC-3',反向引物: 5'-GAATCGAACCCTGATTCCCCGTC-3',产物长度108 bp,所检测基因及合成内参18 S 的引物由苏州瑞博生物技术公司合成。根据ABI7500 qRT-PCR仪说明书进行操作,以18 S rRNA 为内参照。PCR 反应体系: 2×SYBR Green 5μl,正向和反向引物各0.5μl,ROXI 0.2μl,cDNA 1μl,ddH2O 2.8μl,总体系为10μl。PCR 反应条件: 95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸30 s,95℃、15 s绘制熔解曲线,共40 个循环。每个实验至少重复3 次,用2-ΔΔCt法分析。
1.8 Western blotting
取另一部分转染后的hFOB1.19 细胞用预冷PBS清洗2 遍,加适量预冷的细胞RIPA 裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),冰上裂解10 min,使用刮棒刮取培养孔中的细胞,收集裂解液,14 000 r/min离心10 min,上清即为蛋白提取液。利用考马斯亮蓝测定蛋白浓度。加入6×SDS 上样缓冲液,95℃变性5 min。配制10% SDS-PAGE 凝胶,将变性后的蛋白上样,恒压100 V 电泳2 h。电泳结束后在200 mA 恒流条件下1 h 将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,再置于5%脱脂牛奶的TBS 封闭液在摇床上封闭1 h。将抗体按比例在牛血清白蛋白中稀释,按千分之一加入叠氮化钠,使抗体和膜充分接触,4℃孵育过夜。次日,回收一抗,-20℃保存,一般抗体可重复使用,用TBST 洗膜3 次,15 min/次。根据一抗的来源选择二抗,将二抗稀释于TBS 中,常温孵育1 h,之后用TBST 洗膜3 次,10 min/次,显影。以GADPH 作为内参照,对曝光条带进行定量分析。
1.9 统计学方法
数据分析采用Graphpad Prism 8.0 软件进行统计分析及绘图。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 MEF2C-AS1 的表达对MEF2C、SOST 基因的影响
两组MEF2C、SOST mRNA 和蛋白相对表达量比较,差异有统计学意义(P<0.05),过表达MEF2CAS1 组较对照组低。说明在成骨细胞系中,lncRNA MEF2C-AS1可以抑制MEF2C 及SOST的表达。见表1和图1。
2.2 过表达MEF2C-AS1 对ALP 活性的影响
过表达MEF2C-AS1 组与对照组ALP 活性相对表达量分别为(1.024±0.013)和(0.499±0.008),经t检验,差异有统计学意义(t=58.898,P=0.000),过表达MEF2C-AS1 组较对照组高,lncRNA MEF2C-AS1能提高成骨分化过程中早期标志物ALP 的活性。见图2、3。
表1 对照组与过表达MEF2C-AS1 组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)

表1 对照组与过表达MEF2C-AS1 组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)
组别 MEF2C mRNA SOST mRNA MEF2C 蛋白 SOST 蛋白对照组 0.946±0.059 1.051±0.049 0.526±0.053 0.118±0.015过表达MEF2C-AS1 组 0.038±0.002 0.048±0.005 0.127±0.015 0.034±0.007 t 值 26.822 35.066 12.485 8.594 P 值 0.000 0.000 0.000 0.001

图1 过表达MEF2C-AS1 组与对照组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)

图2 MEF2C 提高ALP 活性

图3 过表达MEF2C-AS1 组与对照组ALP 活性 (±s)
2.3 沉默MEF2C-AS1 对MEF2C、SOST 基因表达的影响
两组MEF2C、SOST mRNA 和蛋白相对表达量比较,差异有统计学意义(P<0.05),沉默MEF2CAS1 组较阴性对照组高。结果说明抑制MEF2CAS1 能增加MEF2C、SOST 的表达,进一步验证了MEF2C-AS1 对MEF2C、SOST 的抑制作用。见表2和图4。
表2 沉默MEF2C-AS1 组与对照组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)

表2 沉默MEF2C-AS1 组与对照组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)
组别 MEF2C mRNA SOST mRNA MEF2C 蛋白 SOST 蛋白阴性对照组 0.986±0.028 0.916±0.099 0.163±0.031 0.100±0.016沉默MEF2C-AS1 组 5.039±0.576 4.087±0.263 1.180±0.152 0.571±0.071 t 值 12.177 19.532 11.329 11.230 P 值 0.000 0.000 0.000 0.000

图4 沉默MEF2C-AS1 组与阴性对照组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)
2.4 过表达MEF2C-AS1+MEF2C 基因对SOST表达的影响
经NCBI Blast 比对,笔者发现MEF2C-AS1 与MEF2C 存在反向互补配对碱基序列,反向互补片段长 度151 bp,位 于MEF2C-AS1(transcript variant 3 NR_109941.1)序列和MEF2C(XM_024446057.1)序列的5'UTR 起始(见图5)。这提示MEF2C-AS1 在某种程度上可能对MEF2C 起调控作用。各组MEF2C、SOSTmRNA 和蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较显示,过表达MEF2C组与对照组的SOST mRNA 和蛋白比较,差异有统计学意义(P<0.05),过表达MEF2C 组较对照组高,说明MEF2C 能调控SOST 的表达;过表达MEF2C-AS1组与对照组的SOST mRNA 和蛋白比较,差异有统计学意义(P<0.05),过表达MEF2C-AS1 组较对照组低;过表达MEF2C-AS1+MEF2C 组与过表达MEF2C-AS1组的SOST mRNA 和蛋白比较,差异有统计学意义(P<0.05),过表达MEF2C-AS1+MEF2C 组较过表达MEF2C-AS1 组高。结果提示在过表达MEF2C-AS1的基础上加过表达MEF2C,原本受抑制的SOST 表达有所恢复,说明在成骨细胞中MEF2C-AS1 是通过抑制MEF2C 而进一步抑制SOST 的表达。见表3和图6、7。

图5 MEF2C-AS1 与MEF2C 互补序列示意图
表3 各组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)

表3 各组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)
注: ①与对照组比较,P <0.05;②与过表达MEF2C-AS1 组比较,P <0.05。
组别 MEF2C mRNA MEF2C 蛋白 SOST mRNA SOST 蛋白对照组 0.961±0.129 0.366±0.054 0.976±0.174 0.247±0.019过表达MEF2C-AS1 组 0.062±0.005① 0.027±0.015① 0.011±0.005① 0.027±0.003①过表达MEF2C 组 4.190±0.252① 1.130±0.197① 5.737±0.420① 0.762±0.021①过表达MEF2C-AS1+MEF2C 组 0.503±0.018② 0.356±0.149② 0.511±0.007② 0.210±0.043②F 值 525.520 40.821 406.266 447.214 P 值 0.000 0.000 0.000 0.000
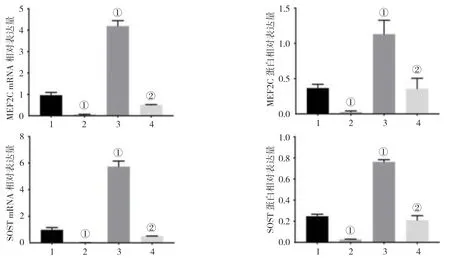
图6 各组MEF2C、SOST mRNA 和蛋白相对表达量比较 (±s)

图7 各组SOST、MEF2C 蛋白的表达
3 讨论
骨代谢需要复杂的调节控制和转录活性来支持基因表达,以响应骨形成与再吸收谱系细胞中激素、生长因子和细胞因子介导的级联反应。在人类基因组中,只有极少数被转录为蛋白质,绝大多数都是非编码RNA,根据其核苷酸长度,可分为lncRNA、Piwi互作RNA、小干扰RNA 及microRNA 等。lncRNA 是指长度>200 核苷酸的转录物家族,其不编码蛋白质。此类RNA 可调节基因表达的多个方面,包括转录、加工和转录后控制途径。同样,lncRNA 也被证实可以调节蛋白功能并组织多蛋白复合物组装。有研究表明lncRNA 可能参加细胞通信[6]。lncRNA 作为非编码RNA 的一种,主要作用机制包括: ①可以结合≥1种染色质修饰复合物并将其活性靶向特定的DNA 基因座;②介导的染色质修饰可以激活或抑制基因的表达[7];③lncRNA 转录可导致染色质重塑,影响调节因子的结合;④可以通过结合特异性转运因子来调节基因表达,从而抑制特定转录因子的核定位[6]。
反义lncRNA 是lncRNA 的一种,参与多种生物学行为,如X 染色体失活、表观遗传调控,可以通过与其他RNA 的碱基对互补,形成RNA 互补双链,调控特定靶基因的表达[4,8]。例如,反义基因RAB11BAS1与RAB11B 呈负相关,可通过RAB11B 影响骨肉瘤细胞的恶性生物学行为[9]。反义基因POSH2-AS1可正向调控靶基因POSH2,从而影响肺癌细胞[10]。笔者通过序列比对发现lncRNA MEF2C-AS1 与MEF2C存在反向互补,认为lncRNA MEF2C-AS1 能起到调控MEF2C 的作用。已有部分文献发现lncRNA 与骨质疏松的联系[11-12]。本研究着重探究lncRNA MEF2C-AS1对成骨细胞的影响,为骨质疏松的治疗探索新的分子靶点。首先过表达MEF2C-AS1 发现MEF2C、SOST的表达下降,然后抑制MEF2C-AS1 发现MEF2C、SOST 的表达升高,这提示lncRNA MEF2C-AS1 对MEF2C、SOST 的表达起抑制作用,又由于实验中的人成骨细胞系具有分化为成熟的成骨细胞功能,并可以表达正常成骨细胞的特性。提示该lncRNA 能通过抑制MEF2C、SOST 的表达,对机体骨量的增加起到积极作用。在此基础上,为了进一步明确MEF2CAS1 是通过MEF2C 影响SOST 的表达,笔者设计了拯救实验,同时过表达MEF2C-AS1 和MEF2C。实验结果显示,同时过表达MEF2C+MEF2C-AS1 组相比过表达MEF2C-AS1 组的SOST mRNA 和蛋白相对表达量升高。这一结果提示在过表达MEF2C-AS1 的基础上过表达MEF2C,使原本受抑制的SOST 表达有所恢复,说明MEF2C-AS1 是通过抑制MEF2C,从而进一步抑制SOST 的表达。
ALP 广泛分布于肝脏、骨及小肠中。特别在骨代谢研究领域被作为骨形成指标之一。ALP 由未成熟的成骨细胞分泌,可作为骨形成的早期标志物,其表达和分泌会随着成骨分化的增加而增加。本研究发现MEF2C-AS1 能提高成骨分化过程中早期标志物ALP的活性。ALP 活性增加是成骨细胞分化成熟的早期标志。这说明MEF2C-AS1 能促进成骨细胞的分化成熟,因此对增加机体骨量有潜在作用。
骨重塑包括破骨细胞的骨吸收和成骨细胞的骨形成,这是维系骨骼正常生长及退变的机制,这种紧密耦合过程的失衡将导致骨质疏松。成骨细胞和破骨细胞可以通过细胞间的直接接触,以及细胞因子和细胞外基质互相作用,彼此连通。而且成骨细胞负责骨基质的合成、分泌及矿化,并产生护骨素、核因子κB 受体活化体配体等调节破骨细胞的功能[13]。所以成骨细胞对于骨形成代谢具有重要作用。既往研究发现SOST基因编码的骨硬化蛋白对成骨细胞起负反馈作用,减少骨的形成,减少机体骨量[14]。此外,SOST基因单核苷酸多态性(single nucleotide polymorphism,SNP)位点rs2023794 和rs74252774 的多态性与大量中国绝经后女性腰椎平均骨密度有关[15]。2 期临床研究也表明,绝经后妇女注射骨硬化蛋白抗体可导致脊柱和髋部骨密度增加[16]。调控SOST 的表达似乎可以成为治疗骨质疏松的新手段。MEF2C基因可以与SOST 上游的远端增强子ECR5 结合,从而调节SOST 的表达[2]。有研究发现MEF2C基因SNP 位点rs1366594 与骨质疏松存在相关性[17]。本实验证实lncRNA MEF2C-AS1 可通过抑制MEF2C,进而抑制SOST,促进成骨细胞的分化成熟,对机体骨量的增加可能产生积极作用。而且有研究通过识别骨质疏松基因SNP 位点发现MEF2C-AS1 与骨质疏松相关[18]。这都提示lncRNA MEF2C-AS1 可通过作用于MEF2C,成为未来治疗骨质疏松的一个新靶点。但本研究主要针对MEF2C-AS1 对下游基因的表达进行检测,成骨细胞功能检测还需完善,也未涉及MEF2C-AS1 调控MEF2C 的具体机制,其更为复杂的作用仍需进一步研究证实。

