α1抗胰蛋白酶与脓毒症患者发生急性肾损伤的关系及其预测价值*
陶静,方晶晶,厉旭光,殷颖杰,黄钦,盖磊,颜碧清
(宁波大学医学院附属医院 重症医学科,浙江 宁波 315020)
脓毒症是重症监护病房最主要的危急重症之一,因引发多器官功能障碍和衰竭而死亡[1]。急性肾损伤(acute kidney injury, AKI)是脓毒症患者最常见的并发症,发病率约为30%[2]。由于脓毒症相关性AKI 的发生机制尚不明确,目前缺乏有效的防治措施,除了最基本的风险评估以外,密切监视尿量和肌酐水平变化,以及无创性评估肾脏血流灌注情况等都对发现肾实质损伤有一定的作用[3]。但是目前的监测手段和指标都具有一定的滞后性,对早期预测肾损伤的敏感性较低。近年来随着我国重症医学的日益发展,对脓毒症发生、发展机制和蛋白组学的研究越来越深入,一些潜在的生物学标志物不断被发现,例如姜伟等[4]学者通过Au 蛋白芯片技术发现α1 抗胰蛋白酶(α1-antitrypsin, α1-AT)在AKI 患者尿液中显著升高。α1-AT 属于一类急性时相炎症反应蛋白,通过抑制蛋白酶过度活化而保护组织、细胞[5]。本研究旨在探讨血清和尿α1-AT 水平变化对AKI 发生的早期预警价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年9月—2019年10月在宁波大学医学院附属医院重症医学科住院的90 例脓毒症患者。其中,男性57 例,女性33 例;年龄18 ~70 岁,平均(51.63±13.82)岁。纳入标准: ①入院时即诊断为脓毒症或住院期间发生脓毒症;②既符合中华医学会重症学分会颁布的《中国脓毒症/脓毒性休克急诊治疗指南(2018 版)》[6]关于脓毒症的诊断标准。排除标准: ①入院时已发生AKI 症状;②既往有肾移植手术史或肾脏替代治疗史,或有明确或可疑慢性肾脏疾病或恶性肿瘤;③长期服用肾毒性药物。本研究通过医院医学伦理委员会批准,患者及其家属知情同意。
1.2 分组
按照《改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes, KDIGO)AKI 临床实践指南(2012年版)》[7]推荐,符合以下情况之一即可诊断为AKI: ①48 h 内血清肌酐(serum creatinine, Scr)升高≥26.5μmol/L;②7 d 内Scr 升高≥1.5 倍;③尿量<0.5 ml/(kg·h)达6 h 以上(本研究未纳入尿量标准)。以患者入组7 d 内是否发生AKI 作为研究终点,将90例患者分为脓毒症AKI组28例和非AKI组62例。
1.3 研究方法
1.3.1 样本采集患者自入院当日或发生脓毒症当日,采取外周静脉血5 ml 置于肝素钠真空采血管(美国BD 公司)中,分离血清标本;另外采集3 ml 尿液,用于尿生化检测。随后每隔24 h采集患者外周静脉血,并留取尿液标本。观察患者7 d 内是否出现肾损伤。若7 d 内发生AKI,则血标本采集至确诊当日;若患者未发生AKI,则连续采集7 d 静脉血,保存备用。
1.3.2 治疗所有患者进行液体复苏、抗感染治疗、病因治疗、血管活性药物治疗、连续性肾替代治疗,必要时给予机械通气和血糖控制。
1.3.3 常规检测指标检测患者白细胞(WBC)、C 反应蛋白(C-reactive protein, CRP)、降钙素原(Procalcitonin, PCT)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase, AST)、尿素氮(blood urea nitrogen, BUN)、Scr 等。采用MDRD方程估算肾小球滤过率(estimated glomerlar filtration rate, eGFR)。男性eGFR=186-1.154×Scr×年龄-0.203,女性eGFR=186-0.742×Scr×年龄-0.203)。另外检测患者平均动脉压(mean arterial pressure, MAP)、心率(HR)、氧化指数(OI)、血清钾离子浓度(K+)、血清钠离子浓度(Na+)。OI=动脉血氧分压/吸入气氧浓度比值(PO2/FiO2)。
1.3.4 急性生理学与慢性健康评估Ⅱ(acute physiology and chronic health evaluations Ⅱ, APACHEⅡ)和快速脓毒症相关性器官功能衰竭评价(quick sepsis-related organ failure assessment, qSOFA) 评 分根据患者入院时生命体征检测及实验室检查结果,进行APACHE Ⅱ和qSOFA 评分。
1.3.5 血清和尿α1-AT 含量检测采用固相夹心法酶联免疫吸附检测试剂盒检测血清和尿α1-AT 含量,试剂盒购自上海润裕生物科技有限公司。板内变异系数<10%,板间变异系数<15%。实验操作者对标本和研究资料致盲。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或单因素方差分析或随机区组设计的方差分析或秩和检验,方差分析的进一步两两比较用LSD-t检验;计数资料以率(%)表示,比较用χ2检验;绘制ROC 曲线,脓毒症患者发生AKI危险因素的分析用多因素Logistic 回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
AKI 组与非AKI 组年龄、性别、基础疾病、感染部位比较,差异无统计学差异(P>0.05),具有可比性。见表1。

表1 两组临床资料比较
2.2 两组患者血清和尿α1-AT 含量比较
观察非AKI 组患者连续7 d 的检测数据,经随机区组设计的方差分析,非AKI 组患者连续7 d 血清和尿α1-AT 含量比较,差异无统计学意义(F=1.741和1.935,P=0.225 和0.174)(见图1)。因此选择非AKI 患者入组当日血清和尿α1-AT 含量作为对照数据,与AKI 组患者AKI 确诊前48 和24 h 及确诊当日的检测数据进行比较,经单因素方差分析,差异有统计学意义(P<0.05),AKI 组患者AKI 确诊前48和24 h 及确诊当日血清α1-AT 含量低于非AKI 组(P<0.05),但是尿α1-AT 含量则升高(P<0.05)。见表2。

图1 非AKI 组连续7 d 血清和尿α1-AT 含量变化趋势 (±s)
表2 非AKI 组与不同时间AKI 患者血清和尿α1-AT 含量比较 (±s)

表2 非AKI 组与不同时间AKI 患者血清和尿α1-AT 含量比较 (±s)
注: †与非AKI 组入组当日数据比较,P <0.05。
组别 n 血清α1-AT/(g/L)尿α1-AT/(mg/L)非AKI 组入组当日 62 2.23±0.76 33.59±12.84 AKI 组确诊前48 h 28 1.87±0.65† 48.56±23.39†AKI 组确诊前24 h 28 1.59±0.41† 57.81±31.45†AKI 组确诊当日 28 1.45±0.37† 84.15±35.97†F 值 13.041 27.928 P 值 0.000 0.000
2.3 脓毒症患者血清和尿α1-AT 对AKI 发生的预警或诊断价值
AKI确诊前48和24 h血清及尿α1-AT预测AKI 的曲线下面积(AUC)比较,经秩和检验,差异有统计学意义(Z=-8.235 和-4.671,均P=0.000),尿α1-AT 对AKI 的预警效能高于血清α1-AT。AKI确诊当日血清和尿α1-AT 对AKI 的诊断效能比较,差异无统计学意义(Z=-1.239,P=0.258)。
经ROC 曲线分析,AKI 确诊前48 和24 h 及确诊当日血液和尿α1-AT 含量对AKI 的预警或诊断的AUC 见表3和图2。
2.4 两组其他生物化学指标比较
两组患者WBC、CRP、K+、Na+、MAP、HR、OI比较,差异无统计学意义(P>0.05);而PCT、ALT、AST、BUN、Scr、eGFR水平和APACHEⅡ评分、qSOFA 评分比较,经t检验,差异有统计学意义(P<0.05),AKI 组PCT、ALT、AST、BUN、Scr 水平和APACHE Ⅱ评分、qSOFA 评分高于非AKI 组,而eGFR 低于非AKI 组。见表4。
2.5 脓毒症患者发生AKI 的影响因素Logistic 回归分析
以是否发生AKI 作为因变量,将PCT、ALT、AST、BUN、Scr、eGFR、APACHE Ⅱ评 分、qSOFA 评 分、尿α1-AT 指标作为自变量,进行多因素非条件一般Logistic 回归分析,结果显示Scr、eGFR、qSOFA 评分、尿α1-AT是AKI发生的独立影响因素(P<0.05)。见表5。
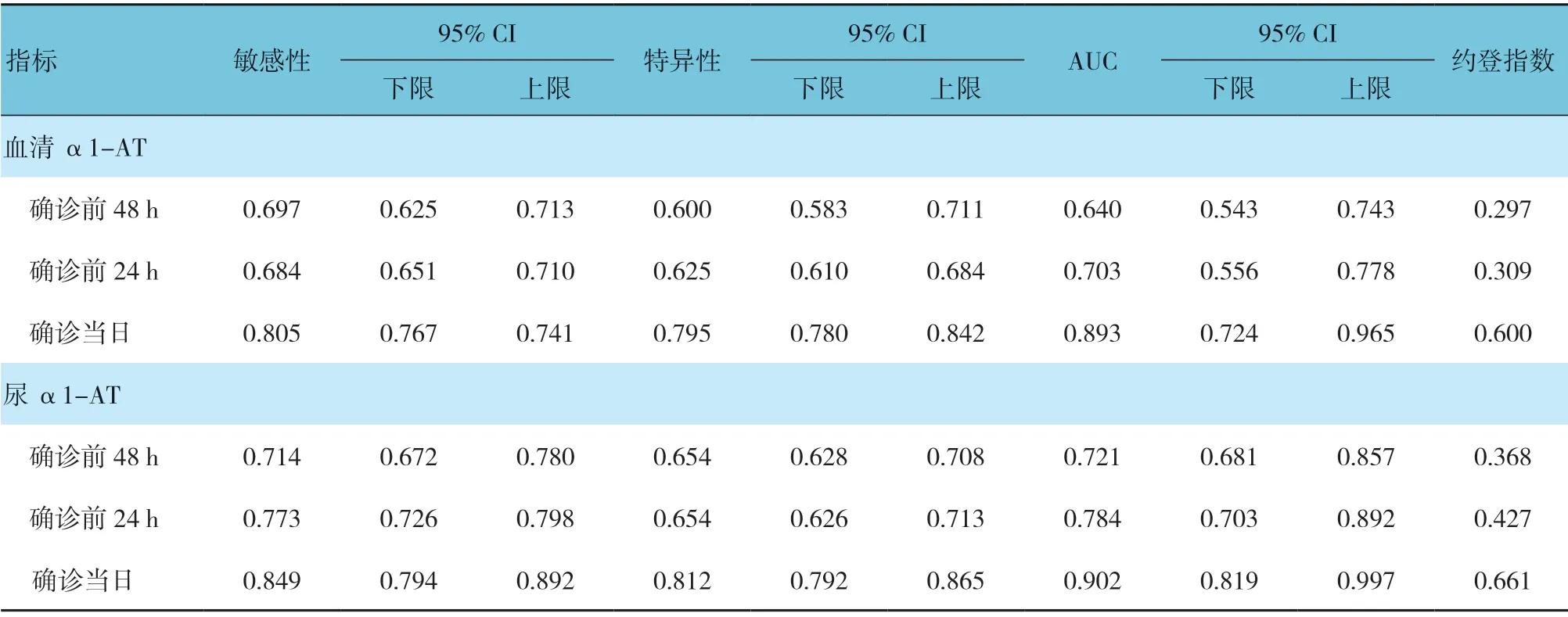
表3 血清和尿α1-AT 含量对脓毒症患者发生AKI 的预警或诊断价值参数
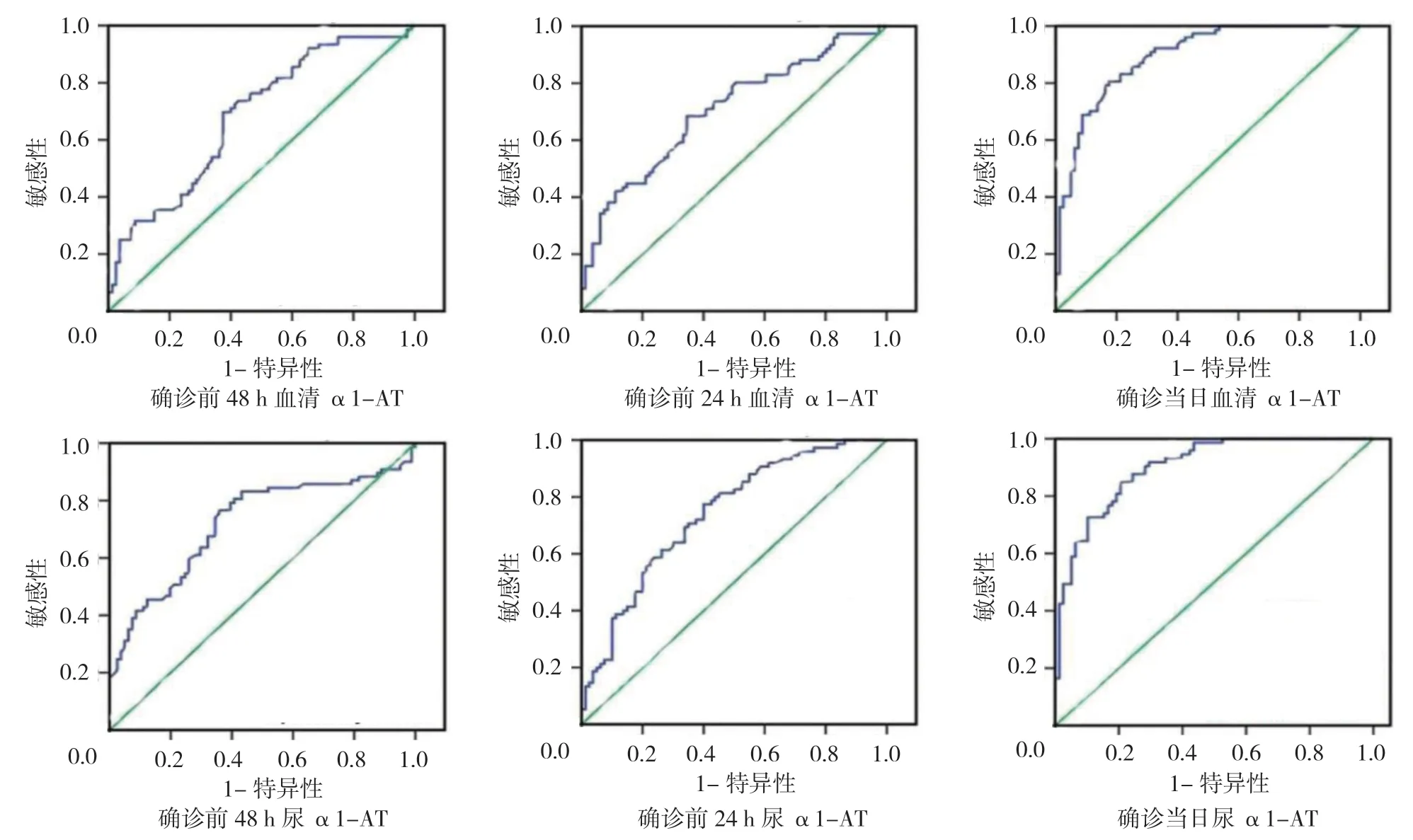
图2 血清和尿α1-AT 水平预警或诊断脓毒症患者发生AKI 的ROC 曲线

表4 两组其他生物化学指标比较
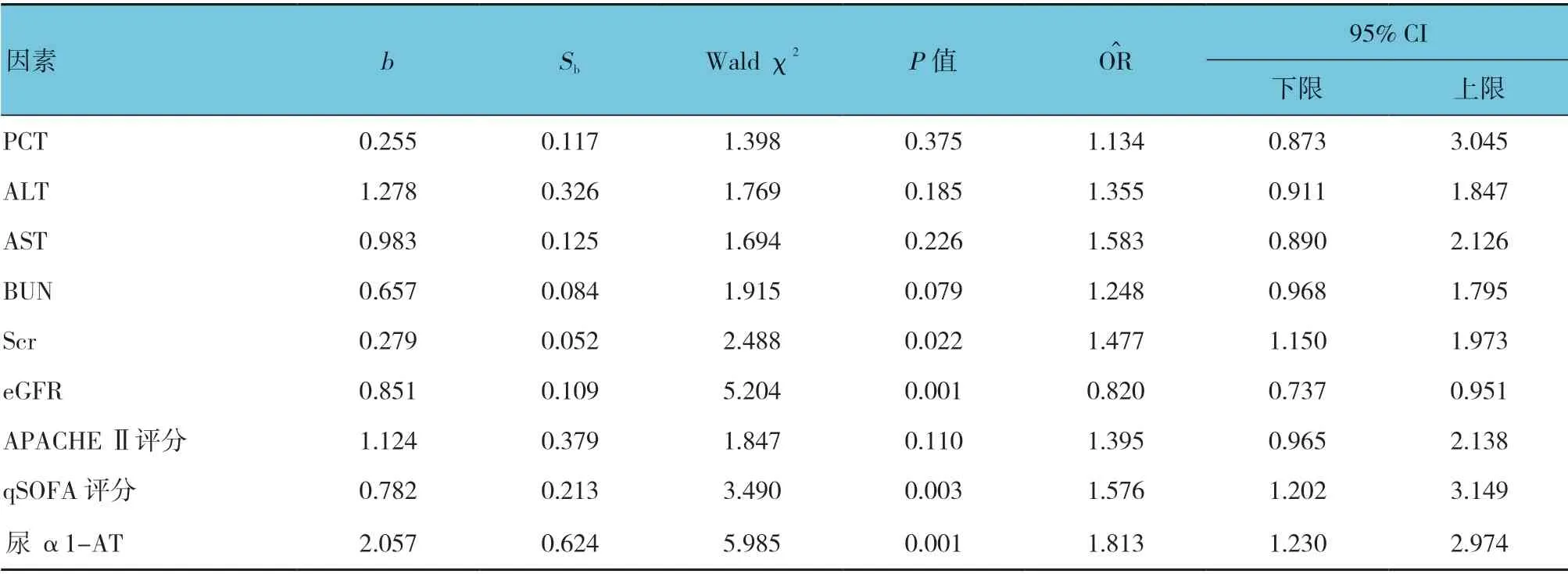
表5 脓毒症患者发生AKI 的影响因素Logistic 回归分析参数
3 讨论
根据我国近期两项大规模、多中心回顾性队列研究显示,AKI 的发病率约为10%,但是住院期间重复进行≥2 次Scr 检测的患者比例<30%,远低于发达国家报道的数据,因此AKI 在我国的发病率大大被低估[8-9]。但是重症监护病房重症患者AKI 的发病率>30%,尤其是脓毒症患者AKI 的发病率>50%[10]。本研究纳入宁波大学医学院附属医院重症监护病房脓毒症患者,但是剔除了住院7 d 内死亡的患者并排除合并有慢性肾脏病史者,因此AKI 的发病率略低于国内某些研究得出的流行病学数据。
除此以外,由于AKI 的诊断标准、指标、Scr 基线值等一直未达成共识,因此我国部分医疗水平较低的地区,AKI 的漏诊率和误诊率非常高。近几年随着发病机制研究的深入,2012年KDIGO 指南[7]在前期RIFLE 和AKIN 标准的基础上对AKI 的诊断指标进一步细化,虽然适当地延长了AKI 干预的窗口期,但是其核心指标依然是Scr 和尿量的变化,敏感性和可靠性较低,而且Scr 和尿量只能作为AKI 的诊断指标,基本无预警效能。因此笔者希望从AKI 发生的病理生理学机制及蛋白组学差异性出发,寻找具有早期预警效能的敏感指标。
α1-AT 蛋白是一类主要由肝细胞分泌的蛋白酶抑制剂和炎症抑制因子,抑制血浆多种丝氨酸内切肽酶(包括中性粒细胞弹性蛋白酶、凝血酶等)对组织细胞的损伤作用。田鲁等[11]发现,肾病综合征期患者血清α1-AT 蛋白含量低于蛋白尿期患者,推断α1-AT 与AL 型肾脏淀粉样变性病的发生、发展密切相关。CHO 等[12]也证实,α1-AT 通过调节肿瘤坏死因子β1信号通路抑制肾组织纤维化。在本研究中同样也发现AKI 患者在发病前48 h 即出现血清α1-AT 含量降低,说明机体内血清α1-AT 蛋白含量降低可能是发生肾组织损伤的重要因素。经ROC 曲线分析,AKI 确诊前48 和24 h 的血清α1-AT 含量都对AKI 具有一定的预测价值,尿α1-AT 含量升高是AKI 发生的独立危险因素。
新近研究发现,肝外细胞也可能合成并分泌少量α1-AT 蛋白,在局部组织损伤的调节中起重要作用[13]。2011年姜伟等[4]利用表面增强激光解析电离飞行时间质谱技术和Au 蛋白芯片技术对比了237 例AKI 患者和240 例对照者的尿蛋白指纹图谱,除了β2-微球蛋白、α1-微球蛋白、血红蛋白等常见的肾损伤标志分子水平升高以外,α1-AT 蛋白含量也显著升高。2016年陈东辉等[14]通过同位素标记相对和绝对定量技术分析原发性肾病综合征患者尿蛋白指纹图谱,发现尿α1-AT 蛋白是最具差异性表达的蛋白之一。本研究也证实AKI 患者尿α1-AT 蛋白含量较非AKI 组升高,并且经ROC 曲线和多因素Logistic回归分析证实,尿α1-AT 蛋白含量升高是AKI 发生的独立危险因素,并且预测和诊断效能较高,推测可能在肾小管损伤后,肾小管上皮细胞可反应性上调α1-AT基因的表达。唐功耀等[15]曾发现,经脂多糖刺激诱导肾近曲小管上皮细胞合成并分泌α1-AT 蛋白,导致尿蛋白中α1-AT 含量升高。但是α1-AT在肾损伤中具体的调控机制需要更深入的研究。
综上所述,脓毒症合并AKI 是一种发病机制复杂且具有生物学异质性的危急重症。本研究发现脓毒症合并AKI 患者血清α1-AT 含量降低,而尿α1-AT含量则升高,血清和尿α1-AT 对于脓毒症患者发生AKI 都具有早期预警作用,但是只有尿α1-AT 是AKI 发生的独立影响因素。由于α1-AT 在全身系统性和肾脏组织局部的作用机制不明,为临床推广带来了一定的局限性,因此对α1-AT 病理生理机制的研究将是未来工作的重点。

