桑叶生物碱粗提物对D-半乳糖诱导的小鼠蛋白氧化损伤的改善作用
杨忠敏,沈以红,黄先智,王祖文,丁晓雯,*
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,食品科学与工程国家级实验教学示范中心,重庆 400716;2.西南大学科技处,重庆 400716)
活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)是机体的正常代谢产物,适量的ROS、RNS对维持生物体细胞正常的生理功能至关重要[1]。但当机体氧化系统和抗氧化防御系统的平衡遭到破坏时,机体内会产生过量的高活性氧、氮分子(如ROS、RNS),导致机体产生氧化应激[2]。蛋白质是机体一类重要的生物大分子,极易被高活性分子攻击,使其氨基酸残基发生变化,进而导致蛋白质结构和功能的改变[3]。已有研究表明,许多疾病如阿尔茨海默病[4]、尿毒症[5]、帕金森病[6]等的发生与蛋白质的氧化水平密切相关。
核因子E2相关因子2(nuclear erythroid related factor2,Nrf2)/Kelch样环氧氯丙烷相关蛋白1(Kelch like ECH-associated protein-1,Keap1)信号通路被认为是最重要的内源性抗氧化通路。Nrf2是调节细胞对抗异源性物质和氧化损伤的关键转录因子,可调控下游II相解毒酶和抗氧化酶的转录活性进而增强抗氧化作用,而Keap1是Nrf2的调控因子[7]。在正常生理状态下,细胞中Keap1与Nrf2结合在一起并抑制Nrf2的激活,当机体发生氧化应激时,Nrf2和Keap1分离,Nrf2被激活并与抗氧化反应元件相结合,进而激活靶基因的表达,从而发挥抗氧化损伤作用[8]。
药食两用植物中存在的天然抗氧化剂对于预防氧化应激反应诱导相关疾病的发生发展具有重要意义。桑叶生物碱作为一类以1-脱氧野尻霉素为主的多羟基哌啶生物碱,已被证实具有降脂、降糖等作用[9-10]。笔者前期研究已发现桑叶生物碱在体外模拟胃肠消化体系中具有较强的抗氧化潜力[11],同时也证实了该化合物在小鼠体内能增强小鼠的抗氧化能力,对小鼠体内大分子物质的氧化损伤具有改善作用[12]。但目前针对桑叶生物碱改善蛋白氧化损伤特别是作用机理的研究鲜见报道。因此,本实验采用D-半乳糖(D-galactose,D-Gal)诱导建立小鼠氧化损伤模型,然后给实验小鼠灌胃不同剂量的桑叶生物碱,在前期研究的基础上从Nrf2/Keap1信号通路出发深入探讨桑叶生物碱在体内对蛋白氧化损伤的改善作用及机理,为桑叶生物碱的开发利用提供理论依据,为防御机体蛋白氧化损伤提供新的思路。
1 材料与方法
1.1 动物、材料与试剂
基础饲料、SPF级昆明种小鼠(60 只,4 周龄,平均体质量为20 g左右)均由重庆医科大学实验动物中心提供,生产许可证号:SCXK(渝)2018-0003。
桑叶粉末 重庆市蚕业科学技术研究院;桑叶生物碱为西南大学农产品加工重点实验室自制[11],采用硅钨酸沉淀法[13]测定总生物碱质量分数为93.57%。
D-Gal(纯度≥99%)、谷胱甘肽(glutathione,GSH)(纯度≥98%) 阿拉丁试剂(上海)有限公司;蛋白羰基(protein carbonyl,PCO)、晚期蛋白氧化产物(advanced oxidation protein products,AOPP)、3-硝基酪氨酸(3-nitrotyrosine,3-NT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、醌氧化还原酶1(NAD(P)H quinine oxidoreductase 1,NQO1)酶联吸附免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 厦门慧嘉生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒南京建成生物工程研究所;高纯总RNA快速提取试剂盒北京百泰克生物技术有限公司;反转录试剂盒、SYBR®Premix ExTaqTMII(Til RNaseH Plus)试剂盒 宝生物工程(大连)有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Symergy H1酶标仪 美国基因有限公司;811DK高速冷冻离心机 德国Eppendorf AG公司;KQ5200DB超声波清洗仪 昆山市超声仪器有限公司;T100T型聚合酶链式反应(polymerase chain reaction)仪、CFX96实时荧光定量PCR(real-time PCR,qPCR)仪、NanoDropND-2000C微量紫外分光光度计、GelDoc2000凝胶成像系统 美国Thermo公司;DW-HL438型超低温冰箱 合肥美菱股份有限公司。
1.3 方法
1.3.1 动物预实验
根据参考文献[14]开展动物预实验,建立动物实验的饲养方法,确定桑叶生物碱低、中、高剂量分别为50、100、200 mg/kgmb,实验为期8 周。
1.3.2 动物分组及模型建立
60 只雄性SPF级昆明种小鼠,实验前适应性饲养7 d后,随机分出10 只为正常对照组,连续腹腔注射与造模组等量的生理盐水;其余50 只小鼠连续腹腔注射D-Gal(1 000 mg/kgmb)20 d,构造氧化应激模型。以造模组、正常对照组小鼠血清中MDA、SOD水平是否存在显著差异作为判定指标。
正常对照组小鼠继续灌胃生理盐水;将造模成功的小鼠随机分为模型对照组(灌胃生理盐水)、阳性药物组(灌胃200 mg/kgmbGSH)以及桑叶生物碱低、中、高剂量组,每组10 只。实验期间,小鼠每天称体质量1 次,并根据体质量变化按照0.1 mL/10 gmb每天灌胃1 次,连续灌胃8 周。
小鼠按照西南大学实验动物保护和使用规则饲养,实验期间室内通风条件良好,控制动物房温度为(23±2)℃、相对湿度40%~60%,12 h明暗交替(9∶00 a.m.~21∶00 p.m.),所有小鼠均喂饲基础饲料,自由觅食、饮水。
1.3.3 样本采集
8 周灌胃结束后,各实验组小鼠禁食不禁水12 h,摘取小鼠眼球取血于肝素钠采血管中,4 ℃、3 000 r/min离心15 min,上清液即为血浆,于-80 ℃保存备用。采血完毕后,将实验小鼠颈椎脱臼处死,快速取出肝脏,用冷生理盐水漂洗除去表面血液,于-80 ℃保存备用。
1.3.4 血浆PCO、AOPP、3-NT的水平及SOD、GSH-Px、NQO1的活力测定
均按照试剂盒说明书提供的方法进行操作。
1.3.5 肝组织SOD、GSH-Px、NQO1、Nrf2、Keap1mRNA表达的测定
按照RNA提取试剂盒的方法提取肝脏组织总RNA。根据反转录试剂盒说明书将RNA反转录为cDNA,再进行PCR扩增。取上述反转录产物1 μL作为反应模板,进行qPCR扩增,反应体系10 μL。引物由生工生物工程(上海)股份有限公司合成,如表1所示。qPCR条件:95 ℃、4 min预变性;95 ℃、15 s变性,60℃、30 s退火,共39 个循环。以β-actin作内参基因,分别测定肝组织SOD、GSH-Px、NQO1、Nrf2、Keap1的相对表达量,结果以2-ΔΔCt表示。

表 1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据统计分析
2 结果与分析
2.1 桑叶生物碱对小鼠蛋白氧化损伤的影响
PCO是蛋白质分子被ROS攻击后产生的,A OPP是氯氧化剂次氯酸作用于蛋白质而形成的含双酪氨酸的交联产物,两者均可作为蛋白氧化损伤的敏感指标[5,15]。而RNS攻击蛋白质分子中的酪氨酸残基,使蛋白质发生硝化反应产生3-NT,也是氧化应激指标之一[16]。
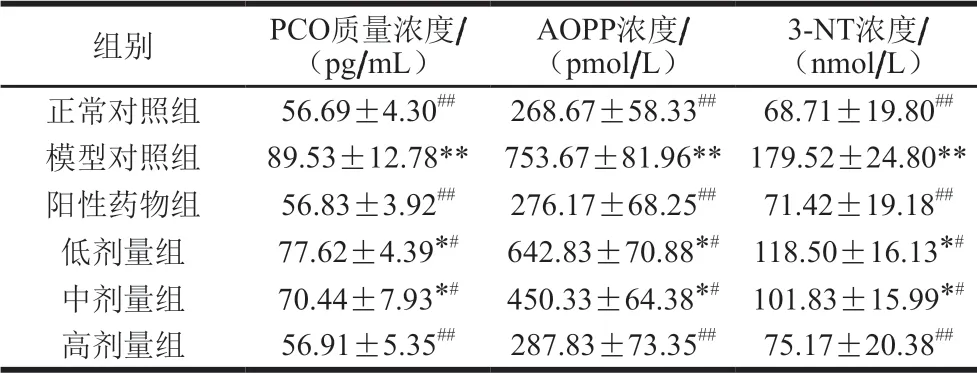
表 2 桑叶生物碱对D-Gal诱导小鼠血浆PCO、AOPP、3-NT水平的影响(n=10)Table 2 Effects of mulberry leaf alkaloids on PCO, AOPP and 3-NT levels in plasma of mice with D-Gal-induced injury (n= 10)
由表2可知,与正常对照组相比,模型组小鼠PCO、AOPP、3-NT水平分别增加了57.93%、180.52%、161.27%(P<0.01),表明模型组小鼠发生了明显的蛋白氧化损伤。与模型组相比,阳性药物组PCO、AOPP、3-NT水平分别减少了36.52%、63.36%、60.22%(P<0.01);桑叶生物碱高剂量组PCO、AOPP、3-NT水平分别减少了36.43%、61.81%、58.13%(P<0.01),且恢复到与正常对照组无显著性差异水平(P>0.05),表明桑叶生物碱对氧化应激小鼠蛋白氧化损伤有较好的改善作用。
2.2 桑叶生物碱对小鼠抗氧化酶活力的影响
机体存在着内源性的抗氧化防御系统,抗氧化酶SOD、GSH-Px是其重要的组成部分,它们可通过分解ROS/RNS而对机体组织起到保护作用[17]。

表 3 桑叶生物碱对D-Gal诱导小鼠血浆SOD、GSH-Px活力的影响(n=10)Table 3 Effects of mulberry leaf alkaloids on SOD and GSH-Px activity in plasma of mice with D-Gal-induced injury (n= 10)
由表3 可知,与正常对照组相比,模型组小鼠SOD、GSH-Px活力分别下降了34.13%、63.88%(P<0.01),表明模型组小鼠的抗氧化酶系统活力大大降低,对氧化应激的改善能力下降。与模型组相比,阳性药物组SOD、GSH-Px活力分别升高50.05%、173.07%(P<0.01);桑叶生物碱高剂量组SOD、GSH-Px活力分别升高了48.89%、167.17%(P<0.01),且恢复到与正常对照组无显著性差异水平(P>0.05)。表明桑叶生物碱能使氧化应激小鼠抗氧化酶活力逐渐恢复,进而达到清除机体过量自由基的作用。
2.3 桑叶生物碱对小鼠II相解毒酶活力的影响
II相代谢酶是细胞在遭受异源性物质侵袭发生氧化应激损伤或细胞毒性、致癌性等可能性增加时发挥保护细胞作用的蛋白酶,又称II相解毒酶或II相抗氧化酶。NQO1是重要的II相解毒酶之一。

表 4 桑叶生物碱对D-Gal诱导小鼠血浆NQO1活力的影响(n=10)Table 4 Effects of mulberry leaf alkaloids on NQO1 activity in plasma of mice with D-Gal-induced injury (n= 10)
由表4可知,与正常对照组相比,模型组小鼠NQO1活力下降了46.97%(P<0.01),表明模型组小鼠保护细胞不被氧化损伤的能力大大减弱。与模型组相比,阳性药物组NQO1活力升高了87.92%(P<0.01);桑叶生物碱高剂量组NQO1活力升高了85.12%(P<0.01),也恢复到与正常对照组无显著性差异水平(P>0.05)。表明桑叶生物碱能改善氧化应激小鼠NQO1活力。
2.4 桑叶生物碱对小鼠抗氧化损伤酶mRNA表达的影响
SOD、GSH-Px、NQO1是机体内抗氧化应激的重要组成酶,且主要表达靶器官是肝脏组织[18]。如果机体发生氧化应激,则SOD、GSH-Px、NQO1的mRNA表达量将会减少。本研究考察了桑叶生物碱是否从转录水平调节上述3 种酶的活力水平。
2.4.1 桑叶生物碱对小鼠肝脏SOD1、SOD2和GSH-PxmRNA表达的影响
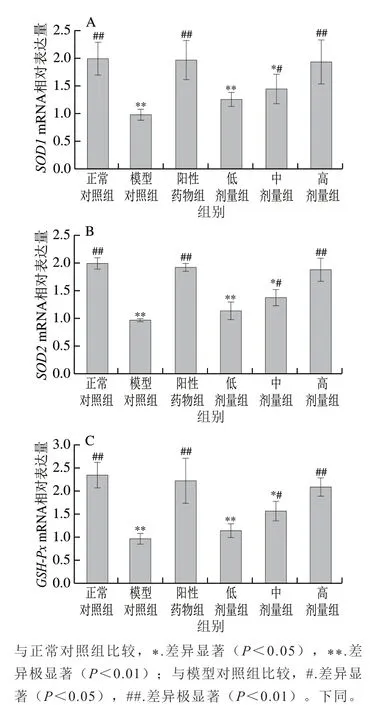
图 1 桑叶生物碱对小鼠肝脏SOD1(A)、SOD2(B)和GSH-Px(C)mRNA表达的影响Fig. 1 Effects of mulberry leaf alkaloids on SOD1 (A), SOD2 (B) and GSH-Px (C) mRNA expression in mouse liver
由图1 可知,与正常对照组相比,模型组小鼠SOD1、SOD2和GSH-PxmRNA表达分别下降了50.71%、51.22%、59.06%(P<0.01)。与模型组相比,桑叶生物碱高剂量组SOD1、SOD2和GSH-PxmRNA表达分别上升了96.96%、94.26%、116.71%(P<0.01),且恢复到与正常对照组无显著性差异水平(P>0.05),说明桑叶生物碱通过调控SOD1、SOD2和GSH-Px的mRNA表达水平使得SOD、GSH-Px活性水平升高进而清除机体自由基,防止蛋白遭受自由基攻击导致氧化损伤。
2.4.2 桑叶生物碱对小鼠肝脏NQO1mRNA表达的影响
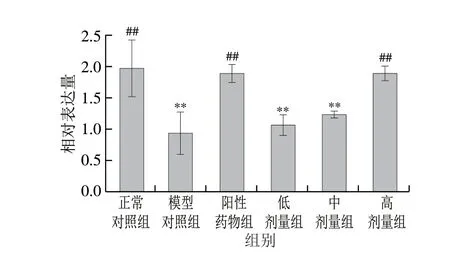
图 2 桑叶生物碱对小鼠肝脏NQO1 mRNA表达的影响Fig. 2 Effects of mulberry leaf alkaloids on NQO1 mRNA expression in mouse liver
由图2可知,与正常对照组相比,模型组小鼠NQO1mRNA表达水平下降了52.46%(P<0.01)。与模型组相比,阳性药物组NQO1mRNA表达水平增加了102.16%(P<0.01),桑叶生物碱高剂量组NQO1mRNA表达水平增加了101.51%(P<0.01),且恢复到与正常对照组无显著性差异水平(P>0.05)。说明桑叶生物碱通过调控NQO1的mRNA表达水平使得NQO1活性逐渐恢复。
2.5 桑叶生物碱对小鼠肝脏Nrf2、Keap1 mRNA表达的影响
Nrf2是亮氨酸转录因子家族成员中最强的转录调节因子,主要在肝脏、肾等参与代谢和解毒的组织中表达,Keap1是Nrf2的特异性受体[19]。为考察桑叶生物碱在机体中改善蛋白氧化损伤的调节机制,本研究测定Nrf2、Keap1在肝脏中的mRNA表达水平。
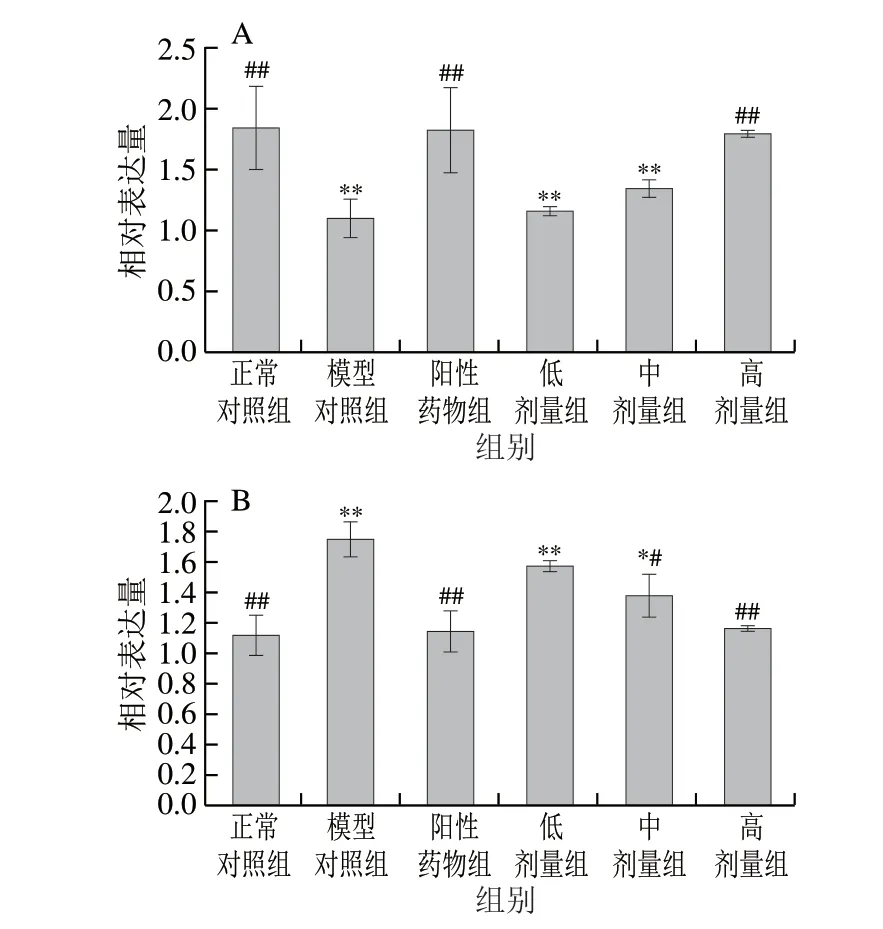
图 3 桑叶生物碱对小鼠肝脏Nrf2(A)和Keap1(B)mRNA表达的影响Fig. 3 Effects of mulberry leaf alkaloids on Nrf2 (A) and Keap1 (B)mRNA expression in mouse liver
由图3可知,与正常对照组相比,模型组小鼠Nrf2mRNA表达水平下降了40.46%(P<0.01),Keap1mRNA表达水平增加了56.85%(P<0.01)。与模型组相比,阳性药物组Nrf2mRNA表达水平增加了66.55%(P<0.01),Keap1mRNA表达水平降低了34.72%(P<0.01),桑叶生物碱高剂量组Nrf2mRNA表达水平增加了63.01%(P<0.01),Keap1mRNA表达水平降低了33.54%(P<0.01),且恢复到与正常对照组无显著性差异水平(P>0.05)。研究结果说明桑叶生物碱能通过调控Nrf2/Keap1信号通路进而增加下游靶基因SOD、GSH-Px及NQO1mRNA表达,改善机体抗蛋白氧化损伤的能力。
3 讨 论
蛋白质分子在机体中占有特殊地位,是机体细胞的基本构成物质,同时,它也是生物体中很多重要的代谢物质、营养物质的载体[20]。Stadtman等[21]研究表明,机体中的高活性分子攻击氨基酸分子中的自由氨基或亚氨基,最终生成相应的羰基衍生物,其中金属离子催化氧化系统是产生PCO的主要途径。AOPP是自由基攻击血清蛋白的氧化作用产生的双酪氨酸蛋白交联产物,也是蛋白氧化损伤的特异性标志之一[22]。酪氨酸硝基化会严重影响机体细胞信号的传导和代谢酶的调节,其产物3-NT不仅能作为一些疾病的生物标志物,也能促进疾病的发生和发展[23]。大量研究已表明,一些天然产物能够抑制自由基对蛋白质的氧化损伤[24],如张月等[25]研究表明,辣椒碱能抑制蛋白质硝基化及PCO水平。本研究结果表明,经桑叶生物碱调控后,已发生了氧化应激的小鼠其PCO、AOPP及3-NT水平可逐渐恢复到与正常对照组无显著性差异的水平(P>0.05),表明桑叶生物碱与其他生物碱化合物作用一样,对机体的蛋白氧化损伤具有较好的改善作用,且表现出明显的量效关系。
机体内存在一套内源性的抗氧化系统,其对机体的氧化应激应答是动态的,在一定程度下可与氧化应激形成平衡。SOD、GSH-Px是抗氧化系统中重要的内源性抗氧化酶:SOD可通过歧化反应将超氧阴离子转化为H2O2,之后GSH-Px可将H2O2转变为水,从而保护生物大分子免受氧化应激损伤[26-27]。NQO1是真核细胞中普遍存在的一类黄素类蛋白酶,它能催化醌类及其衍生物还原并使其毒性降解,从而阻止它们进一步参与机体的氧化还原反应和产生ROS,进而减轻机体氧化应激反应[28]。本研究发现,200 mg/kgmb桑叶生物碱调控后,小鼠血浆中SOD、GSH-Px、NQO1活力及mRNA表达水平均显著升高,且恢复到与正常对照组、阳性药物组无显著性差异的水平(P>0.05),提示桑叶生物碱能从转录水平恢复机体抗氧化酶的活力,这与彭晓蝶[29]、郝麒麟[30]等研究结果相一致。
为进一步探讨桑叶生物碱对蛋白氧化损伤的改善作用,本实验对其作用的分子机制进行了深入研究。Keap1/Nrf2是在机体氧化应激过程中发挥至关重要作用的信号通路。Nrf2能与抗氧化反应元件结合激活特定的下游靶基因转录,且Nrf2水平与SOD、GSH-Px、NQO1的表达呈正相关[31]。Keap1是69 kDa的细胞质蛋白伴侣分子,是Keap1/Nrf2通路的主要调节器,它可根据细胞内的氧化还原状态打开或者关闭Keap1-Nrf2-ARE通路[32]。大量研究表明,许多生物碱化合物(如野百合碱、毛果芸香碱等)对Nrf2/Keap1具有调控作用[33]。本研究结果表明桑叶生物碱可以显著下调Keap1mRNA表达,上调Nrf2mRNA表达,表明桑叶生物碱对Nrf2/Keap1通路有较好的调控作用。
综上所述,桑叶生物碱可能通过激活Keap1/Nrf2信号通路,增加下游SOD、GSH-Px及NQO1mRNA的表达,从而提高SOD、GSH-Px及NQO1活力,促进机体ROS/RNS清除,达到改善生物体内蛋白质分子氧化损伤的目的。

