虾青素对高脂HepG2细胞及高脂膳食饲喂C57BL/6J小鼠血脂代谢的影响
刁翠茹,王 静,闫 勇,刘 东,张晓寒,王 浩
(天津科技大学食品工程与生物技术学院,食品营养与安全重点实验室,天津 300457)
高脂血症主要是指血浆中总胆固醇(total cholesterol,TC)或甘油三酯(triglyceride,TG)水平升高[1]。大量流行病学研究发现,血脂水平、血浆胆固醇水平升高程度与动脉粥样硬化及高脂血症的严重程度有一定的关系,特别是与冠心病、脑中风、心脑血管疾病的死亡率呈正相关[2-4]。而心血管疾病仍然是全球人类死亡的主要原因,在美国所有患病死亡的患者中,约1/3死于心血管疾病[5]。肝脏是合成与分解TG的重要场所,当脂肪合成与分解失衡或代谢运转异常,超于机体可控调节范围时,就会引起TC、TG水平升高,进一步诱发高脂血症[6]。
虾青素是一种叶黄素类胡萝卜素,存在于许多微生物、海洋动物、酵母和鸟类羽毛中,被认为是生物圈中分布最广泛的脂溶性叶黄素[7-9]。虾青素不仅可以抑制脂质过氧化和低密度脂蛋白氧化,还可以减少高脂膳食饲喂大鼠中血清TG含量[9-11]。虾青素已被证明具有多种生物学功能,如抗脂质过氧化和抗炎等[12-14]。研究表明,虾青素的抗氧化性能有助于预防癌症、糖尿病和心血管疾病[13-14]。其抗氧化活性高于大多数抗氧化剂,包括VC、VE、β-胡萝卜素、叶黄素和番茄红素[15]。目前国内外研究集中于虾青素对酒精性脂肪肝的预防[16-17],而对HepG2细胞降血脂功能的研究尚鲜见报道。因此,本实验以高脂HepG2细胞及高脂膳食喂养的C57BL/6J小鼠为模型,探讨虾青素对血脂代谢的影响,为虾青素在保健食品领域的应用提供理论依据。
1 材料与方法
1.1动物、材料与试剂
SPF级雄性C57BL/6J小鼠40 只,体质量(20±2)g,许可证号:No.11400700309252,购自北京维通利华实验动物技术有限公司。
虾青素油(质量分数19.64%) 云南爱尔康生物技术有限公司;TC、TG测定试剂盒和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒 中生北控生物科技股份有限公司;TRIzol试剂、cDNA反转录试剂盒、SYBR Green染料 宝生物工程(大连)有限公司;引物 苏州金唯智生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪、MyiQ2实时荧光定量PCR仪 美国Bio-Rad公司;Multiskan-FC型酶标仪 赛默飞世尔仪器(上海)有限公司;752型紫外-可见分光光度计 上海菁华科技仪器有限公司;Neofuge冷冻离心机 美国Thermo公司;G-box凝胶图像采集分析系统 英国Syngene公司;7890A气相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 油酸诱导HepG2细胞中脂滴含量的测定
细胞培养及种板操作参考实验室已有方法[18],细胞在6 孔板中培养24 h贴壁;弃去培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗一次,选取4、8、16 μmol/L虾青素为药物处理终浓度,选取诱导HepG2细胞脂肪堆积的油酸终浓度为250 μmol/L,同时处理12 h,弃去培养基,PBS清洗两次,每孔加入1 mL 4%多聚甲醛固定30 min,PBS润洗两次,加入终质量浓度为2 mg/L油红O染色40 min,PBS润洗3 次,置于激光共聚焦显微镜下观察并拍照;每孔加入1 mL异丙醇溶解,将孔内溶液全部转于1.5 mL EP管中,取1 mL异丙醇溶液作对照,于510 nm波长处测定吸光度,以吸光度反映脂滴含量。
1.3.2 HepG2细胞中TG、TC含量的测定
细胞在6 孔板中培养24 h贴壁,选取4、8、16 μmol/L虾青素为药物处理终浓度,选取诱导HepG2细胞脂肪堆积的油酸终浓度为250 μmol/L,同时处理12 h,弃去培养基,PBS清洗一次,细胞刮刀小心刮除细胞并溶于1 mL PBS中,混匀,离心(1 000 r/min、10 min),弃上清液,留细胞沉淀,用PBS清洗两次,重复离心;收集细胞沉淀溶于0.3 mL PBS中,冰浴条件下超声破碎(功率300 W、5 s/次、间隔30 s,重复5 次),匀浆。制备好的细胞样品按照TG、TC说明书加样,酶标仪测定吸光度[19]。
1.3.3 动物分组和饲喂
适应一周后将小鼠随机分成4 组,每组10 只,分别为正常组、高脂组、低剂量虾青素组和高剂量虾青素组。动物饲料组成见表1。
动物饲养条件: 屏障系统动物房, 温度(22±2)℃,相对湿度40%~60%,控制照明12 h/12 h昼夜循环。小鼠饲养8 周,实验期间自由摄食摄水。实验动物每2 d更换新粮。实验8 周后,小鼠禁食不禁水12 h,CO2麻醉后取血、处死并解剖。血液4 ℃离心分离血清后-80 ℃保存。收集脏器,生理盐水清洗后-80 ℃保存。结肠内容物装入已灭菌离心管中,-80 ℃保存。
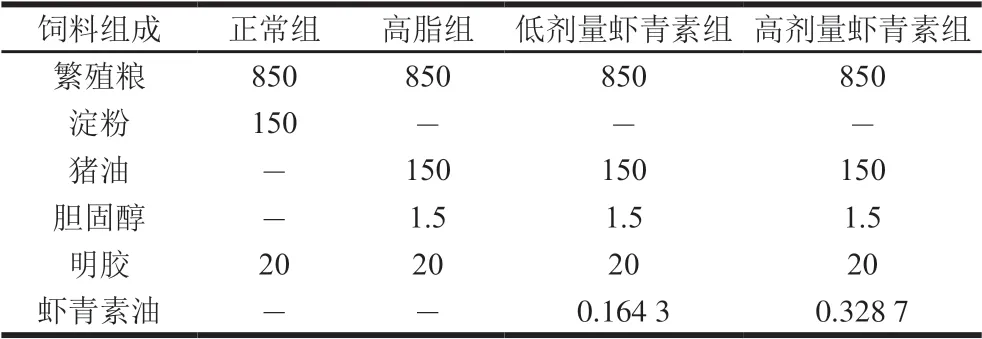
表 1 C57BL/6J小鼠饲料组成Table 1 Ingredients of diets for C57BL/6J mice g
1.3.4 血清中TC、TG和HDL-C水平的测定
血清中TC、TG和HDL-C浓度的测定参照试剂盒说明书进行,分别通过胆固醇氧化酶-过氧化物酶偶联法、甘油磷酸氧化酶-过氧化物酶偶联法和直接法-过氧化氢酶清除法测定。非HDL-C浓度为TC与HDL-C浓度的差值。
1.3.5 病理学检测
取相同位置肝脏,放入盛有体积分数为10%甲醛溶液的标本瓶中固定。24 h后将固定的肝组织脱水,石蜡包埋并切片。切片经二甲苯脱蜡,梯度乙醇脱水,先后用伊红、苏木精染色和复染,梯度乙醇脱水后用二甲苯透明,中性树胶封片,用显微镜观察肝脏组织病理学变化。
1.3.6 实时荧光定量PCR检测肝脏中脂肪合成相关基因表达水平
TRIzol法提取RNA,反转录得cDNA,-80 ℃保存。SYBRGreen法检测基因表达水平,以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因为内参基因,根据美国国家生物信息中心数据库设计引物(表2)。反转录及实时荧光定量PCR参照试剂盒具体说明进行。具体操作方法参考文献[20]。

表 2 C57BL/6J小鼠肝脏中与脂肪合成相关基因PCR引物Table 2 PCR primers for genes related to lipid synthesis in C57BL/6J mouse liver
1.3.7 粪中短链脂肪酸的测定
取每只小鼠新鲜粪便,以2-乙基丁酸作为内标,4 ℃放置过夜,加入浓硫酸酸化,再次漩涡振荡,混匀后加入乙醚萃取,将上层有机相转到另一离心管中,加入无水硫酸钠,10 000×g离心30 min,取上层进行气相色谱分析。短链脂肪酸(short chain fatty acids,SCFAs)测定的前处理方法参见文献[21]。气相色谱条件:FID检测器、19091N-133 HP-INNOWAX色谱柱(30 m×0.25 mm,0.25 μm)。
1.4 数据统计与分析
采用SPSS 22.0软件分析,以平均值±标准差表示,用t检验法进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 虾青素对油酸诱导HepG2细胞胞内脂滴含量的影响
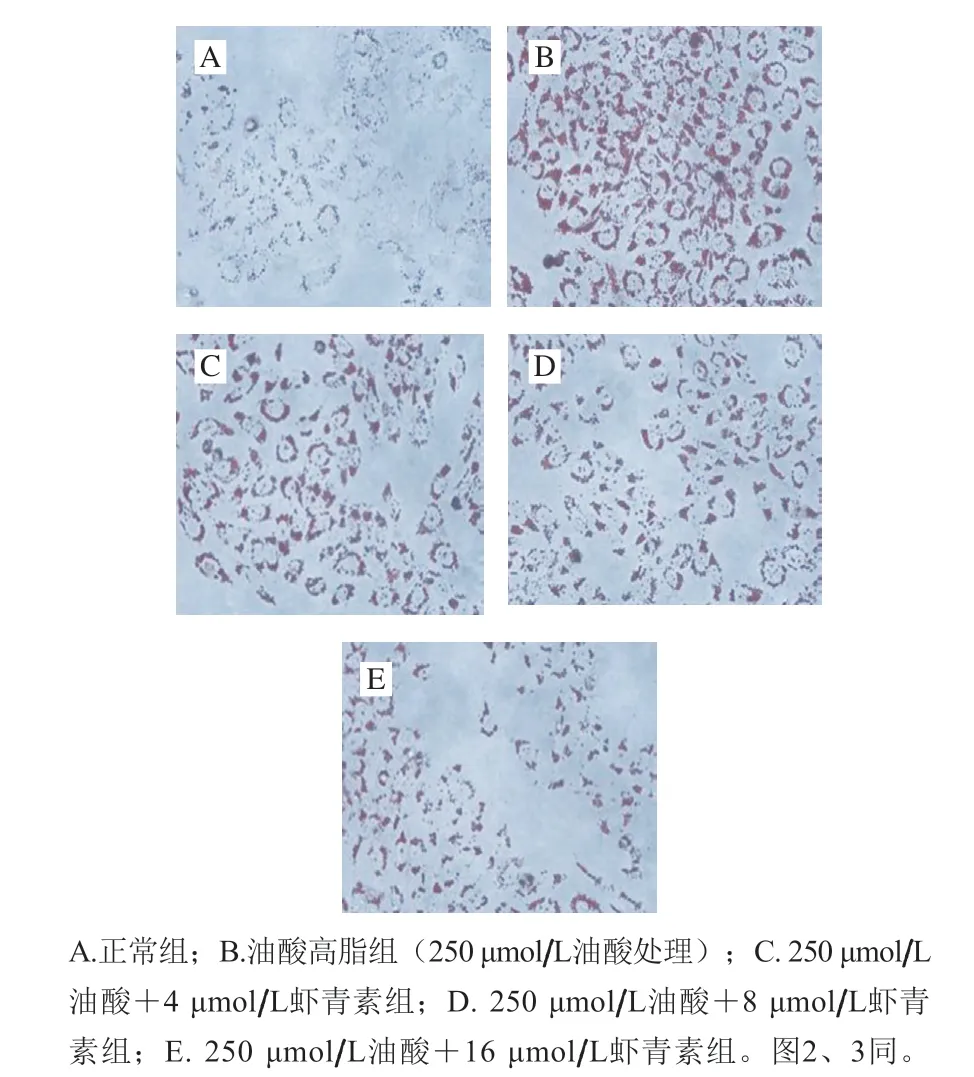
图 1 虾青素对油酸诱导HepG2细胞内脂滴含量的影响(400×)Fig. 1 Effect of astaxanthin on the content of lipid droplets in HepG2 cells induced by oleic acid (400 ×)
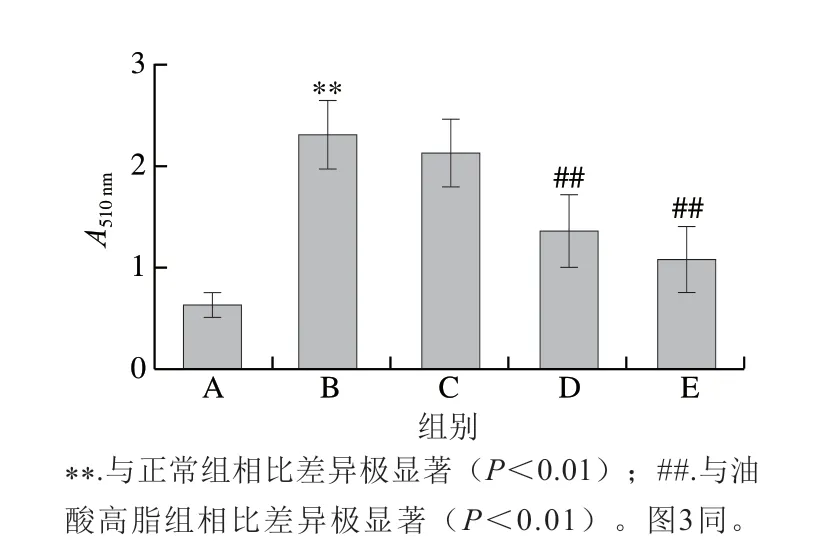
图 2 各实验组的吸光度Fig. 2 Absorbance of five cell groups
由图1、2可以看出,经油红O染色后,胞内脂滴呈红色,250 μmol/L油酸处理的细胞内脂滴含量明显增多,染色后油酸高脂组中细胞异丙醇溶液的吸光度是正常组的3.67 倍,脂肪积累极显著增加(P<0.01);8、16 μmol/L虾青素组极显著降低油酸诱导的细胞内脂滴含量(P<0.01),吸光度相比于油酸高脂组分别降低41.13%和53.25%,证实虾青素能有效抑制油酸诱导的脂滴沉积。
2.2 虾青素对油酸诱导HepG2细胞内TG、TC含量的影响
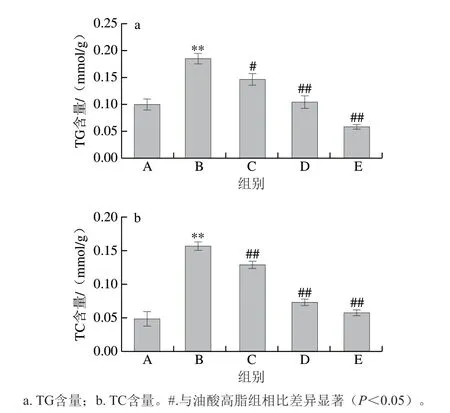
图 3 虾青素对油酸诱导HepG2细胞内TG和TC含量的影响Fig. 3 Effect of astaxanthin on TG and TC contents in oleic acid induced HepG2 cells
由图3可见,与正常组相比,油酸高脂组细胞内TG、TC含量极显著升高(P<0.01);与油酸高脂组相比,经虾青素处理后细胞内TG、TC含量极显著降低,且呈浓度依赖趋势,其中16 μmol/L虾青素组TG、TC含量分别降低69.19%和63.69%(P<0.01),表明虾青素能够明显抑制油酸诱导的胞内TG、TC含量的增加。
2.3 虾青素对C57BL/6J小鼠体质量、摄食量及脏器质量的影响

表 3 C57BL/6J小鼠体质量、摄食量及脏器质量(n=10)Table 3 Body mass, feed intake and viscera mass of C57BL/6J mice in four groups (n= 10)
由表3可知,C57BL/6J小鼠饲喂8 周后,高脂组小鼠摄食量略低于正常组小鼠摄食量。但各组小鼠初始体质量、最终体质量及摄食量均无显著性差异(P>0.05)。与正常组相比,高脂组小鼠的肝脏质量极显著增加(P<0.01);与高脂组比,高剂量虾青素组肝脏质量显著降低20.28%(P<0.05)。
2.4 虾青素对C57BL/6J小鼠血脂水平的影响
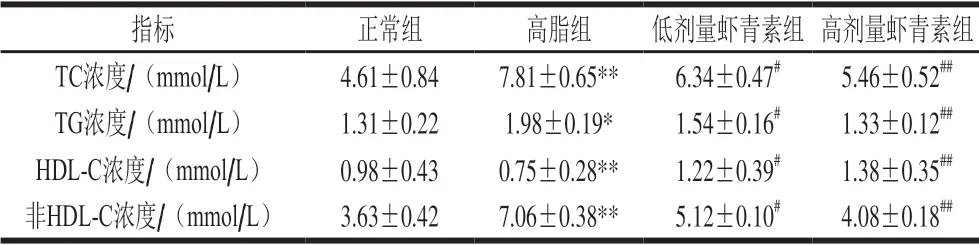
表 4 虾青素对C57BL/6J小鼠血脂水平的影响(n=10)Table 4 Effect of astaxanthin on serum lipid levels in C57BL/6J mice (n= 10)
由表4可知,高脂组的小鼠血清TC、TG、非HDL-C水平较正常组均显著升高(P<0.05,P<0.01),而HDL-C水平极显著低于正常组(P<0.01)。从血清TC水平看,与高脂组相比,虾青素两个剂量组的TC水平显著降低(P<0.05,P<0.01),高剂量虾青素降低TC水平效果更明显,使TC水平显著降低30.1%。从血清TG水平看,与高脂组相比,虾青素两个剂量组的TG水平都显著降低(P<0.05,P<0.01),并且高剂量虾青素组降低TG水平比低剂量虾青素组提高10.6%,从血清HDL-C水平看,高剂量虾青素组的HDL-C水平极显著高于高脂组(P<0.01),是高脂组的1.84 倍,说明虾青素能升高小鼠血清中HDL-C水平。从血清非HDL-C水平看,与高脂组相比,低、高剂量虾青素组的非HDL-C水平显著降低(P<0.05,P<0.01),分别降低了27.5%和42.2%。
2.5 虾青素对C57BL/6J小鼠肝细胞形态的影响
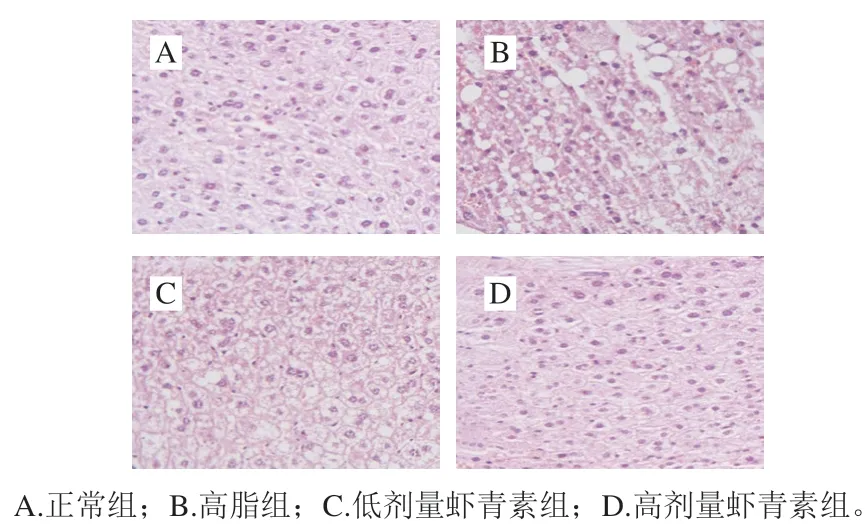
图 4 虾青素对C57BL/6J小鼠肝细胞形态的影响(200×)Fig. 4 Effect of astaxanthin on hepatocyte morphology of C57BL/6J mice (200 ×)
由图4可知,正常组小鼠肝小叶结构完整,肝细胞排列整齐,少见脂肪变性,细胞结构清晰、胞质丰富,细胞核位于细胞中央,肝小叶内和血管周围无炎症细胞聚集;高脂组小鼠肝组织出现大面积脂肪变性,部分肝细胞胞质内充满大脂滴,细胞核被较大的脂滴挤到一侧;与高脂组相比,高剂量虾青素组小鼠肝组织脂肪变性减轻,胞浆内脂滴数量减少、体积变小。正常组肝小叶结构正常且肝细胞排列整齐,与高剂量虾青素组无明显差异。高脂饮食导致小鼠肝脂肪变性,肝细胞中细胞坏死的数量增加且出现大量的脂肪空泡,使其明显增大。结果表明,虾青素能够干预逆转高脂引起的肝脂肪变性。
2.6 虾青素对C57BL/6J小鼠粪中SCFAs的影响

图 5 虾青素对C57BL/6J小鼠粪便中SCFAs的影响Fig. 5 Effect of astaxanthin on fecal short-chain fatty acid level in C57BL/6J mice
对粪便样品中3 种主要的SCFAs(乙酸、丙酸和丁酸)进行测定。由图5可知,与正常组相比,高脂饮食诱导的3 种主要的SCFAs含量和总SCFAs含量均极显著降低(P<0.01),虾青素干预后,3 种主要SCFAs的含量显著升高(P<0.05,P<0.01)。并且高剂量虾青素组乙酸、丙酸和丁酸的水平分别是高脂组的1.31、1.44 倍和1.47 倍。高剂量虾青素组主要SCFAs的生成量是高脂组的1.40 倍。
2.7 虾青素对C57BL/6J小鼠肝脏中与脂肪合成相关基因表达水平的影响
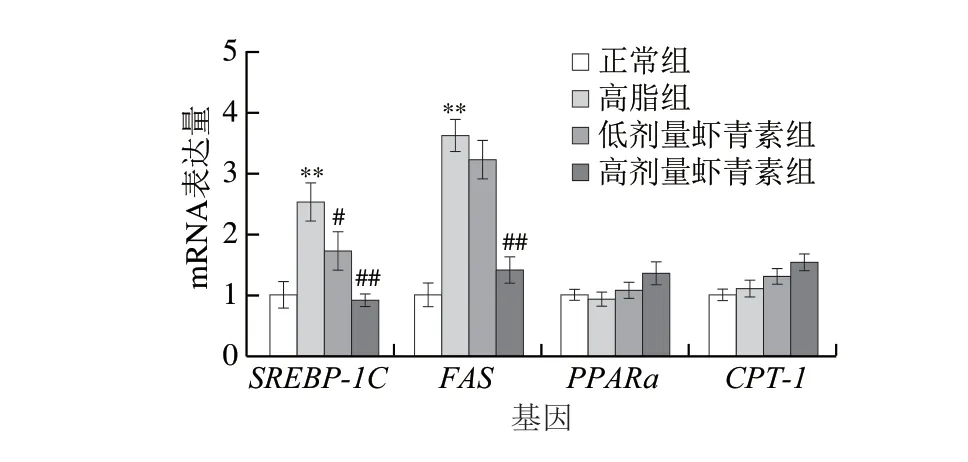
图 6 虾青素对C57BL/6J小鼠肝脏中基因SREBP-1C、FAS、PPARa mRNA和CPT-1 mRNA表达的影响Fig. 6 Effect of astaxanthin on the mRNA expression levels of genes related to lipid synthesis in C57BL/6J mouse liver
由图6可知,FAS是内源性脂肪酸合成的限速酶,在控制脂肪酸合成中具有重要作用。与高脂组相比,高剂量虾青素干预组FASmRNA和SREBP-1CmRNA相对表达量均极显著降低(P<0.01),高剂量虾青素组PPARαmRNA和CPT-1mRNA相对表达量提高。
3 讨 论
血脂水平异常是动脉粥样硬化和冠心病等心血管疾病的重要危险因素,因此将血脂水平维持在正常范围对心血管疾病的预防和治愈有着重要意义[22]。研究表明高脂膳食会导致血脂异常,提高血清中TC、TG、低密度脂蛋白胆固醇水平[23-24]。本实验结果显示,高脂膳食会引起肝细胞损伤,导致血清中TG水平增加,并在肝细胞内沉积,诱导肝脏中脂肪变性,给予一定剂量的虾青素可以降低血清中TC、TG、非HDL-C水平,显著升高HDL-C水平,对于调节血脂水平具有重要作用,并且通过降低脂肪含量改善由高脂膳食诱导的肝损伤。
此外,细胞实验结果同样显示虾青素能够显著降低细胞中脂肪含量和胆固醇水平。通过对肝脏中与脂肪相关基因表达水平的分析,可以看出高脂饮食导致FASmRNA和SREBP-1CmRNA表达水平显著升高,给予虾青素干预后逆转这种改变。与高脂组的表达水平相比,FAS是催化脂肪酸从头合成的关键酶,添加虾青素干预,FASmRNA表达及其代表的内源性脂肪酸合成受到抑制[25]。SREBP-1C是调控TG合成相关的靶基因,并且能激活脂质合成[26]。与高脂组相比,虾青素下调SREBP-1C基因及其靶基因FAS的表达,进而减少血清中内TG水平。CPT-1是脂肪酸β氧化的限速酶[27],在脂肪代谢中发挥重要作用。PPARα是调控CPT-1mRNA表达的上游基因,PPARα被高脂饮食激活后将诱导CPT-1mRNA的表达,增加CPT-1的合成,促进脂肪酸β氧化,减少脂肪酸在肝细胞内的沉积,减轻肝细胞的脂肪变性[28]。结果显示,高剂量虾青素组小鼠的PPARαmRNA和CPT-1mRNA的表达增高,说明肝细胞在高脂饮食的诱导下,增强肝细胞内的脂肪酸β氧化,减轻肝细胞的脂肪性变。
SCFAs对能量代谢的多重影响已经被证明,SCFAs从肠腔被运输到宿主的血液,并被机体的各器官吸收,其可在器官中作为底物或信号分子调节脂质代谢[29]。本实验中,虾青素促进主要SCFAs(乙酸、丙酸和丁酸)的产生,进而总SCFAs的产生增加,结果显示虾青素可通过SCFAs依赖途径调节脂质代谢。
综上所述,虾青素可减少HepG2细胞中脂滴含量,调节高脂膳食饲喂C57BL/6J小鼠血脂水平和粪便中SCFAs的含量、改善肝脏病理状态、调控肝脏中脂肪合成相关基因的表达并对血脂代谢起到调节作用,推测其具有较好的降血脂生物活性,其作用机制有待进一步研究。

