裸燕麦球蛋白源多肽作用于D-半乳糖致衰老小鼠的代谢组学研究
付 媛,张美莉,高韶辉,张 宇
(1.内蒙古农业大学理学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
代谢组学是对生物体内所有代谢物进行定量分析,并寻找代谢物与生理病理变化的相对关系的一种研究方法,其研究对象大多是相对分子质量小于1 000的小分子物质,是20世纪90年代发展起来的一门跨领域学科[1-2]。液相色谱-质谱联用(liquid chromatograph-mass spectrometer,LC-MS)技术是代谢组学研究中非常重要的一种手段和方法,近年来由于超高效液相色谱(ultra high performance liquid chromatography,UPLC)的广泛应用,UPLC与四极杆-飞行时间(quadrupole-time-of-flight,Q-TOF)MS联用技术已经被广泛用于代谢组学研究。代谢组学的分析中,对样品进行提取及衍生化反应获得相应的LC-MS总离子流图,建立数学模型,从而获得生物体内源性代谢产物的变量,然后利用MS中强大的谱图解析功能或图谱库检索系统进行识别分析,再对引起这些代谢物变化的生物学意义进行解释[3-4]。
裸燕麦又称莜麦,其富含蛋白质、不饱和脂肪酸、膳食纤维、维生素、矿物质等,是我国高寒地区重要的粮食作物之一。近年来,对于燕麦蛋白来源的抗氧化剂——燕麦肽的研究报道逐渐增多。蔺瑞[5]利用碱性蛋白酶对裸燕麦球蛋白进行酶解,分别得到分子质量为1.1×104~1.3×105Da及114~861 Da的两种组分,并且测得后者具有较强的清除O2-·、·OH、1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)自由基的能力。任清等[6]将燕麦麸蛋白酶解后制备得到的抗氧化肽对DPPH自由基清除率可达57.39%。本课题组前期研究发现,裸燕麦球蛋白源多肽(peptide from naked oats globulin,PNOG)可以有效提高D-半乳糖(D-galactose,D-gal)致衰老小鼠血清中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及过氧化氢酶(catalase,CAT)的活性,增强肝、脑组织中GSH-Px活性,降低肝、脑组织中单胺氧化酶-B(monoamine oxidase B,MAO-B)活力以及丙二醛(malonic dialdehyde,MDA)含量[7],表明PNOG可清除衰老小鼠体内过多的自由基,减少其对机体的损害。由此可见,PNOG具有强抗氧化作用,但目前对其抗氧化机制却鲜有报道。本实验采用UPLC-Q-TOF MS/MS分析正常对照组、衰老模型组、PNOG治疗组小鼠脑组织的代谢指纹图,并筛选出脑组织代谢中具有显著差异的代谢标志物及作用通路。从代谢组学角度研究D-gal致衰老小鼠被PNOG干预后的代谢通路和PNOG发挥抗氧化功效的作用机制,为燕麦抗氧化作用机理的研究提供新的思路和依据。
1 材料与方法
1.1 动物、材料与试剂
健康昆明种小白鼠,雄性,体质量(20±2)g,生产许可证号:SCXK(蒙)2016-0001,购自内蒙古大学实验动物部。
裸燕麦产于内蒙古武川县,晒干后粉碎,过60 目筛,备用。
D-gal 美国Sigma公司;碱性蛋白酶(活力200 000 U/g) 英国BDH Chemicals有限公司;乙腈、乙酸铵、甲醇、氨水 德国Merck公司。
1.2 仪器与设备
SCIENTZ-12N冷冻干燥机 宁波新芝生物科技股份有限公司;SQP型万分之一分析天平 德国赛多利斯科学仪器有限公司;H2500R-2高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;DZ-1BCII真空干燥箱 天津市泰斯特仪器有限公司;TripleTOF 5600+质谱仪 美国SCIEX公司; 1290 Infinity LC UPLC系统 美国Agilent公司。
1.3 方法
1.3.1 裸燕麦球蛋白源多肽的制备及结构鉴定
按本实验室方法制备裸燕麦多肽[5]:裸燕麦粉经石油醚脱脂,10 g/100 mL NaCl溶液提取,利用碱性蛋白酶(酶用量10 000 U/g)、质量浓度5 g/100 mL底物在温度60 ℃、pH 9.0下水解3 h,再经过Sephadex G-25凝胶柱层析分离收集抗氧化性强的组分II,经冷冻干燥,制得PNOG。并利用UPLC-MS技术对其进行氨基酸序列鉴定,所得数据提交UniProt数据库,得到PNOG的氨基酸序列。
1.3.2 实验动物分组及处理
参照文献[8-10]的分组方法,昆明种健康小鼠24 只,适应性喂养一周后,随机分为3 组,分别为正常对照组、衰老模型组、裸燕麦球蛋白源多肽(PNOG)治疗组。除了正常对照组以外,其他各组按120 mg/(kgmb·d)颈背部皮下注射D-gal,正常对照组注射等量生理盐水;PNOG治疗组每日灌胃PNOG 1 000 mg/(kgmb·d),其他组灌胃等量生理盐水。每日定时灌胃、注射一次,连续6 周,期间自由饮食饮水,观察小鼠体征表现。
1.3.3 样品采集与预处理
末次给药后禁食12 h,断颈处死,解剖小鼠,迅速取出脑组织,用4 ℃生理盐水冲洗表面残血,滤纸吸干水分,用液氮速冷后,样品保存于-80 ℃冰箱中待测。
1.3.4 UPLC-MS代谢组学分析
代谢物提取:取脑组织样本液氮研磨成粉末100 mg,加入1 mL甲醇/乙腈/水(体积比为2∶2∶1),漩涡混匀,低温下超声破碎30 min,-20 ℃孵育1 h沉淀蛋白质,4 ℃、13 000 r/min离心15 min,取上清液进行冻干,-80 ℃保存待用。分析时加入10 μL体积分数50%乙腈溶液复溶,漩涡振荡,4 ℃、14 000×g离心15 min,取上清液进行进样分析。
色谱条件:采用1290 Infinity LC UPLC系统,使用HILIC色谱柱进行分离。进样量10 μL、柱温25 ℃、流速0.3 mL/min;色谱流动相A:水+乙酸铵(0.025 mol/L)+氨水(0.025 mol/L)、流动相B:乙腈;色谱梯度洗脱程序如下:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~9 min,65%~40% B;9~10 min,40% B;10~11.1 min,40%~95% B;11.1~16 min,95% B。同时样本队列中插入质控样本(quality control,QC),用于监测系统的稳定性及数据的可靠性。
质谱条件:样品分别采用电喷雾电离(electrospray ionization,ESI)进行正离子和负离子模式检测。样品经过UPLC分离后用TripleTOF 5600质谱仪基于信息采集(information dependent acquisition ,IDA)功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子采集对应的二级质谱数据。轰击能量:30 eV。ESI离子源参数设置如下:雾化气压60 Pa、辅助气压60 Pa、气帘气压30 Pa、辅助气压60 Pa、温度600 ℃、喷雾电压±5.5 kV(正负离子模式)。
1.4 数据统计与分析
U P L C-Q-T O F M S/M S 采集的原始数据经ProteoWizard程序转换格式,再经XCMS程序进行峰对齐、保留时间校正和提取峰面积。采用精确质量数匹配和二级谱图匹配的方式检索Metlin、HMDB和MassBank数据库对代谢物进行结构鉴定。对XCMS提取得到的数据应用SIMCA-P 14.1程序进行模式识别,再经Pareto-scaling程序预处理后,进行无监督主成分分析(principal components analysis,PCA)和正交偏最小二乘法判别分析(orthogonal projection to latent structures,OPLS-DA)。以OPLS-DA模型得到的变量权重值(variable importance for the projection,VIP)大于1为筛选标准,初步筛选出各组间的差异物。再进一步采用单变量统计分析,得到P值。选择VIP>1且P<0.05的代谢物作为具有显著性差异的代谢物;而VIP>1且0.05<P<0.1则作为差异代谢物。将得到的显著性差异代谢物进行KEGG ID Mapping,并提交到KEGG网站进行相关通路分析。
2 结果与分析
2.1 PNOG结构鉴定结果
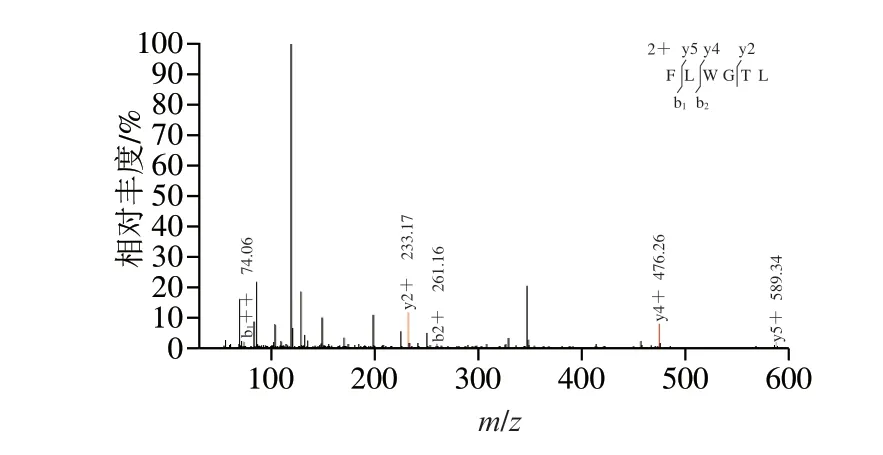
图 1 PNOG的二级质谱图Fig. 1 Tandem mass spectrum of PNOG
通过UPLC-MS/MS技术分析PNOG结构,其结果如图1所示,将质谱图结果提交Uniprot数据,经鉴定,PNOG的氨基酸序列为:苯丙氨酸-亮氨酸-色氨酸-甘氨酸-苏氨酸-亮氨酸(Phe-Leu-Trp-Gly-Thr-Leu,FLWGTL)。
国内外很多研究发现,抗氧化肽中Leu残基出现的频率比较高[11-13],本实验中测得PNOG的氨基酸序列为Phe-Leu-Trp-Gly-Thr-Leu,Leu出现频率也非常高,故而PNOG的抗氧化性可能与此有关。Leu是一种调节因子,杨力源[14]研究发现,Leu可通过抑制促炎细胞因子的表达,起到抗氧化、延缓机体衰老的作用。Rojas-Ronquillo等[15]研究发现,苯丙氨酸等芳香族氨基酸暴露在两端的多肽表现出更好的抗氧化性;Babini等[16]研究发现色氨酸是抗氧化肽中典型氨基酸之一,这可能是由于苯丙氨酸和色氨酸均具有苯环,具有供氢能力,能减缓自由基链式反应。
2.2 小鼠脑组织UPLC-Q-TOF MS分析结果
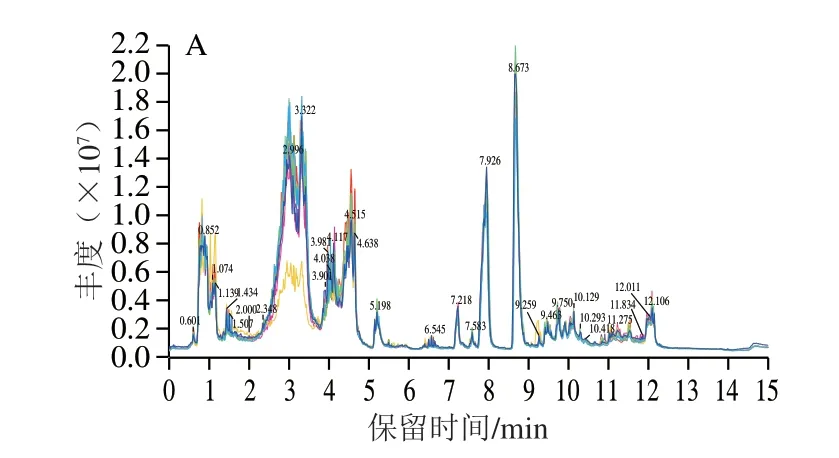

图 2 UPLC-Q-TOF MS采集的小鼠脑样品典型总离子流色谱图Fig. 2 Typical total ion current chromatograms of metabolites in brain tissues obtained by UPLC-Q-TOF MS
采用UPLC-Q-TOF MS在正离子模式下采集脑组织样本的代谢信息,其中图2D为质控样本在正离子模式下的总离子流图,结果表明各色谱峰的响应强度和保留时间基本重叠,表明实验误差小、数据可靠。从图2A~C总离子流图上可以看出各组色谱峰保留时间基本一致,同一时间色谱峰高度有差别,表明正常对照组、衰老模型组与PNOG治疗组小鼠脑组织中内源性代谢物含量出现了差异,即表示代谢模式发生了变化。
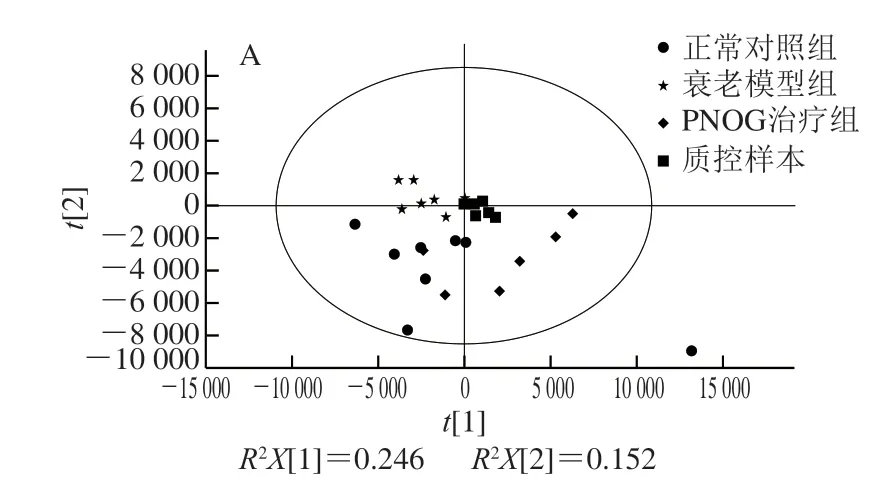

图 3 小鼠脑样本的PCA得分图Fig. 3 PCA score plots of mouse brain samples
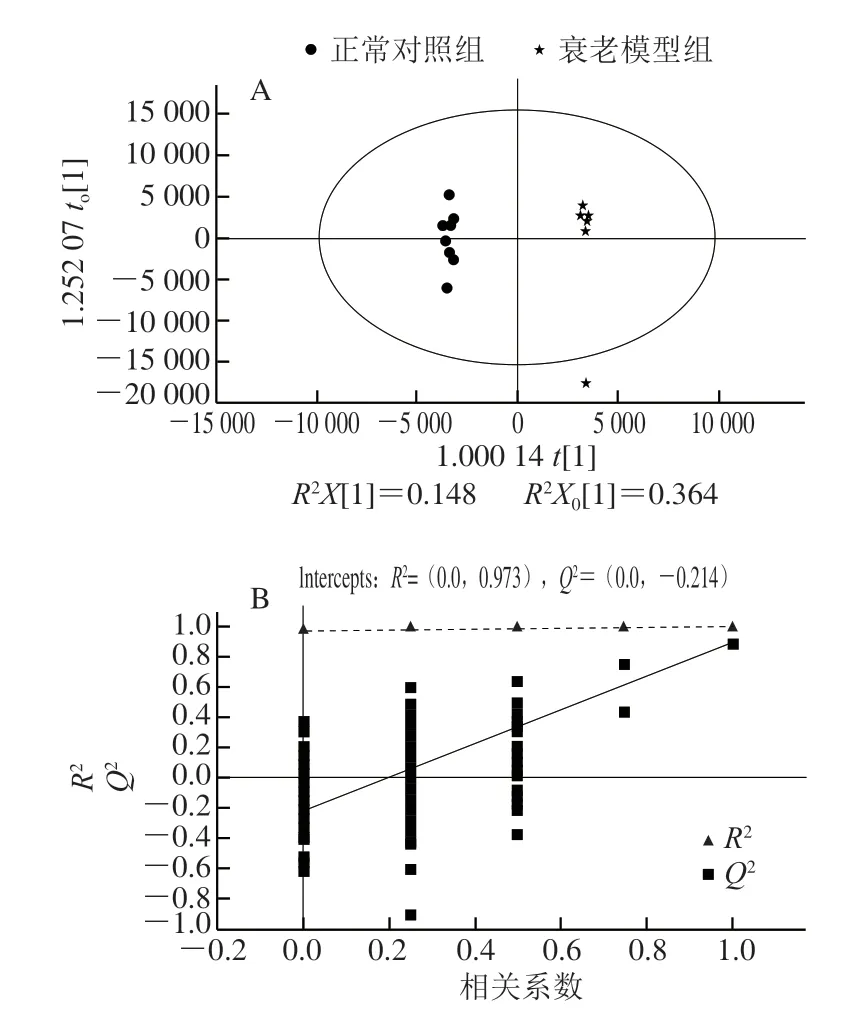
图 4 衰老模型组和对照组小鼠脑样本的OPLS-DA得分图(A)及置换检验图(B)Fig. 4 OPLS-DA score plot (A) and permutation test chart (B) of mouse brain samples between aging model and control groups
将经过预处理的UPLC-Q-TOF MS数据进行PCA,获得各个小鼠脑样本在空间上的分布情况,由图3可知,质控样本较为紧密地聚集在一起,表明本实验的重复性良好,实验数据稳定可靠,在实验中获得的代谢谱差异能反映样本间本身的生物学差异。正常对照组与衰老模型组以及衰老模型组与PNOG治疗组各样本明显分离,显示出显著差异,说明小鼠经过连续6 周颈背部皮下注射120 mg/(kgmb·d)D-gal造模后,其脑组织中内源性代谢物发生了明显变化,出现了代谢紊乱。另外,PNOG治疗组各样本点显示出不同程度地向正常对照组靠近的趋势,说明灌胃PNOG后,可有效调节衰老小鼠体内的代谢紊乱,起到抗氧化作用。

图 5 PNOG治疗组和衰老模型组小鼠脑样本的OPLS-DA得分图(A)及置换检验图(B)Fig. 5 OPLS-DA Score plots (A) and permutation test charts (B) of mouse brain samples between PNOG and aging model groups
为了进一步验证正常对照组、衰老模型组和PNOG治疗组小鼠脑样本的分离情况,并从中识别出标志代谢物,对各数据组进行OPLS-DA分析,对脑组织样本的代谢全谱进行区分,其得分图及置换检验见图4、5。其中,由图4B可知,R2X(cum)=0.7、R2Y(cum)=0.998、Q2(cum)=0.894,即表明可以用70%的变量解释了99.8%的组间差异,预测能力为89.4%;由图5B可知,R2X(cum)=0.452、R2Y(cum)=0.934、Q2(cum)=0.681,均具有较高的解释率和预测率,表明该模型是可靠的。
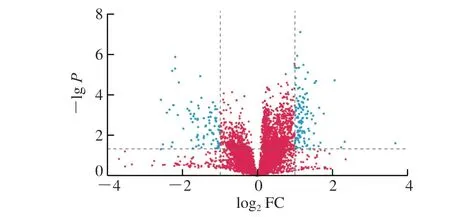
图 6 PNOG治疗组对比衰老模型组小鼠脑样本正离子模式下的火山图Fig. 6 Volcano plot of PNOG-treatment versus aging model groups under positive ion mode
在进行两组样本间的差异代谢物分析时,火山图是常用的单变量分析方法。图6为衰老模型组与PNOG治疗组正离子模式数据的火山图,图中蓝色点为变异倍数(fold change,FC)>2或FC<0.5且P<0.05的代谢物,即筛选出的差异代谢物。
2.3 层次聚类分析结果
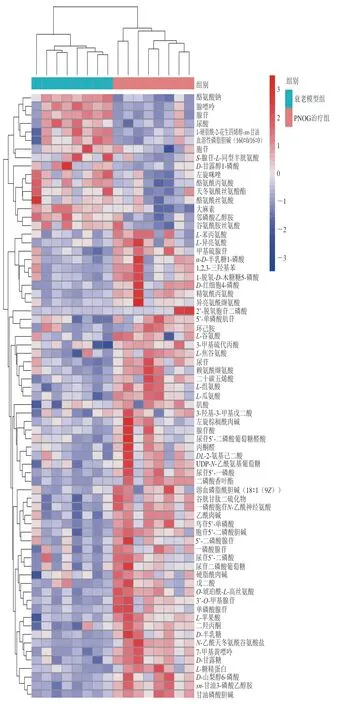
图 7 PNOG治疗组对比衰老模型组小鼠脑样本显著性差异代谢物层次聚类结果Fig. 7 Heat map for brain metabolites in PNOG-treated versus aging model groups
对各组样本进行层次聚类分析可更直观地显示样本之间的关系以及代谢物在不同样本中的表达模式上的差异,图7显示了PNOG治疗组与衰老模型组两组样本间进行比较的显著性差异代谢物层次聚类结果。可以看出,衰老模型组与PNOG治疗组的样本很明显地分为两簇,两组间的主要差异代谢物有磷脂、脂肪酸、氨基酸、嘌呤代谢物等,同时也提示PNOG抗氧化的机制可能会涉及到甘油磷脂代谢、脂肪酸代谢、嘌呤代谢、氨基酸代谢等代谢途径。
2.4 显著差异代谢物筛选及相关通路分析结果
利用OPLS-PA模型的VIP值并结合火山图及聚类分析法,筛选出显著差异代谢物并进行KEGG ID Mapping,并提交到KEGG网站进行相关通路分析,结果如表1所示。

表 1 衰老模型组、正常对照组及PNOG组显著差异代谢物筛选Table 1 Screening of differentially expressed metabolites among aging model, control and PNOG-treated groups
与衰老模型组相比,PNOG治疗组小鼠脑组织中乙酰胆碱、甘油磷酸胆碱、胞苷5’-二磷酸(cytidine 5’-diphosphocholine,CDP)-胆碱、溶血磷脂酰胆碱、sn-甘油3-磷酸乙醇胺、L-肉碱、L-棕榈酰肉碱、二十碳五烯酸(eicosapentaenoic acid,EPA)、一磷酸腺苷(adenosine monophosphate,AMP)、腺苷5’-二磷酸(adenosine 5’-diphosphate,ADP)、次黄嘌呤核苷酸(inosine 5’-monophosphate,IMP)、3-甲基硫代丙酸盐、N-乙酰天冬氨酰氨基甲酸(N-acetylaspartylglutamate,NAAG)这13 种物质含量升高;腺嘌呤、腺苷、尿酸、S-腺苷-L-同型半胱氨酸这4 种物质含量降低;而与正常对照组相比,衰老模型组小鼠脑样本的显著差异代谢物含量的变化趋势恰好与其相反。结果显示,这17 种显著差异代谢物涉及了甘油磷脂代谢、脂肪酸代谢、不饱和脂肪酸的生物合成、嘌呤代谢、半胱氨酸和蛋氨酸代谢、神经活性配体-受体相互作用等途径。
乙酰胆碱是脑组织中重要的神经递质,发挥着调节学习记忆功能的作用[17-18]。随着衰老的发生,体内产生的大量自由基会对胆碱乙酰化转移酶等蛋白质进行攻击,进而影响乙酰胆碱的合成,乙酰胆碱含量的降低会造成学习记忆能力的减退[17]。本实验结果表明,与正常对照组相比,衰老模型组小鼠脑组织中的乙酰胆碱含量显著降低(FC=0.78,且P<0.01),说明D-gal致衰老小鼠胆碱系统功能降低。长期灌胃一定量的PNOG可显著提高衰老小鼠脑组织中乙酰胆碱含量(FC=1.32,且P<0.01),说明PNOG可清除体内大量活性氧,减缓胆碱乙酰化转移酶等的氧化损伤,提高小鼠体内的抗氧化能力。
甘油磷酸胆碱是生物合成乙酰胆碱的重要前体[19-20];CDP-胆碱是生物合成磷脂酰胆碱时的中间体,磷脂酰胆碱是构成生物细胞膜的主要成分,且其在脑神经细胞中约占17%~20%[21-23]。大脑可直接从血液中摄取磷脂酰胆碱及胆碱,并将其迅速转化为乙酰胆碱,从而提高脑细胞的活性、改善脑功能[24]。本实验结果表明,灌胃PNOG后,可明显改善甘油磷脂代谢,显著提高D-gal致衰老小鼠体内甘油磷酸胆碱及CDP-胆碱的含量(FC分别为2.41和1.31,且P<0.01),从而进一步提高脑组织中乙酰胆碱的含量,提高大脑的学习记忆能力,延缓衰老。
溶血磷脂酰胆碱是磷脂的降解产物,其含量的异常很大程度上意味着磷脂代谢的紊乱。溶血磷脂酰胆碱不仅与维持细胞膜结构的完整性和稳定性密切相关,还可以作为第二信使参与细胞多种信号转导过程[25]。溶血磷脂酰胆碱的含量随年龄增加而减少也可能与细胞的凋亡机制有关,或者是在提示机体内存在能量代谢障碍和氧化损伤[26-27]。本实验结果表明,与正常对照组相比D-gal致衰老小鼠体内溶血磷脂酰胆碱含量降低(FC为0.87,且P<0.05),而灌胃PNOG后,D-gal致衰老小鼠体内其含量有所升高(FC为1.13,且P<0.05),说明PNOG可有效改善D-gal致衰老小鼠机体内的磷脂代谢紊乱、能量代谢障碍及氧化损伤。
肉碱在脂肪酸代谢中必不可少,脂肪酸必须借助肉碱才能进入线粒体发生β氧化;EPA不仅是大脑的重要营养成分,而且可以保持细胞膜的流动性及通透性以维持细胞的正常生理功能,促进脂肪酸的β氧化[28-30]。本实验中,衰老模型小鼠脑组织中肉碱及不饱和脂肪酸的含量均降低,表明可能存在脂肪酸代谢异常;而灌胃PNOG后,小鼠体内L-肉碱、L-棕榈酰肉碱、EPA含量显著上升(FC分别为1.12、1.46和1.47,且P<0.05),提示PNOG可改善D-gal致衰老小鼠的脂肪酸代谢异常。
在正常机体代谢中,在半乳糖激酶的作用下,半乳糖与ATP反应生成半乳糖-1-磷酸和ADP;在半乳糖-1-磷酸尿苷酰转移酶及尿苷二磷酸4位差向异构酶作用下,半乳糖-1-磷酸可生成葡萄糖-1-磷酸参与葡萄糖代谢。但过量供给D-gal时,在半乳糖激酶的作用下,半乳糖磷酸化时会消耗大量ATP,生成大量ADP,ADP进一步形成AMP,AMP大量增加,嘌呤代谢酶系统被激活,AMP在核苷酶作用下,生成腺苷,腺苷在腺苷脱氨酶(adenosine deaminase,ADA)的作用下生成IMP,进而其在黄嘌呤氧化酶(xanthine oxidase,XOD)的作用下生成尿酸[31-32]。尿酸虽然可以将体内部分自由基清除,但是,由于其具有特殊的环状结构,更容易产生氧化性更强的自由基,导致细胞的损伤[33-34]。衰老模型组小鼠与正常组小鼠对比,体内腺苷、腺嘌呤含量都明显增大,表明衰老模型组小鼠体内出现腺嘌呤代谢紊乱。越来越多的研究显示,嘌呤的代谢紊乱在许多神经系统疾病的发病机制中起关键作用[32-34]。当灌胃PNOG后,D-gal致衰老小鼠体内腺苷、腺嘌呤以及尿酸含量明显下降(FC分别为0.34、0.28和0.64,且P<0.01),ADP、AMP、IMP含量明显升高(FC分别为1.41、1.35和1.32,且P<0.05),说明PNOG可以通过调控核苷酶减缓AMP生成腺苷的速度,使腺苷、腺嘌呤、尿酸的含量明显降低,从而使腺嘌呤代谢趋于正常。
S-腺苷-L-同型半胱氨酸脱去腺苷后,即可形成同型半胱氨酸(homocysteine,HCY)。研究表明,HCY是一种兴奋性氨基酸,通过激活代谢型谷氨酸或离子型受体,造成钙离子内流,从而损伤线粒体及激活蛋白酶、磷酸酯酶等,导致细胞代谢障碍[35-36]。灌胃PNOG后,可有效降低机体内S-腺苷-L-同型半胱氨酸的含量(FC为0.72,且P<0.05),对神经系统起到保护作用。
NAAG是一种重要的内源性神经保护递质,具有极强的抑制谷氨酸释放的作用[37];而谷氨酸的过度释放可导致细胞的衰老、死亡[38-39]。与衰老模型组小鼠相比,灌胃PNOG后,小鼠体内NAAG含量明显提高(FC为1.98,且P<0.01),可有效抑制谷氨酸的过度释放,起到延缓衰老的作用。
实验结果表明灌胃PNOG后,D-gal致衰老小鼠代谢通路的紊乱都得到了改善,从代谢组学的角度验证了PNOG可清除体内过多的自由基,起到抗衰老、抗氧化的作用,这可能与PNOG的氨基酸序列中Leu出现频率高、Phe出现在C端以及序列中出现Trp有关。
3 结 论
采用基于UPLC-Q-TOF MS的代谢组学方法,并结合多元统计学研究了D-gal致衰老小鼠在PNOG干预下的脑组织代谢变化,共筛选出17 种显著差异代谢物及其参与的6 条代谢通路,揭示了灌胃PNOG后对D-gal致衰老小鼠体内代谢紊乱干预的作用机制。结果表明:PNOG可通过升高小鼠脑组织中乙酰胆碱、甘油磷酸胆碱、溶血磷脂酰胆碱、CDP-胆碱、sn-甘油3-磷酸乙醇胺含量,从而改善D-gal致衰老小鼠体内甘油磷脂代谢;可通过升高L-肉碱、L-棕榈酰肉碱含量,从而促进脂肪酸的β氧化,并使紊乱的脂肪酸代谢得到恢复;可通过改善不饱和脂肪酸的生物合成来升高EPA含量,提高机体清除自由基的能力;另外,PNOG可通过调节嘌呤代谢,从而降低腺嘌呤、腺苷、尿酸含量,缓解衰老小鼠的体内的氧化应激;PNOG还可通过调节半胱氨酸和蛋氨酸代谢、神经活性配体-受体相互作用,从而降低S-腺苷-L-同型半胱氨酸含量,升高小鼠体内NAAG含量,对小鼠的神经系统起到保护作用,延缓衰老、抗氧化。

