姜黄素对兔耳增生性瘢痕的抑制作用研究
赵凌昆,陈丽娟,郭云辉,孙琪,吕红梅*
(1.佳木斯大学临床医学院,黑龙江 佳木斯 154002; 2.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007)
增生性瘢痕(HS)是创伤修复的必然产物,严重影响机体的正常功能及美观,给患者心理和身体带来极大的痛苦。由于其确切发病机制尚不明确,故目前临床中无特异性根治方法[1]。外科手术切除、药物治疗、加压及激光治疗等方法是近些年来临床上常用的治疗HS的方法,虽然取得较好的治疗效果,但存在着治疗周期长、复发率高以及副作用大等缺点[2-3]。故从天然药物中筛选更为安全、有效的药物治疗更显尤为迫切。
姜黄素是从我国传统中药——姜黄等的根茎中提取得到的多酚类活性物质,不仅具有消除炎症、抵抗自由基、抑制肿瘤发生发展的作用,还具有抗纤维化的作用[4],增生性瘢痕即是瘢痕过度纤维化的表现。故本实验以兔耳瘢痕模型为研究对象,探讨姜黄素对增生性瘢痕的治疗效果及作用机制,为姜黄素的进一步开发提供新的思路。
1 材料与方法
1.1 材料
姜黄素(美国Sigma公司);黄凡士林(上海商玺伟康医药用品有限公司);液体石蜡(国药集团化学试剂有限公司);复方醋酸地塞米松乳膏(芜湖三益制药有限公司);戊巴比妥钠(美国Sigma公司);免疫组化试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司);鼠抗人Ki67多克隆隆抗体、兔抗人α-SMA单克隆抗体(英国Abcom公司);石蜡切片机Leica(德国);电热恒温干燥箱(沈阳市医疗器械厂);格兰仕微波炉(顺德格兰仕微波炉电器有限公司);显微镜(DM 2000)(奥林巴斯株式会社)。
1.2 方法
1.2.1 瘢痕模型的建立
清洁级新西兰大白兔12只,雌雄不限,体质量2.0~2.7 kg,由辽宁长生生物技术有限公司提供,适应性喂养3 d。根据李荟元等[5]建立的兔耳增生性瘢痕动物模型方法,3 g/100 mL戊巴比妥钠(30 mg/kg)耳缘静脉麻醉,75%酒精消毒,严格无菌操作,在兔耳腹侧中段沿长轴避开可见血管,做6个直径为1 cm的圆形全层皮肤缺损创面,每个创面间隔1 cm以上,创面深达软骨层,完整去除软骨膜,压迫止血后创面暴露,自行愈合。
1.2.2 实验分组及给药
瘢痕完全上皮化后将动物随机分为3组,瘢痕模型组(B组)不予特殊处理,姜黄素组(C组)涂抹质量分数为10%姜黄素软膏(通过预实验筛选确定,姜黄素∶凡士林∶液体石蜡=1∶7∶2),地塞米松阳性药对照组(D组)涂抹地塞米松软膏。每次用量0.1 g,每日2次,连续用药28 d。另留取3只为正常皮肤对照组(A组)。实验结束后将白兔处死,每组各获得标本36个。
1.2.3 HE染色观察
各组标本用4%甲醛溶液固定,酒精、二甲苯脱水、石蜡包埋,4 μm厚度切片, 按照苏木素-伊红(HE)染色操作步骤进行。显微镜下观察各组标本的病理学改变;低倍镜下测量疤痕增生指数(HI)[6]。高倍镜下计算各组瘢痕中单位面积的成纤维细胞数目(NA)。
HI=瘢痕最高点到软骨的垂直距离/正常皮肤到软骨的距离
1.2.4 免疫组化染色观察
石蜡切片经二甲苯脱蜡,梯度酒精水化,甲醇-过氧化氢液封闭,消除内源性过氧化物酶活性,根据抗体要求,按照免疫组化操作步骤进行(SP法),滴加抗Ki67多克隆抗体及抗α-SMA单克隆抗体,DAB显色,出现棕黄色阳性细胞时,终止反应,封片固定。高倍镜(×400)下随机选取5个部位,采用半定量记分法,根据阳性细胞的染色强度及阳性细胞百分率进行综合评分。0分为无色或无细胞染色;1分为浅黄色或阳性细胞≤25%;2分为棕黄色或阳性细胞26%~50%;3分为棕褐色或阳性细胞>50%;二者相加后0~2分为阴性,3~6分为阳性。
1.2.5 统计学处理
2 结果
2.1 一般情况
模型组中瘢痕明显高出周围正常组织,厚度约为正常皮肤的2.5倍,质地较硬,淡红色;姜黄素组及地塞米松组中瘢痕体积均减小,质地变软,淡粉色,基本接近正常肤色;各组瘢痕均未超出原创伤范围。
2.2 组织学观察
正常组织中成纤维细胞数目少,密度低,胶原纤维排列整齐。模型组中可见真皮层增厚,大量成纤维细胞及胶原纤维堆积,胶原纤维排列紊乱并伴有炎细胞浸润;姜黄素组及地塞米松组成纤维细胞及炎细胞明显减少,胶原纤维排列相对规则。见图1。
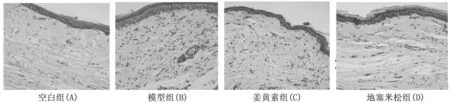
图1 HE染色结果(×200)
2.3 瘢痕增生指数HI
HI被认为是评估瘢痕形成的最客观标准,瘢痕增生过程中细胞的增殖,细胞外基质的沉积,上皮的增厚,都可以通过它来进行量化描述[6]。模型组中HI显著高于空白组,差异有统计学意义(P<0.05);姜黄素组及地塞米松组中HI均较模型组降低,与模型组差异有统计学意义(P<0.05),但二组之间差异不明显,无统计学意义(P>0.05)。各组的瘢痕增生指数见表1。
2.4 成纤维细胞密度NA
模型组中NA显著高于空白组,差异有统计学意义(P<0.05);药物治疗组中(姜黄素组及地塞米松组)NA均较模型组降低,差异有统计学意义(P<0.05),但二组之间差异不明显,无统计学意义(P>0.05)。各组的成纤维细胞密度见表1。
表1 各组兔耳瘢痕增生指数、成纤维细胞密度的比较
2.5 免疫组织化学染色结果
免疫组织化学结果显示:Ki-67及α-SMA阳性表达分别位于胞核及胞浆内,呈黄色或棕黄色,正常组织中表达极少,模型组织中可见较多的阳性表达,二组差异有统计学意义(P<0.05);在药物治疗组中,Ki-67及α-SMA表达量均较模型组明显下降,差异有统计学意义(P<0.05),但二组之间差异不明显。具体结果见表2。

表2 各组兔耳Ki67、α-SMA阳性表达水平变化[n(%)]
3 讨论
HS是纤维结缔组织过度增生性疾病,迄今为止,尚无理想药物治疗。我国传统中药在治疗瘢痕方面有着悠久历史,如积雪草苷、苦参碱、丹参酮ⅡA、血竭素B、地龙等均在治疗瘢痕方面取得良好效果[7]。姜黄是我国常见的一种中药,《新修本草》中记载姜黄具有活血行气、通经止痛的功效,归肝、脾经。临床广泛应用于血瘀气滞诸痛,痹证[8]。姜黄素是姜黄中提取的主要活性成分,现代医学研究表明姜黄素不仅具有抗炎、抗氧化、抗肿瘤、调脂、抗组织损伤等作用,在预防及治疗肝脏,肺脏等器官纤维化疾病中亦具有明显的效果[4],因此姜黄素在对抗纤维化疾病中具有潜在的应用前景,有望成为治疗HS的一线用药。
在本实验中,成功建立了兔耳瘢痕模型,每组获得36个瘢痕创面,具有统计学意义。实验结果表明:姜黄素对兔耳瘢痕有明显抑制作用,在药物治疗组中(姜黄素组及地塞米松组)瘢痕体积均减小,质地变软,颜色变浅,具有向正常皮肤转化的趋势,组织学上也证实了这一结论,药物治疗后HE切片显示瘢痕中Fb及炎细胞减少,胶原纤维排列相对规则,同时HI及NA这些量化指标检测结果也提供了强有利的证据,姜黄素组中HI及NA均较模型组小,差异有统计学意义(P<0.05)。
HS作为病理性瘢痕的一种,Fb的异常增殖及向MFb转化是HS发生、发展的关键因素之一[9]。研究表明,在创伤发生后6 d左右Fb在TGF-β1的诱导作用下向MFb转化。MFb不仅高表达α-SMA,还具有强大的合成和分泌胶原蛋白为主要成分的细胞外基质的功能[10]。因此通过α-SMA蛋白的检测可以反映组织中MFb的数量。本实验结果显示:α-SMA在正常组织中极少表达5(13.89%),模型组中大量表达22(61.11%),二者具有统计学意义;经姜黄素治疗后,α-SMA蛋白由模型组的22(61.11%)降至13(36.11%),具有明显差异,提示姜黄素可以抑制HS中Fb向MFb转化,减少α-SMA的表达。
Ki67是1983年由 Gerdes 等发现的一种增殖细胞核抗原,是检测细胞增殖活性最可靠的指标[11]。研究结果显示Ki67在正常组织中阳性表达极少3(8.33%),模型组中可见大量阳性表达25(69.44%),而姜黄素组及地塞米松组中Ki67表达量分别为8(22.22%)及10(27.78%),药物治疗组与模型组有明显差异(P<0.05),说明模型组中Fb的大量存在与Fb增殖活跃有关,而姜黄素可以抑制Fb的异常增殖。
目前糖皮质激素类药物是治疗HS的首选药物,但是其副作用大,复发率高,不适合长期应用,具有局限性[12]。而姜黄素具有药源丰富、价格低廉、药效安全稳定等优点,故深入开展对姜黄素的研究具有重要的理论及现实意义。

