新疆伊犁地区乳制品中乳酸菌发酵和益生特性及其复合发酵方案优化
蔡静静,张亚川,李 谞,张 艳,倪永清
(石河子大学食品学院,新疆 石河子 832000)
乳酸菌是指一类可以利用碳水化合物发酵产生乳酸的细菌,乳酸菌被应用于人类生活的方方面面,如改善食品风味、延长食品储藏期、促进人体健康。
酸乳是乳酸菌在代谢过程中发生酸化作用得到的一款产品,乳酸菌会对牛乳的理化、感官和微生物组成产生重大影响[1]。发酵乳生产过程中使用的乳酸菌主要包括发酵剂乳酸菌、非发酵剂乳酸菌以及益生乳酸菌。发酵剂乳酸菌是一类能够在乳制品中生长并能产酸凝乳的乳酸菌[2],通常通过评估乳酸菌的产酸速率、产香特性以及改善酸乳质构的能力筛选发酵剂乳酸菌[3]。传统酸乳通常以保加利亚乳杆菌和嗜热链球菌作为发酵剂[4],尽管一些保加利亚乳杆菌具有耐受消化道胃肠液的能力,但是与大多数人用益生菌相比,保加利亚乳杆菌不具有宿主同源性,因此,在酸乳生产中经常会添加一些常用的益生菌提高酸乳的保健价值[5]。益生菌被定义为具有活性的、当达到一定施用量时会对宿主产生有益作用的微生物[6]。益生菌应具有非致病性和非产毒性、抑制病原菌生长、耐受胃肠道环境等特性[7-9],并且还应具有一定的黏附性[10-11]。乳酸菌通常被认为是安全(generally regarded as safe,GRAS)的益生菌,广泛应用于食品和药品的生产中[12]。
新疆是少数民族聚居区之一,少数民族同胞独特的文化习俗以及生活习惯,为优良发酵剂乳酸菌以及益生型乳酸菌的开发提供了丰富的资源。本研究旨在通过对新疆伊犁地区传统乳制品中分离出乳酸菌的发酵和益生特性进行研究,为开发出一款益生型酸奶提供理论依据。
1 材料与方法
1.1 材料与试剂
菌株:XKN1-5为Leuconostoc lactis;BSTS6-1、BSTS6-3、BSTS6-4为Lactobacillus delbrueckiisubsp.bulgaricus;BST2-3为Lactobacillus fermentum;XSXN1-1、XSXN1-2为Streptococcus thermophilus。均为实验室前期从新疆伊犁地区传统乳制品中分离得到。
病原指示菌:出血性大肠埃希氏菌(CICC 21530)、致泻大肠埃希氏菌(CICC 10411)、鼠伤寒沙门氏菌(CICC 10420)、产肠毒素大肠埃希氏菌(CICC 10421)、单核细胞性李斯特菌(CGMCC 1.9136)、血清型肠炎沙门氏菌(CGMCC 1.10754)、金黄色葡萄球(CICC 21600),购自中国工业微生物菌种保存管理中心。
全脂乳粉(蛋白质38%、脂肪53%) 新疆石河子花园乳业有限公司;丁二酮 北京索莱宝生物科技公司。
1.2 仪器与设备
TA.XTPlus质构仪 英国SMS公司;RVDV-III流变仪 美国Strider Tech公司;UV1240外分光光度计 中国睿诚永创公司;5417R高速冷冻离心机德国Eppendorf公司。
1.3 方法
1.3.1 乳酸菌发酵性能分析
1.3.1.1 乳酸菌酸化能力
将单菌株发酵剂以2%的接种量接种于复原乳中,记录凝乳时间,并将样品置于4 ℃保藏备用,取5.0 g冷藏24 h的酸乳样品并加入5 滴0.5%酚酞指示剂,用0.1 mol/L标准NaOH溶液滴定至粉红色,1 min不消失为宜。记录NaOH消耗量及酸乳质量[13]。计算如式(1)所示:
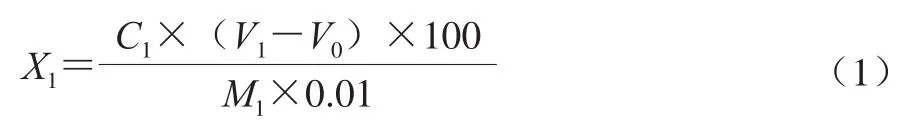
式中:X1为试样的酸度/(°T);C1为NaOH浓度/(mol/L);V1为样品消耗NaOH溶液体积/mL;V0为空白消耗NaOH溶液体积/mL;100为100 g试样;M1为试样的质量/g;0.01为酸度理论定义NaOH浓度/(mol/L)。
1.3.1.2 酸乳感官评价
组织食品专业的20 名研究生,对酸乳样品的色泽、风味、组织状态进行感官评价。感官评价细则参考熊政委等[14],具体评分标准见表1。

表1 感官评分细则Table 1 Criteria for sensory evaluation
1.3.1.3 乳酸菌对酸乳质构特性的影响
全质构分析:利用物性测试仪,P/36 R探头。测试前速率:5.00 mm/s;测试速率:1.00 mm/s;测试后速率:5.00 mm/s;测试距离:30 mm;感应力:Auto(Force)-2 g。由质构特性曲线图得出表征质构状况的评价参数硬度、黏附性、弹性、内聚性和胶黏性[15]。
表观黏度测定:由DHR流变仪在flow peak模式下,剪切速率为10 s-1,在25 ℃条件下测定[16]。
保水性测定:称取15 g酸乳样品于50 mL离心管中,10 000×g离心20 min,酸乳的保水率用离心后剩余沉淀质量与样品质量比值表示[17]。
1.3.1.4 乳酸菌产风味物质能力分析
参考万金敏[18]的方法进行测定。
1)双乙酰含量测定
丁二酮标准曲线的绘制:取15 μL丁二酮溶于蒸馏水中,定容至500 mL。分别量取丁二酮标准溶液0.0、2.0、4.0、6.0、8.0、10.0 mL于编号的12 支双排放置试管中,并用蒸馏水补足至10 mL。向前排6 支试管中加1%的邻苯二胺溶液0.5 mL,后排6 支试管不加邻苯二胺溶液,充分混匀后于黑暗处反应30 min。反应完全后加4.0 mol/L盐酸进行终止反应(前排试管加2.0 mL,后排试管加 2.5 mL,摇匀后以后排试管为空白对照,用紫外分光光度计在335 nm波长下测定吸光度。以丁二酮浓度为横坐标,吸光度为纵坐标绘制标准曲线。根据标准曲线回归方程y=0.116 2x+0.040 7,R2=0.999 9,计算双乙酰含量。
丁二酮含量的测定:取待测酸乳样品,用16%三氯乙酸溶液等体积与其混合,混匀后静置10 min,3 500×g离心10 min。取上清液20 mL,等体积加入2 个试管中,向1号试管中加入1%的邻苯二胺溶液0.5 mL,2 号试管不加,充分混匀后于黑暗处使其反应30 min,然后向2 个试管中加入4.0 mol/L的盐酸终止反应(1号试管加2.0 mL,2号试管加2.5 mL),混匀后以2号试管作为对照液,在335 nm波长测定吸光度。如果样品中丁二酮含量较高,测得的吸光度超过0.2~1.0范围,可用8%三氯乙酸对样品进行适当的稀释处理。
2)乙醛含量测定
试剂配制:称取12.70 g碘于500 mL烧杯中,加入40 g碘化钾,加适量的水溶解,移至1 000 mL棕色容量瓶,定容摇匀,配制成0.1 mol/L碘标准溶液。然后准确量取10.00 mL的0.1 mol/L碘标准溶液于100 mL棕色容量瓶中,用蒸馏水定容,摇匀,两种溶液现用现配。
样品测定:取1% NaHSO3溶液5 mL置于250 mL锥形瓶中,加入处理后试样上清液25 mL,混匀后在室温下放置1 h,然后加入1%淀粉溶液1 mL,用0.1 mol/L碘液滴定至接近淡蓝紫色,再用0.01 mol/L碘液滴定至淡蓝紫色,并且在30 s内淡蓝紫色不褪去,以上滴定均不计数。然后加入20 mL 1 mol/L的NaHCO3溶液,充分振荡混匀,使溶液蓝紫色消失,最后用0.01 mol/L碘液滴定至蓝紫色终点,记录消耗标准碘液的体积,每个样品有2 个平行,并同时做空白实验。
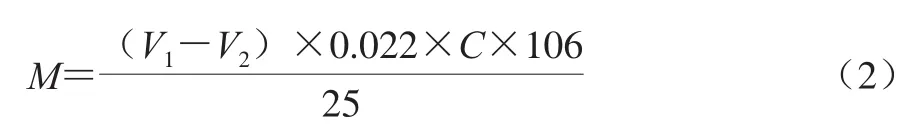
式中:M为乙醛质量浓度/(mg/L);V1为滴定样品消耗碘标准溶液体积/mL;V2为滴定空白消耗碘标准溶液体积/mL;C为碘标准溶液的浓度/(mol/L);25为样品称样量/mL;0.022为乙醛反应化学基本单位/g。
1.3.2 乳酸菌益生特性分析
1.3.2.1 抑菌特性
用培养18 h的病原指示菌(浓度为107CFU/mL)100 μL,牛津杯法测定菌株抑菌能力。取37 ℃培养36 h的菌株菌悬液,10 000×g离心10 min后用1 mol/L NaOH溶液将pH值调至6.0,并用过氧化氢酶和胰蛋白酶处理上清液,然后用22 μm滤膜过滤,灭菌后取200 μL加入牛津杯中,将平板置于4 ℃静置5 h,直至上清液扩散到琼脂中。37 ℃培养24 h后,使用游标卡尺测定抑菌圈直径[19]。
1.3.2.2 菌株黏附性
参考赵圣明等[20]的方法测定菌株的疏水性和自凝集性。
疏水性:将菌株发酵液4 000×g离心20 min,用生理盐水洗涤2 次后重悬于0.1 mol/L KNO3(pH 6.2)溶液中,调节菌悬液浓度为107CFU/mL,600 nm波长处测定样品吸光度(A0);分别吸取1 mL二甲苯、乙酸乙酯、氯仿溶剂加到3 mL菌液中混匀,室温放置10 min后涡旋振荡2 min,室温静置20 min后取水相,测定其在600 nm波长处的吸光度(A1)。细菌疏水率用式(3)计算:
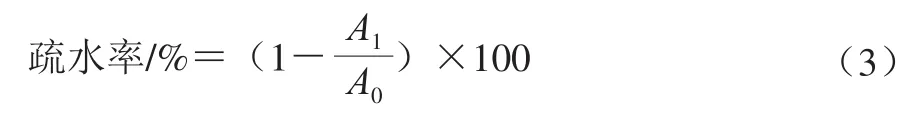
自凝集能力:将菌株发酵液4 000×g离心20 min,用磷酸盐缓冲液洗涤2 次后调节菌悬液浓度为107CFU/mL。取5 mL菌悬液于10 mL试管中漩涡振荡10 s,在室温条件下静置5 h,每隔1 h取出菌悬液置于600 nm波长处测其吸光度。每组3 个平行实验。菌株自凝集率用式(4)计算:
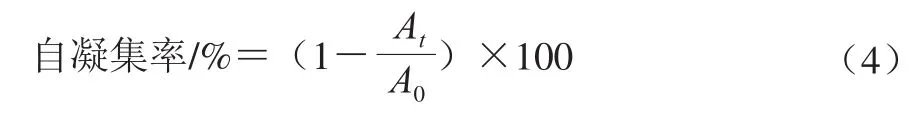
式中:At为菌悬液在1、2、3、4 h和5 h不同时间的吸光度;A0为第0小时的吸光度。
1.3.2.3 耐受胃肠液能力
胃蛋白酶溶解于无菌磷酸盐缓冲溶液(0.2 mol/L,pH 3.0)中制备成终质量浓度为3 g/L的模拟胃液[21]。胰蛋白酶溶解于含有0.3%牛胆盐的无菌磷酸盐缓冲溶液中(0.2 mol/L,pH 8.0)中制成胰蛋白酶终质量浓度为1 g/L的模拟肠液[22]。
将菌株培养至对数期后,4 ℃、4 000×g离心10 min收集菌体,用无菌生理盐水洗涤3 次后重悬于模拟胃液中,调节菌悬液浓度为109CFU/mL。将菌株置于37 ℃条件下培养,分别于0、1、2、3 h后取出进行平板计数。将1 mL胃液处理3 h后的菌株离心后重悬至模拟肠液中,置于37 ℃条件下培养,分别于2、4、6 h后取出进行平板计数[23]。
1.3.2.4 菌株耐药性
采用纸片扩散法(K-B法)对菌株进行20 种抗生素药敏实验。取100 μL浓度为107~108CFU/mL的菌悬液,使用灭菌棉签将其均匀涂布于MRS平板,待其表面干燥后将药片贴上,37 ℃培养24 h,观察抑菌结果,检测抑菌圈直径,每种抗生素药片做3 个平行,实验结果参照CLSI 2012抗微生物药物敏感性实验执行标准。
1.3.3 复合发酵菌种复配
依照益生实验结果,将7 株乳酸菌按酸化能力、产香性能、改善质构性能、益生性能进行分组,每4 株菌组合进行复配发酵,并通过分析对比,选出最优的菌株组合方式。
1.4 数据统计与处理
实验数据处理采用SPSS 19.0软件进行分析,所有实验重复3 次,结果以±s表示,显著性分析使用Duncan检验(P<0.05,差异显著);使用Origin 9.1软件绘图。
2 结果与分析
2.1 菌株发酵特性分析
2.1.1 酸化能力
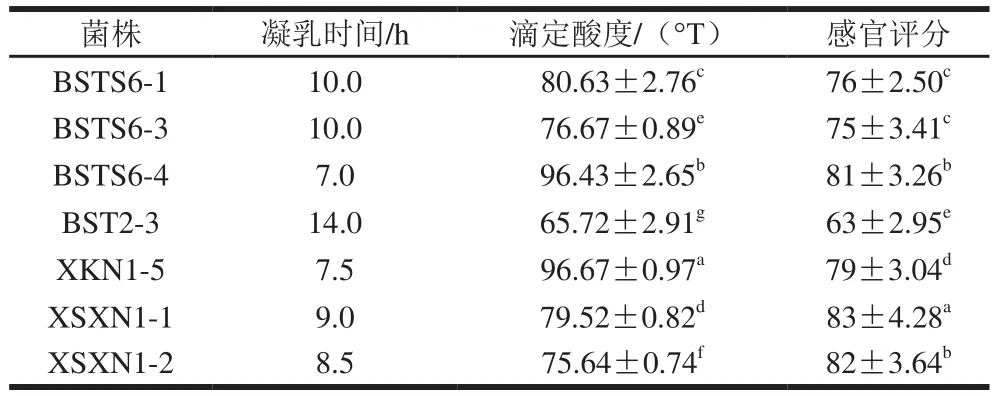
表2 乳酸菌发酵性能初筛Table 2 Fermentation performance of LAB strains
酸化能力较强的菌株会导致酸乳过度酸化失去食用价值,酸化能力较弱会影响酸乳中风味物质的产生,也易使酸乳感染杂菌。研究表明,消费者能够接受酸乳酸度为70~110 °T[24]。由表2可以看出,大部分株菌的酸度在70~90 °T,产酸能力适中,满足生产需求。在酸乳生产过程中,如果凝乳时间太短,不利于酸乳香味的生成,也会对酸乳的组织状态产生影响;凝乳时间过长,虽然对状态和香味有一定作用,但不利于节约生产能源和时间,也易造成发酵过程中的杂菌污染[25]。由表2可以看出,菌株的凝乳时间均不大于14 h,其中菌株BSTS6-4和菌株XKN1-5凝乳时间较快,8 h左右即可凝乳,凝乳时间较其他菌株短。
2.1.2 感官评价
由7 株乳酸菌发酵制成的酸乳的感官评分见表2。7 株菌发酵所得酸乳色泽较为良好,均呈现乳白色或微黄色;除菌株BST2-3因产酸不足导致的酸乳风味不佳外,其余菌株均具有酸乳特有的风味且无苦涩味;菌株BSTS6-1、BSTS6-3、BSTS6-4、XSXN1-1、XSXN1-2发酵制得的酸乳质地细腻、表面光滑和无裂缝,菌株BST2-3发酵制得的酸乳有轻微的分层现象,可能与其酸化能力弱,凝乳不充分的原因有关,XKN1-5发酵制得的酸乳有轻微的乳清析出。
2.1.3 单菌株发酵乳质构特性分析
通过比较各个酸乳样品的硬度、黏附性、弹性、内聚性、胶黏性、保水率以及表观黏度评估发酵乳的质构特性,量化比较各项物性指标的差异性。由表3可以看出,各菌株酸乳在质构特性上存在差异(P<0.05),其中硬度、黏附性、保水率、表观黏度受发酵菌株的影响较大。菌株BSTS6-3、XSXN1-2发酵制得的酸乳大部分物性指标较其他几株菌好,其中菌株BSTS6-3的表观黏度达到了3.50 Pa·s,保水率达55.23%;菌株XSXN1-2的表观黏度达到了3.80 Pa·s,保水率达58.51%。刘娜等[26]对酸羊奶、酸牛奶分离出的保加利亚乳杆菌MAU40167进行研究,结果显示其保水率达58.24%,黏度为0.96 Pa·s。Wang Jicheng等[27]研究表明L.caseiZhang发酵所得酸乳的保水率为60%,表观黏度为3.96 Pa·s。说明菌株具有商业应用潜力。
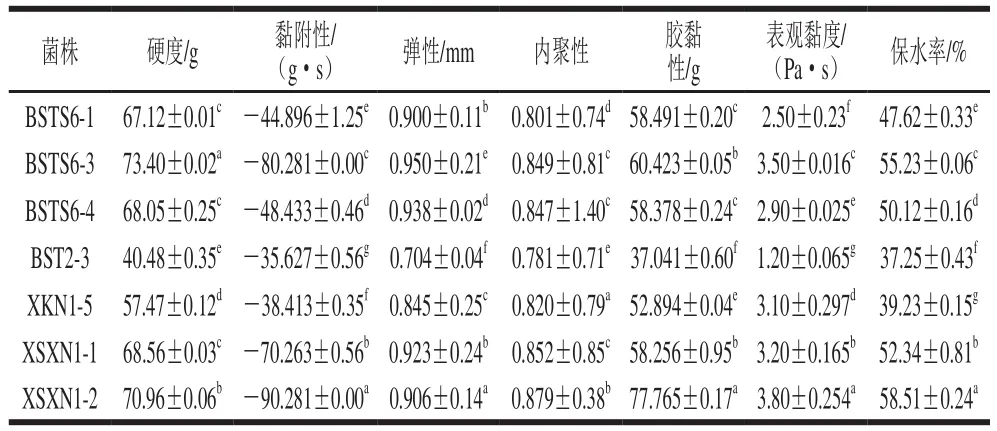
表3 单菌株发酵乳质构特性Table 3Texture characteristics of milk fermented by single-strain cultures
2.1.4 菌株产香特性分析
乙醛和双乙酰是构成酸乳典型风味的重要化合物,其含量以及两者之间比例会对酸乳风味产生较大的影响[28],由图1可以看出,大部分菌株乙醛质量浓度大于10 mg/L,乙醛是酸乳主要的风味物质,其含量对酸乳风味的影响较大,要使酸奶达到良好的风味,乙醛质量浓度应该在10~15 μg/mL之间[29];有研究表明乙醛与双乙酰含量比值大于3∶1时,酸乳的风味最佳[30]。由图1可知,各组发酵乳乙醛和双乙酰含量之比均大于3∶1,尤其菌株BSTS6-1、XSXN1-1双乙酰及乙醛产量均较其他菌株高,产香能力突出,其中菌株XSXN1-1的乙醛质量浓度可达16 mg/L,双乙酰质量浓度达到2.02 mg/L。
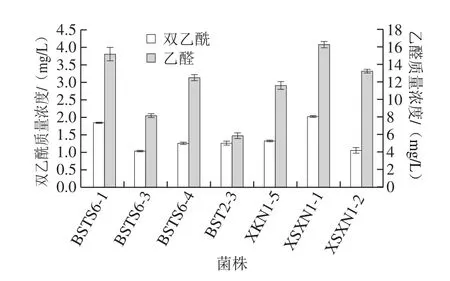
图1 单菌株产香性能Fig.1 Aroma-producing ability of single-strain cultures
2.2 菌株益生特性分析
2.2.1 菌株抑制肠道病原菌特性
由表4可以看出,7 株乳酸菌都对大肠埃希氏菌均具有较好的抑制性,其中杆菌抑菌效果明显优于球菌。有研究表明,引起细菌性腹泻的致病菌主要为大肠埃希氏菌,郭利敏等[31]收集分析了463 名腹泻患者的粪便样品,得出引起腹泻的主要原因为致泻大肠埃希氏菌感染;李迎慧等[32]对深圳市腹泻人群进行调查研究发现导致该地区人群腹泻的主要致病菌为致泻大肠埃希氏菌、产肠毒素大肠埃希氏菌。本研究菌株BSTS6-4、BSTS6-3、BSTS6-1、BST2-3的发酵上清液对7 种常见肠道致病菌均有不同程度的抑制作用,抑菌谱较广,可能是菌株在生长代谢过程中产生的有机酸、过氧化氢及细菌素等抑菌物质,能有效地抑制这些肠道致病菌的生长,从而使得这些乳酸菌在开发治疗腹泻的药物中具有应用的潜力[33]。
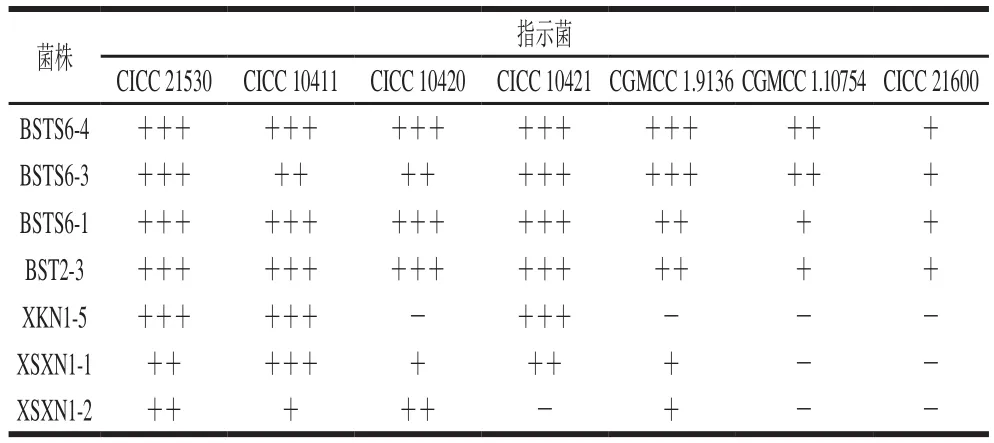
表4 不同菌株抑菌特性Table 4 Antibacterial properties of seven different strains
2.2.2 模拟胃肠液耐受性
益生菌需经过胃肠道转运才能到达肠道发挥益生作用,因此,益生菌菌株必须克服苛刻的消化道环境,例如胃酸以及肠道中的胆汁和消化酶[34]。本实验通过体外模拟胃肠道环境对7 株乳酸菌的胃肠液耐受性进行分析,结果见表5。可以看出7 株乳酸菌均可以耐受模拟胃液,只是在耐受程度上有差异(P<0.05),其中菌株BSTS6-1、XKN1-5、BST2-3、XSXN1-1在3 h的模拟胃液处理后的存活率高达89%以上;模拟肠液实验中,7 株乳酸菌对胃液也表现出不同程度的耐受性(P<0.05),其中菌株BSTS6-1、BSTS6-3、BSTS6-4耐受肠液能力较差,在模拟肠液中连续处理6 h后存活率均较低。菌株BST2-3耐受肠液能力最佳,6 h模拟肠液处理后存活率仍达77.1%,活菌数高于106CFU/mL,符合乳酸菌应用于工业生产中的最低要求。
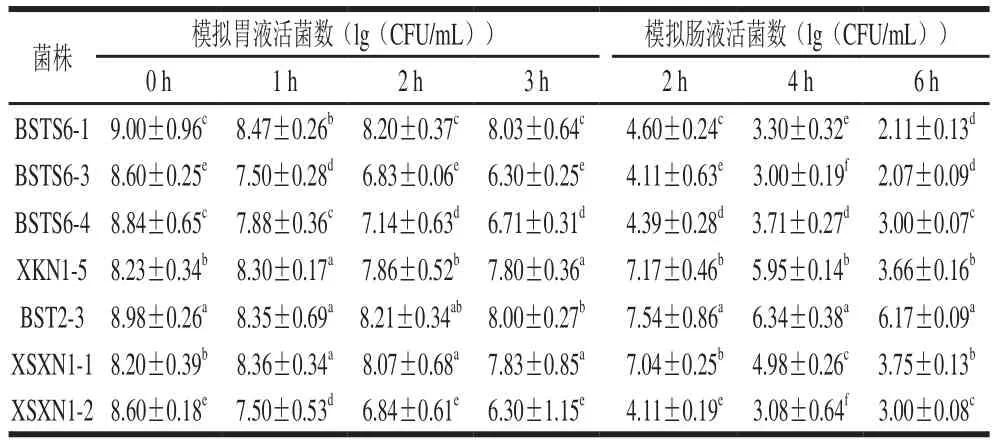
表5 不同菌株在转运过程中的耐受性Table 5 Gastrointestinal transit tolerance of seven different strains
2.2.3 黏附性
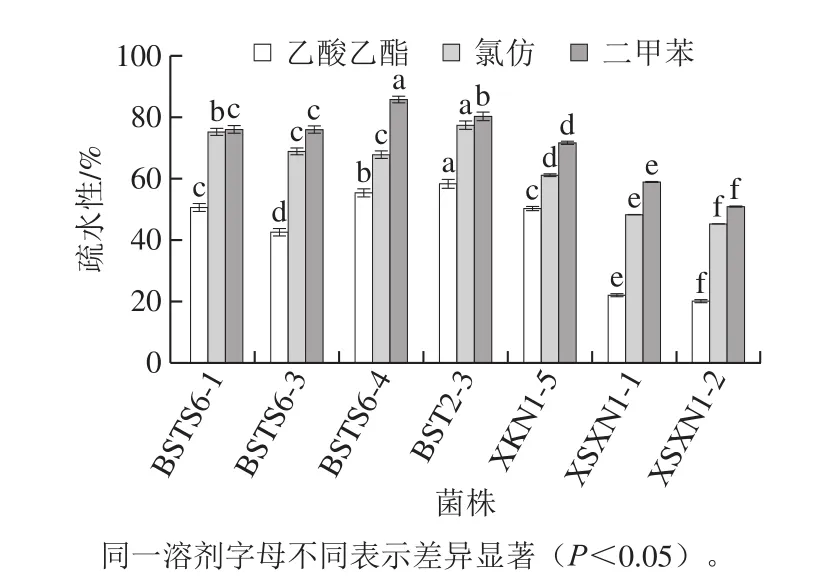
图2 不同菌株疏水性Fig.2 Hydrophobicity of different strains
细菌表面疏水性和自聚集能力作为乳酸菌的表面特性,被用于间接评估益生菌的黏附能力[35]。菌体表面疏水性是影响乳酸菌黏附性典型的内在因素,近年来普遍地作为评价乳酸菌黏附性能的重要参数[36]。由图2可以看出,所有菌株均表现出一定的疏水性,不同菌株的疏水性存在差异(P<0.05)。乙酸乙酯是单碱性溶剂,属于电子供体,氯仿是酸性溶剂,属于电子受体,供试的7 株乳酸菌对氯仿的疏水性都明显的高于对乙酸乙酯的疏水性,说明这几株菌都是电子供体;二甲苯为非极性溶剂,7 株乳酸菌均表现出对二甲苯的黏附性(>50%),表明这些菌株的细胞表面都具有疏水性。
菌株的自凝集是指同一种菌株间相互凝集形成多细胞簇的现象,有研究证明细胞表面疏水性和自聚集的体外实验可用于初步筛选适合商业应用的潜在黏附细菌[37]。由表6可以看出,在5 h的静置过程中,7 株乳酸菌的自凝集率随着时间延长而增大,其中菌株BSTS6-4、BSTS6-1、BST2-3的自凝集能力较强,自凝集率可达50%以上,具有较好的自凝集能力,进一步证明这些菌株可以黏附于胃肠道,发挥其益生特性,有作为益生菌应用于食品工业的潜力。
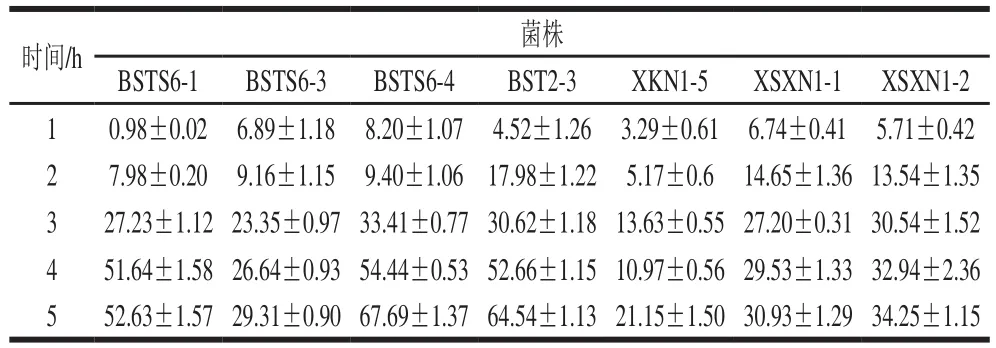
表6 不同菌株自凝集率Table 6Self-aggregation characteristics of seven different strains%
2.2.4 菌株耐药性分析
肠道微生物可以通过自发突变或通过肠道或结肠内的其他物种的水平转移获得抗性基因,产生抗生素抗性[38]。尽管乳酸菌被认为是安全的菌株,但是对于所选定的菌株还是要通过评估其传播和接受抗生素基因的能力评估其安全性。
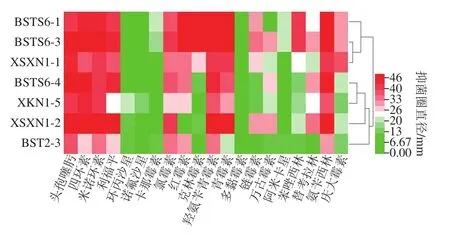
图3 基于抑菌圈直径对7 株乳酸菌的抗生素抗性热图分析Fig.3 Heatmap of antibiotic resistance of 7 strains of LAB based on diameter of inhibition zone
热图可以通过颜色梯度表示7 株乳酸菌抗生素抑菌圈的大小,进而直观显示出7 株乳酸菌的抗生素耐药性,颜色有红色渐变为粉红色、白色、绿色,代表抑菌圈直径的不断缩小。由图3可以看出,绿色区域主要集中在环丙沙星、诺氟沙星、卡那霉素、多黏霉素、阿米卡星这5 种抗生素中,表示大多数菌株对这5 种抗生素表现出耐药性,有研究报道乳酸菌对大多数核酸抑制剂耐药,其耐药机制主要受乳酸菌存在的药物外排系统、甲基转移酶以及产生的药物灭活酶所介导[39]。本研究中卡那霉素、多黏霉素、阿米卡星均属于氨基糖苷类抗生素,表明本实验研究结果与之前报道较一致。图中大部分区域的颜色位于红色和绿色的渐变区域,表明7 株乳酸菌对大部分抗生素敏感。从热图纵向分析,大部分菌株对于头孢噻肟、四环素、米诺环素、利福平、氯霉素、红霉素、羟氨苄青霉素、青霉素、氨苄西林、克林霉素、链霉素、万古霉素、苯唑西林、庆大霉素表现出敏感;从横向分析,菌株BST2-3所对应区域颜色介于红色与绿色之间的渐变区域,表明对20 种实验用抗生素药片均表现出敏感,即菌株安全性较高,这可能与样品的采集地有关,新疆伊犁自治州是我国主要的畜牧业基地之一,该地区的少数民族经常手工制作各种发酵乳制品,极少使用抗生素,因此有很多天然益生菌资源值得开发。
2.3 最优组合菌株筛选
2.3.1 菌株组合方式
单菌株的发酵和益生实验研究中,酸化能力较优的菌株为XKN1-5和BSTS6-4,能显著改善酸乳质构的菌株为BSTS6-3和XSXN1-2,产香能力较为突出的菌株为BSTS6-1和XSXN1-1,益生特性较为突出的菌株为BST2-3,依照酸化、产香、质构以及益生实验结果将7 株乳酸菌分为4 组进行组合复配,共得到8 种组合,如表7所示。按照1∶1∶1∶1的菌种接种比例进行发酵,选择其中最优的复合发酵菌株的组合方案。
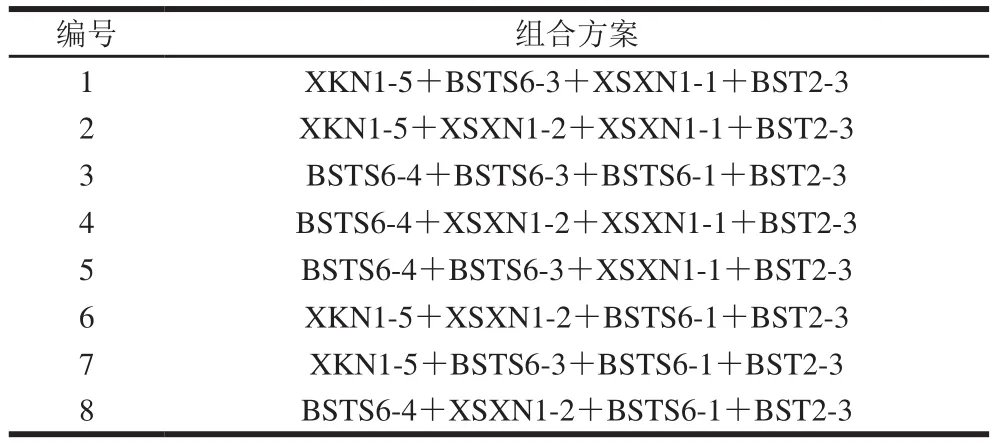
表7 复合发酵菌株组合方案Table 7Combinations of seven strains for mixed-culture fermentation
2.3.2 菌株组合方式对酸奶品质的影响
不同菌株组合方式对酸乳总酸度、风味物质、凝乳时间以及感官评价等的影响见表8。8 组样品的酸度均控制在70~110 °T,符合国家规定的酸乳酸度要求;8 组样品的风味物质含量均处于较高水平,其中以5号组合最为突出,发酵乳中双乙酰质量浓度达7.96 mg/L,乙醛质量浓度达28.68 mg/L;8 组样品的凝乳时间均控制在5.5 h左右,凝乳时间较短,节省成本;8 组酸乳样品的感官评分均较单菌株发酵酸乳高,表明复合发酵在一定程度上提升了酸乳的品质,其中5号组合复合发酵制得的酸乳样品组织细腻、口感顺滑、酸甜适中且具有酸牛乳独有的风味,受到大多数评测者的喜爱,感官评分显著高于其他几组(P<0.05)。
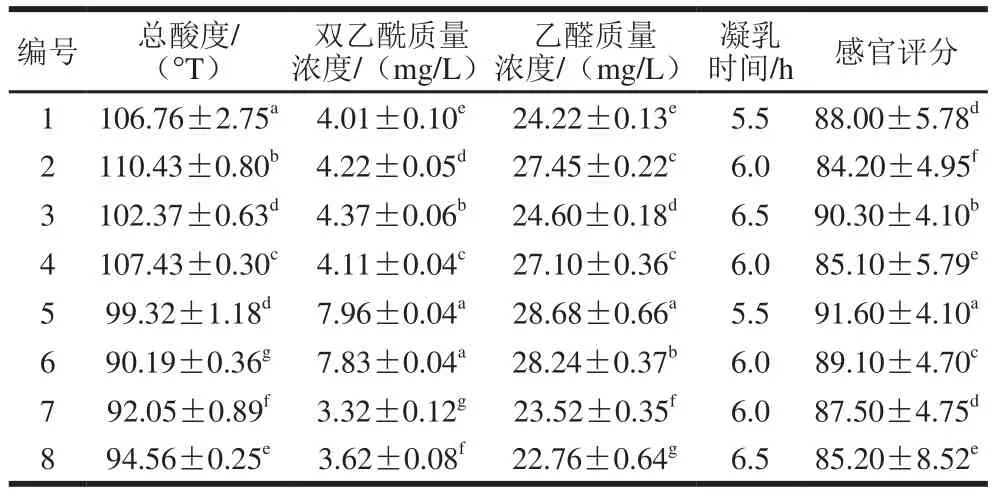
表8 菌株组合方式对酸奶发酵性能的影响Table 8 Effects of different strain combinations on acidity, sensory score and coagulation time of yoghurt
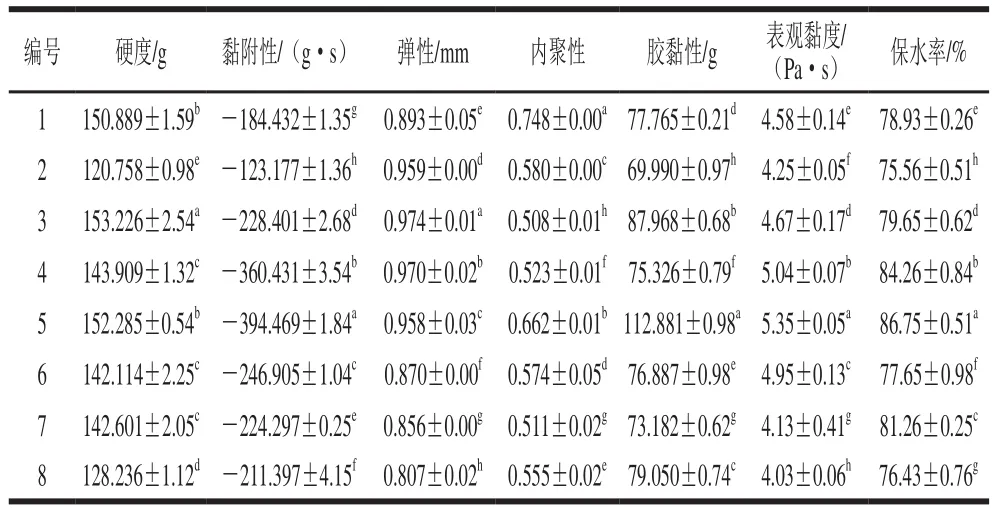
表9 菌种组合方式对发酵乳质构特性的影响Table 9 Texture characteristics of fermented milk with different strain combinations
如表9所示,复合发酵制得酸乳的各项质构指标均较单菌株发酵好,其中5号组合黏附性、胶黏性、保水率以及表观黏度均较其他几组好,表现出良好的质构特性。综上所述,5号组合方式为复合发酵菌株的最佳方案,其菌种组成为L.delbrueckiisubsp.bulgaricus(BSTS6-4和BSTS6-3)、L.lactisXSXN1-1以及L.fermentumBST2-3。使用该混合菌种组合发酵酸乳,发酵时间短,发酵制得酸乳组织状态良好,风味独特,而且还具有一定的益生特性。
3 结 论
通过发酵和益生实验对从新疆伊犁地区乳品中分离的7 株优良乳酸菌进行分析研究,以获得最优的复合发酵菌株的组合方案。单菌株发酵实验中XKN1-5和BSTS6-4酸化能力较强,BSTS6-3和XSXN1-2发酵所制得的酸奶质构特性较佳,BSTS6-1和XSXN1-1产香能力突出;益生实验结果表明菌株BST2-3在模拟胃肠液处理9 h后活菌数仍可达106CFU/mL,满足了益生菌到达胃肠道所需的最低活菌数要求;同时7 株乳酸菌对大部分所试抗生素表现敏感,安全性较好。根据发酵和益生实验结果将菌株分为4 组,每4 株菌组合进行酸乳发酵,共得到8 种组合方式。将8 组复合发酵所得酸乳的各项指标进行分析对比,结果显示,5号组合凝乳时间时间短,产香能力最为突出,保水率、表观黏度等指标均为最优,感官评分可达91.6 分,为最优的复合发酵菌株组合方案,菌株组成为L.delbrueckiisubsp.bulgaricus(BSTS6-4和BSTS6-3)、S.thermophilusXSXN1-1以及L.fermentumBST2-3,菌种接种比例为1∶1∶1∶1。

