肠膜明串珠菌ATCC8293中乳酸脱氢酶的特性
李 玲,龚金炎,袁海娜,方若思,楚秉泉,肖功年,,Namsoo HAN
(1.浙江科技学院生物与化学工程学院,浙江 杭州 310023;2.韩国忠北大学食品科学与工程专业,韩国 忠清北道 清州 28644)
乳酸菌是降解可发酵性碳水化合物产生乳酸的一类无芽孢、革兰氏阳性菌的统称。目前,乳酸菌可分为20 个属,共有200多种。乳酸菌可作为各种不同发酵食品的发酵剂,如酸奶、奶酪和蔬菜发酵食品[1-3]。其中,肠膜明串珠菌(Leuconostoc mesenteroidessubsp.mesenteroidesATCC8293)是一种G+C含量低于50%的异型发酵乳酸菌。在发酵过程中产生柠檬酸、苹果酸等有机酸和芳香族化合物,能够有效地提升发酵食品的品质,作为发酵剂应用于发酵食品产业中[4-6]。
乳酸脱氢酶(lactate dehydrogenase,LDH)是乳酸菌产生乳酸代谢途径中的关键酶,其催化丙酮酸转化成乳酸。根据催化产物不同,LDH分为D-LDH(EC:1.1.1.28)和L-LDH(EC:1.1.1.27)两种,分别产生D-乳酸和L-乳酸[7]。LDH也是乳酸菌产生苯乳酸的关键酶,LDH转化苯丙酮酸产生苯乳酸[8]。苯乳酸是一种新型的抑菌物质,能够抑制多种食源性致病菌和真菌。苯乳酸也分为D-苯乳酸和L-苯乳酸,其中D-苯乳酸比L-苯乳酸有更高的抗菌活性[9]。苯乳酸的抑菌谱宽、抑菌能力强,具有良好的溶解性和热稳定性,非常有潜力发展成一种新型的生物防腐剂用于食品、饲料等领域[10-11]。在前期研究中,从不同乳酸菌中筛选高产苯乳酸的乳酸菌,其中,肠膜明串珠菌ATCC8293生产苯乳酸的效率达到80%[12]。结果表明,肠膜明串珠菌ATCC8293参与苯乳酸代谢的LDH的活性高。肠膜明串珠菌ATCC8293中含有7 种LDH,经蛋白质组学分析,其中3 种基因LEUM_1756、LEUM_2043、LEUM_0445能够有效表达[12]。对LEUM_1756基因已测定酶学特性,证实了LEUM_1756是肠膜明串珠菌ATCC8293中的关键LDH。LEUM_2043基因的转录量和翻译量是LEUM_1756的70%和40%,表明该基因也能参与乳酸和苯乳酸的生产代谢[13]。因此,对肠膜明串珠菌ATCC8293的次要关键酶LDH(LEUM_2043)进行进一步研究,为利用肠膜明串珠菌生产乳酸和苯乳酸提供理论依据。
目前,有关乳酸菌LDH的酶学性质研究已很多,大多是将基因导入到大肠杆菌(Escherichia coli),得到重组纯化酶,研究酶学性质。已对来自植物乳杆菌、乳酸片球菌、詹氏乳杆菌的LDH进行酶学特性研究[14-17]。虽然对LDH的研究很多,但是对于肠膜明串珠菌的LDH的研究却很少,不同LDH性质也存在较大差异。本研究将采用基因工程的方法,以肠膜明串珠菌ATCC8293为研究对象,克隆ldh基因,并导入E.coli中表达,经Ni-NTA柱亲和层析进行纯化。测定纯化后酶的比活力,并且研究酶学性质,包括最适pH值和温度、对不同底物的酶活力及动力学常数。鉴于其在合成乳酸中的关键作用,可为高效生产乳酸、苯乳酸等有效成分物质提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和培养基
肠膜明串珠菌ATCC8293 美国ATCC微生物菌种保藏中心;E.coliMC 1061、E.coliBL21(DE3)、质粒pETDuetTM-1 德国Novagen公司;MRS培养基、LB培养基 美国BD Difco公司。
1.1.2 试剂
细菌基因组DNA提取试剂盒、DNA快速回收纯化试剂盒、胶回收试剂盒 韩国Bioneer公司;ExTaqDNA聚合酶、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、限制性内切酶EcoR I和PstI 日本TaKaRa公司;BCA试剂盒 美国Pierce Biotechnology公司;氨苄青霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、丙酮酸、D-/L-乳酸、还原态烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、α-酮丁酸、草酰乙酸、苯丙酮酸、2-酮戊二酸、乙酰丙酸 美国Sigma公司。
1.2 仪器与设备
Ni-NTA柱 瑞典GE Healthcare公司;高效液相色谱(high performance liquid chromatography,HPLC)仪韩国Younglin公司。
1.3 方法
1.3.1 重组质粒pETldh的构建
以肠膜明串珠菌ATCC8293基因组为模板,用LEUM_2043-N(5’-TTGAATTCAATGAAAATTTTAATG TACAAT-3’)和LEUM_2043-C(5’-TTCTGCAGCCGC AAAATTTCGTTTTC-3’)作为引物进行PCR扩增。PCR产物经DNA回收试剂盒回收,同时在1%琼脂糖凝胶上电泳鉴定其分子质量大小。纯化的ldh基因产物插入到pETDuetTM-1质粒(5 420 bp)的EcoR I和PstI酶切位点上,得到表达质粒pETldh(6 394 bp)。将得到的质粒转化至E.coliMC 1061感受态细胞中,在氨苄青霉素质量浓度为100 μg/mL的LB培养基中选菌落经酶切鉴定后挑取阳性重组子进行测序。
1.3.2 组菌pETldh的蛋白表达及纯化
为过表达重组质粒pETldh,将其转化到至E.coliBL21(DE3)感受态细胞中进行表达。将E.coliBL21(DE3)/pETldh接种于含100 μg/mL氨苄青霉素的LB液体培养基中,250 r/min、37 ℃培养至OD600nm达到0.5,加入1 mmol/L IPTG诱导表达。收集菌体发酵液12 000 r/min、4 ℃离心5 min,弃上清液。菌体以裂解液(10 mmol/L咪唑、500 mmol/L NaCl、20 mmol/LNa2HPO4-NaH2PO4缓冲液,pH 7.4)洗涤,再超声裂解10 min。将裂解液12 000 r/min、4 ℃离心5 min,上清液作为粗酶液。依据重组蛋白的His标签,粗蛋白用Ni-NTA柱进行亲和层析纯化。用洗脱液(500 mmol/L咪唑、500 mmol/L NaCl、20 mmol/L Na2HPO4-NaH2PO4缓冲液,pH 7.4)洗脱,4 ℃保存使用。蛋白样品经变性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析表达与纯化水平。
1.3.3 LDH活力测定
丙酮酸还原反应的总反应体系3 mL:0.5 mmol/L NADH、10 mmol/L丙酮酸、0.01 mL酶液、0.1 mol/L Tris-HCl缓冲液(pH 8.0)。由于反应过程中需要辅酶NADH的参与,根据NADH在340 nm波长处吸光度的减少速率定义酶活力。1 min减少1 μmol NADH所需酶量为1 个酶活力单位;1 mg酶蛋白所含的酶活力单位数(U/mg)为比活力。使用BCA试剂盒测定蛋白含量。
采用HPLC分析该酶的反应产物。色谱条件:色谱柱Shodex ORpac CRX853(8.0 mm×50 mm,6 μm);检测器:紫外检测器;流动相:1.00 mmol/L CuSO4溶液;流速:1 mL/min;柱温:30 ℃;波长:250 nm;进样量:10 μL。
1.3.4 温度和pH值对LDH的影响
分别在不同pH值缓冲液测定酶活力,最适pH值定义为最高酶活力(以相对酶活力100%计)所对应的pH值。缓冲液配制如下:pH 6.0~7.0为100 mmol/L磷酸缓冲液,pH 8.0~10.0为100 mmol/L Tris-HCl缓冲液,pH 11.0~13.0为100 mmol/L甘氨酸-氢氧化钠缓冲液。分析温度对LDH的影响,将反应液分别在10、20、30、40、50 ℃进行反应,最适温度定义为最高酶活力(以相对酶活力100%计)所对应的温度。
1.3.5 LDH对不同底物的酶活力及动力学常数测定
由于LDH具有较宽的底物谱系,因此,选取与丙酮酸结构相似的5 种底物(乙酰丙酸、苯丙酮酸、α-酮丁酸、草酰乙酸、2-酮戊二酸)测定LDH对不同底物的酶活力,以丙酮酸用作底物时为最高酶活力(以相对酶活力100%计)。测定LDH分别对丙酮酸及辅酶NADH的动力学常数,反应在最适温度和pH值条件下,丙酮酸浓度为1、2、4、5、10 mmol/L(NADH浓度0.5 mmol/L),NADH浓度为0.1、0.2、0.3、0.4、0.5 mmol/L(丙酮酸浓度10 mmol/L),计算Km、Vmax、Kcat。
1.4 数据处理
每个实验重复3 次,每次3 个平行,采用SigmaPlot 10.0进行数据处理分析及图表绘制。
2 结果与分析
2.1 重组质粒的构建与鉴定
利用设计的引物对LDH进行PCR扩增,获得996 bp的PCR产物。纯化的ldh基因产物插入到pETDuetTM-1质粒(5 420 bp)的酶切位点上,获得重组质粒pETldh(6 394 bp)。对其进行双酶切之后,在1%琼脂糖凝胶上电泳鉴定得到相应的目的基因的片段被切出。同时基因测序结果与目的基因一致,表明ldh基因成功克隆到pETDuetTM-1质粒获得重组载体pETldh。
2.2 ldh基因诱导表达分析
将已构建的重组质粒pETldh转入到E.coliBL21(DE3)感受态细胞中。E.coliBL21(DE3)/pETldh在LB培养基中培养,经过IPTG诱导表达,对菌体蛋白经预处理后进行SDS-PAGE分析。未加入IPTG的E.coliBL21(DE3)/pETldh菌体作为对照组。结果显示,与对照组相比,重组菌株经过诱导表达后在分子质量约37 kDa处有一条明显蛋白带出现,说明构建的重组质粒pETldh成功实现ldh基因的表达(图1)。通过Ni-NTA亲和层析柱纯化后的蛋白条带单一,与预测分子质量相似。
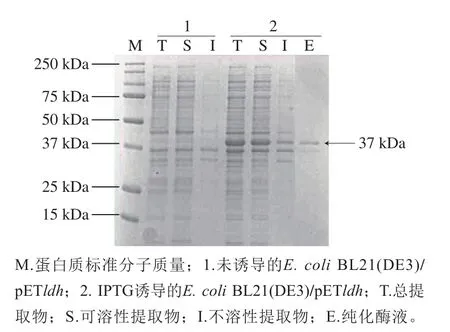
图1 重组D-LDH的SDS-PAGE分析Fig.1 SDS-PAGE analysis of purification of expressed LDH
2.3 LDH活力及反应产物分析
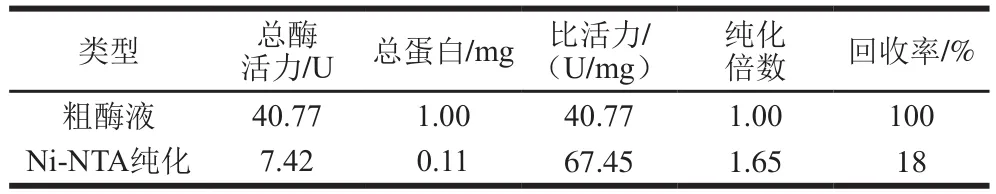
表1 LDH在纯化前后的酶活力Table 1 Summary of LDH purification
如表1所示,LDH粗酶液对丙酮酸的比活力为40.77 U/mg,经过纯化之后比活力达到67.45 U/mg。其酶活力远低于来自同一种肠膜明串珠菌内其他LDH(LEUM_1756)的比活力(4 450 U/mg)[12],但是相对于来自其他肠膜明串珠菌亚种或其他乳酸菌属的LDH,其酶活力较高,如来自肠膜明串珠菌NCDO(0.6、0.9 U/mg,2 种基因LDH,下同)、鼠李糖乳杆菌(0.02、0.21 U/mg)的LDH[18-19]。近年来,有研究利用带有高活性LDH的微生物有效合成乳酸,作为聚乳酸、苯乳酸等物质的前提物质[20-21]。
利用纯化后的LDH催化丙酮酸与NADH反应后,用HPLC检测LDH能否转化丙酮酸生成乳酸,并且确定产生乳酸是D-型或L-型。由图2a可以看出,D-乳酸和L-乳酸分别在第10分钟和第8分钟的保留时间检测到。由图2c可以看出,在第10分钟左右明显出现D-乳酸的峰,说明LDH可还原丙酮酸生成D-乳酸的D-LDH。研究表明,肠膜明串珠菌作为主要发酵剂的蔬菜发酵中主要产生D-乳酸,是一种生产D-型乳酸或苯乳酸代表性乳酸菌[22-23]。因此,可推测肠膜明串珠菌中含有的LDH中,主要表达的基因均为D-型ldh。已证实酶特性的蛋白质表达量高的2 个ldh基因LEUM_1756和LEUM_2043均表达为D-LDH。
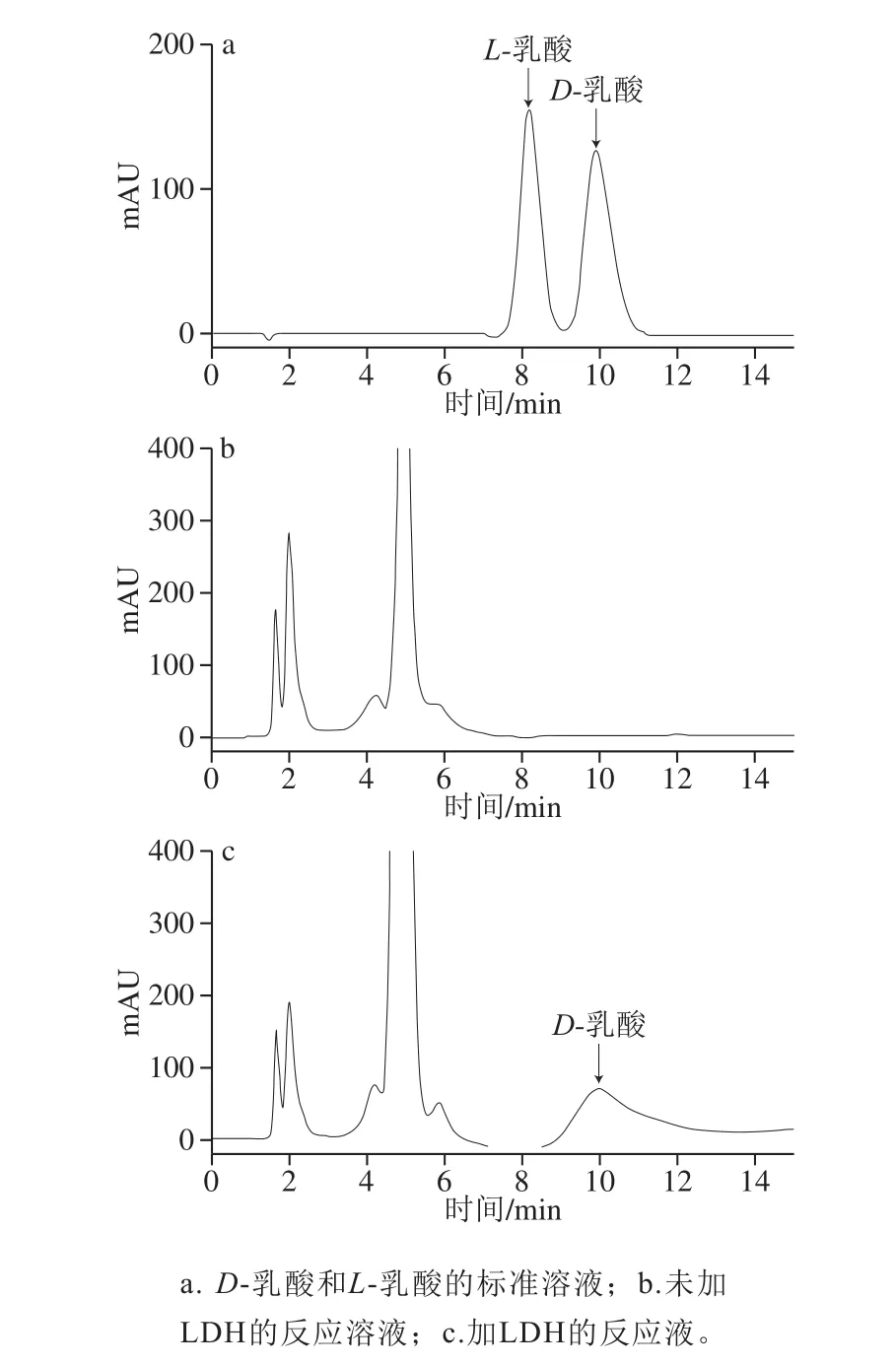
图2 LDH还原丙酮酸生成乳酸的HPLCFig.2 HPLC analysis of lactic acid produced from pyruvate with LDH
2.4 LDH的最适pH值和温度
如图3a所示,LDH活力在pH 7.0~9.0之间相对稳定;在pH值小于6.0或大于10.0时酶活力显著降低;在pH 7.0时具有最大酶活力。其在pH 7.0时具有相对高活性,这与His-标签纯化系统的最适pH值相同,能够减少纯化过程中的复杂操作。大部分来自乳酸菌的LDH都在pH 6.6~8.0之间相对稳定,这与乳酸菌最适生长pH值有关[24]。如图3b所示,LDH在30~50 ℃相对稳定;在40 ℃时具有相对高活性;温度大于50 ℃时显著降低;60 ℃之后,相对酶活力降到60%以下。来自同种肠膜明串珠菌内其他LDH(LEUM_1756)和其他乳酸菌的D-LDH相比,其酶对温度稳定性范围相对较宽[25-26]。
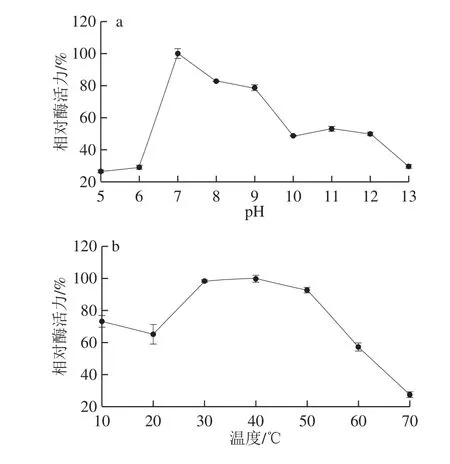
图3 pH值(a)和温度(b)对LDH活力的影响Fig.3 Effects of pH (a) and temperature (b) on LDH activity
2.5 不同底物酶活力及动力学参数
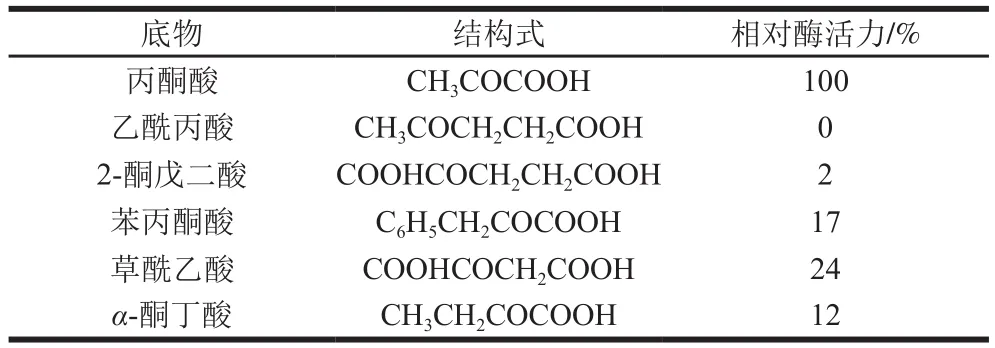
表2 LDH对不同底物的相对酶活力Table 2 Relative activity of LDH with different substrates
表2结果显示,LDH对多种底物的催化能力不同,大小顺序为草酰乙酸>苯丙酮酸>α-酮丁酸>2-酮戊二酸。肠膜明串珠菌LDH对不同底物的相对酶活力与发酵乳杆菌LDH很相似[27]。其中,对草酰乙酸(16.19 U/mg)和苯丙酮酸(11.47 U/mg)的催化能力较强,对其他底物的催化能力很低,如对α-酮丁酸和2-酮戊二酸的活力为8.09 U/mg和1.35 U/mg。来自肠膜明串珠菌的LDH对苯丙酮酸的活力高于来自詹氏乳杆菌的LDH(7、9 U/mg),证实了肠膜明串珠菌ATCC8293苯乳酸生产率优于其他乳酸菌菌种[17]。但是,其对α-酮丁酸的活力低于来自詹氏乳杆菌的LDH(41、68 U/mg)[17]。利用LDH对其他底物的特性,已成功实现苯乳酸、羟基丁酸等有效成分的高效生物合成[28-29]。
以丙酮酸和NADH为底物,在该酶最适反应条件下测定酶动力学参数。LDH对丙酮酸和NADH的Km分别为1.27 mmol/L和0.48 mmol/L,对于丙酮酸的Kcat和Kcat/Km分别为421 s-1和3.31×105L/(mol·s)。虽然本研究测定的D-LDH的Kcat/Km值比来自同种肠膜明串珠菌的另一种D-LDH(LEUM_1756)值低,但是比来自其他乳酸菌如詹氏乳杆菌、乳酸片球菌的LDH的值高出3 倍和2 倍多[25,30]。结果表明,来自肠膜明串珠菌的D-LDH对丙酮酸的亲和力和催化效率高,有利于利用肠膜明串珠菌生产D-乳酸及D-苯乳酸具有潜力。
3 结 论
本研究以肠膜明串珠菌ATCC8293基因组为模板,成功构建了携带乳酸和苯乳酸合成途径关键酶ldh基因的重组表达载体pETldh,实现其在E.coliBL21(DE3)中的高效异源表达。与其他乳酸菌LDH的酶学性质比较,肠膜明串珠菌LDH具有高的比活力,是转化丙酮酸为D-乳酸的D-LDH,并且对丙酮酸底物的亲和力和催化效率远大于其他乳酸菌LDH。此外,其对pH值和温度稳定性范围相对较宽。本研究进一步提供了利用肠膜明串珠菌高效生产乳酸和苯乳酸的理论依据。

