1 株分离自宋河镇浓香型白酒酒醅的产香细菌鉴定及风味物质分析
刘冰冰,周开心,叶丽靖,余盈盈,李学思,闫培勋,郭书贤,
(1.南阳理工学院 河南省工业微生物资源与发酵技术重点实验室,河南 南阳 473004;2.河南省宋河酒业股份有限公司,河南 鹿邑 477265)
浓香型白酒的发酵是酒曲、窖泥及酒醅之间微生物以酒醅为载体发生复杂生化反应的过程,这一期间不同微生物之间相互作用,菌群结构发生有序变化[1]。浓香型白酒的香味物质主要来自酒醅中微生物发酵,其中丁酸乙酯、乳酸乙酯、己酸乙酯、乙酸乙酯是浓香型白酒中微生物发酵产生的主要香味物质,另外还包括其他醇酸类等[2]。
一般把能够产生香味或能够产生产香物质前体的微生物统称为产香菌。产香菌包括香气及其前体物产生菌[3-6](如己酸菌、醋酸菌、乳酸菌、丙酸菌、丁酸菌、芽孢杆菌、硫酸盐还原菌、硝酸盐还原菌、链霉菌等)及酯化酶产生菌(如酿酒酵母菌、汉逊酵母菌、假丝酵母属、酒香酵母属、球似酵母菌属等[7-8];曲霉、根霉等[9])。对产香微生物进行分离及鉴定,有助于进一步研究白酒发酵过程中微生物的功能,同时也能够进一步指导实践生产。利用产香微生物制作成己酸菌液、酯化酵母液、生香窖泥等效果显著[10-12]。决定浓香型白酒品质的主要风味物质是己酸乙酯,通过对产香微生物的研究,提出“增己降乳”的指导思路,对于提升白酒品质及竞争力具有重要的理论价值[13-14]。酒醅是白酒的主要产生体,对于宋河镇浓香型白酒,酒醅的发酵时间历经60 d。宋河镇浓香型白酒丰满醇厚的口感与酒醅中微生物有重要的关系。本研究以宋河镇浓香型白酒不同时期酒醅作为研究对象,探寻其中的产香微生物类群,研究产香微生物的生理生化特性,以期为进一步挖掘与利用宋河镇浓香型白酒酒醅产香微生物的代谢特征提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
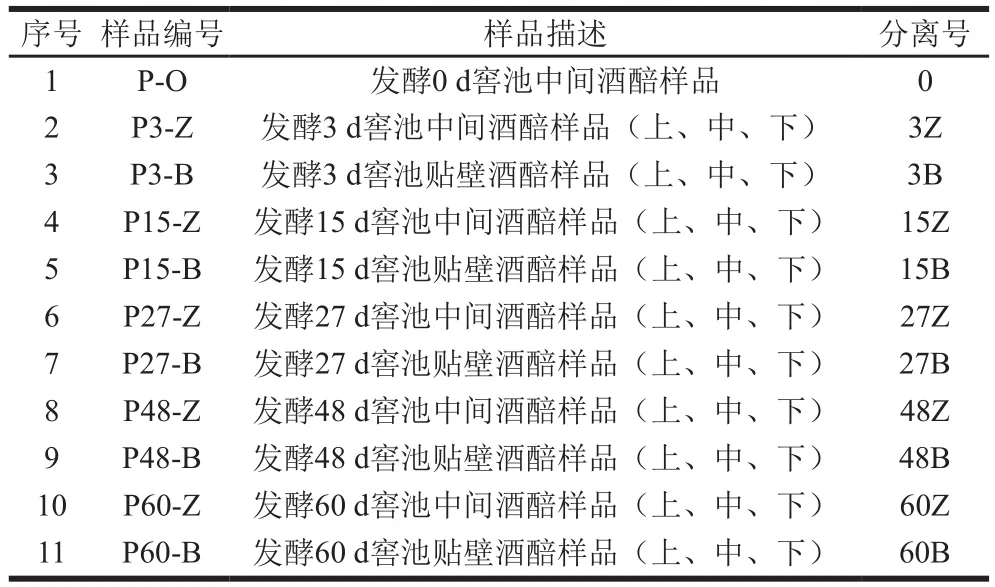
表1 酒醅样品信息Table 1 Information about samples of fermented grains tested in this study
2018年3 月于河南省鹿邑县宋河镇宋河酒业股份有限公司浓香型酒窖中取酒醅样本。按照酒醅发酵周期,取发酵0 d窖池中间酒醅样品,发酵3、15、27、48、60 d窖池中间酒醅及贴壁酒醅上、中、下3 个位置的样品;窖池中间、窖池壁的上中下位置样品分别混合,总计合并为11 个样品,装于无菌采样瓶中,4 ℃保藏。样品信息如表1所示。
1.1.2 培养基种类与组成
1.1.2.1 菌株分离培养基
高氏培养基:可溶性淀粉20 g,KNO31 g,MgSO4·7H2O 0.5 g,K2HPO40.5 g,FeSO4·7H2O 0.01 g,琼脂20 g,蒸馏水1 L,pH值自然,121 ℃灭菌20 min。待培养基冷却至60 ℃左右,添加制霉菌素(50 μg/L)以抑制真菌的生长。
1.1.2.2 菌株形态鉴定培养基
R2A培养基:酵母浸出粉0.5 g,蛋白胨0.5 g,酪蛋白水解物0.5 g,葡萄糖0.5 g,可溶性淀0.5 g,K2HPO40.3 g,MgSO4·7H2O 0.024 g,丙酮酸钠0.3 g,琼脂15.0 g,蒸馏水1 L,pH 7.0,121 ℃灭菌20 min。
CDA培养基:K2HPO41 g,KCl 0.5 g,NaNO32 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂20 g,蒸馏水1 L,pH 7.0,121 ℃灭菌20 min。
ISP4培养基:可溶淀粉性10 g,K2HPO42 g,CaCO34 g,微量盐2 mL,(NH4)2SO44 g,MgSO4·7H2O 2 g,NaCl 2 g,琼脂20 g,蒸馏水1 L,pH 7.0,121 ℃灭菌20 min。
ISP3培养基:燕麦片20 g+1 L水煮沸20 min,粗纱布过滤补水到1 L,微量盐1 mL,琼脂20 g,pH 7.0,121 ℃灭菌20 min。
ISP5培养基:L-天门冬酰胺1 g,甘油10 g,K2HPO41 g,微量盐1 mL,琼脂20 g,蒸馏水1 L,pH 7.0,121 ℃灭菌20 min。
ISP2培养基:酵母膏4 g,麦芽膏10 g,葡萄糖4 g,琼脂20 g,蒸馏水1 L,pH 7.0,121 ℃灭菌20 min。
微量盐培养基:FeSO4·7H2O 0.2 g,MnSO4·H2O 0.1 g,ZnSO4·7H2O 0.1 g,蒸馏水100 mL,pH值自然。
选用标准为菌株最适生长培养基及放线菌形态特征描述国际公认培养基。
1.1.2.3 生理生化检测及酶活性筛选培养基
温度生长范围、抗生素敏感、乙醇耐受实验的培养基选自1.1.2.2节最适生长培养基。
碳源利用基础培养基:(NH4)2SO42.64 g,KH2PO42.38 g,K2HPO45.65 g,MgSO4·7H2O 1.0 g,微量盐1 mL,蛋白胨0.125 g,胰蛋白胨0.25 g,蒸馏水1 L,pH 7.2~7.4。
酶活性检测基础培养基:K2HPO40.5 g,葡萄糖0.5 g,KCl 0.5 g,硝酸钾1 g,琼脂粉20 g,蒸馏水1 L,pH值自然。
淀粉酶、纤维素酶、蛋白酶、酯分解酶活性检测培养基分别以酶活性检测基础培养基为母液,分别添加0.5%的可溶性淀粉、羟甲基纤维素钠(0.2%)、果胶、吐温20、吐温40、吐温60、吐温80,pH 7.2。
酯化酶检测培养基[15]:聚乙烯醇乳化液100 mL,酶活性检测基础培养基1 000 mL,pH值自然。聚乙烯醇乳化液:30 mL 3%聚乙烯醇,10 mL甘油三丁酸酯,放于冰箱5~10 ℃静置1~2 h,超声波破碎仪120 W处理60 min,溶液由分层变成均匀乳白色,且不再分层。乳化液经过滤器过滤除菌,按照每100 mL培养基加入1 mL乳化液倒平板(聚乙烯醇乳化液现用现配)。
1.2 仪器与设备
LD2X-50KBS立式高温灭菌锅 上海申安医疗器械厂;FA1004电子天平 上海恒平科学仪器有限公司;SWCJ-ZG单人净化工作台 苏中净化公司;BPS-150生化培养箱 上海讯博实验仪器公司;HZQ-B数显恒温摇床苏威尔试验仪器公司;AX10相差显微镜 德国蔡司公司;Centrifuge 5430R高速冷冻离心机 德国默克公司;SB-800DT超声波清洗仪 宁波新芝生物科技有限公司;SMART-N水纯化系统 立康生物医疗控股有限公司;HYC-390医用冷藏冰箱 海尔医疗电器有限公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 菌株纯培养分离及纯化
将酒醅样品无菌条件下自然风干,采用梯度稀释方法稀释浓度为10-3。取100 μL菌悬液涂布于分离平板上,放入37 ℃培养箱中培养3~5 d,观察菌种生长情况及形态。挑取不同形态微生物于R2A培养基上转接2 代,37 ℃培养3 d以获得形态单一的纯菌株。超净工作台中,打开培养皿盖一端,通过30 名学生的感官评判,判断菌株是否产生香味。对产香菌株进行转接扩繁,保藏甘油管。
1.3.2 菌株形态观察
接种菌株于R2A、CDA、ISP4、ISP5、ISP3、ISP2的斜面中,37 ℃培养3~4 d,观察菌株的菌体颜色、形态、产孢及产色素情况[16]。接种菌株于R2A液体培养基中,37 ℃摇床培养3~4 d,4 000 r/min离心收集菌体,用生理盐水冲洗菌体2~3 次,以洗去培养基成分,最终制成生理盐水菌悬液,于40 倍光学显微镜下观察菌株形态特征。革兰氏反应检测选用KOH方法[17]。
1.3.3 菌株16S rRNA基因克隆鉴定及系统进化分析
采用Power soil试剂盒提取产香菌株基因组,选用16S rRNA基因引物[18](27F:5’-AGTTTGATCMTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。扩增体系为:2×TaqPCR StarMix(康润生物)10 μL,引物各1 μL,模板DNA 1 μL,去离子水7 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,循环32 次;72 ℃延伸10 min。送生工生物工程(上海)股份有限公司进行16S rRNA基因克隆测序。16S rRNA基因序列通过EZBioCloud[19]进行比对,分析菌株16S rRNA基因相似性,初步确定菌株分类地位。下载相似菌株16S rRNA基因序列,选用CLUSTAL-X软件[20]进行多重序列比对,采用MEGA 5[21]构建菌株16S rRNA基因NJ系统进化树[22]。
1.3.4 生理生化指标鉴定
1.3.4.1 不同温度生长实验
将菌株接种于R2A固体培养基上,分别置于25、30、37、42、45、50 ℃恒温箱中培养2~3 d,观察其生长情况,界定菌株的温度生长范围及最适生长温度。实验设置3 个重复。
1.3.4.2 抗生素敏感实验
采用0.85%生理盐水制作菌株菌悬液,涂布于R2A固体培养基上。采用纸片法[23],选用制菌霉素(100 μg/片)、多黏菌素(300 IU/片)、庆大霉素(10 μg/片)、利福平(5 μg/片)、新生霉素(30 μg/片)、杆菌肽(0.04 U/片)、新霉素 (30 μg/片)、红霉素(15 μg/片)、氯霉素(30 μg/片)、氨苄西林(10 μg/片)、诺氟沙星(10 μg/片)、卡那霉素(30 μg/片)、万古霉素(30 μg/片)、四环霉素(30 μg/片)等抗生素纸片点植于涂布菌体的R2A固体培养基上,37 ℃培养3 d,观察菌株对抗生素的耐受特征。实验设置3 个重复,取2 个及以上一致的结果记录为阳性实验数据。
1.3.4.3 酶活性检测
采用点植法,分别接种菌株于淀粉酶、纤维素酶、蛋白酶、酯化酶活性检测平板中,37 ℃培养3~4 d,观察菌落周边透明圈有无及大小,判断产蛋白酶、酯化酶特性;采用碘液染色,观察菌株周边透明圈有无及大小判断产淀粉酶特性;采用0.2%的刚果红染色30 min,随后用2%的NaCl溶液浸泡冲洗至洗脱液为无色,观察菌株周边透明圈有无及大小,判断产纤维素酶特性。实验设置3 个重复,取2 个及以上一致的结果记录为阳性实验数据。
1.3.4.4 不同pH值条件下酶活性检测实验
1.3.4.5 API试剂条检测
分别选用API ZYM[26]、API 50CH、API 20NE试剂条(bioMérieux)对菌株的酶学特性、碳源产酸、碳源利用等生理生化特性进行检测。恒温箱37 ℃培养,按照API操作手册进行结果观察并记录。
1.3.4.6 乙醇耐受检测
在酒醅发酵过程中微生物会持续产生乙醇,一定体积分数的乙醇会对微生物生长产生不同程度的抑制作用。本实验分离到的菌株分离自酒醅中,且在酒醅发酵前期3 d及发酵中期27 d均分离得到,说明该菌株能够耐受一定量的乙醇。配制不同乙醇体积分数(0%、2%、5%、8%、10%、12%、15%、18%、20%)的R2A液体培养基于带有内塞的5 mL螺口厌氧瓶中,115 ℃灭菌20 min,加入200 μL菌悬液(OD600nm≈1.0),37 ℃、140 r/min倒置摇床培养4~6 d,测定OD600nm值判断乙醇耐受范围。实验设置3 个重复,取3 个平均值记录为实验数据。
1.3.5 有氧及无氧条件下菌株G培养基发酵液挥发性物质检测及分析
采用顶空-气相色谱-质谱联用法[27]检测发酵液中的挥发性物质成分。取发酵液6 mL装入20 mL顶空瓶中密封好,45 ℃条件下对样品瓶振荡加热45 min,在100 ℃条件下对仪器阀和定量环进行加热,传输线温度设定110 ℃。样品进样体积1 mL,进样时间1 min。气相色谱-质谱分析仪进样口温度240 ℃,载气为氦气,流速1.2 mL/min,分流比5∶1。柱箱升温程序:初始温度50 ℃,维持2 min;以3 ℃/min速率升温至80 ℃,维持2 min;以3 ℃/min速率升温至230 ℃,维持10 min。质谱条件:使用电子电离源,设定离子源温度230 ℃,四极杆温度170 ℃,辅助加热温度250 ℃;电子能量70 eV,灯丝流量0.20 mA,检测器电压350 V。采用全扫模式收集信号,扫描范围m/z33~550。测定结果经计算机检索谱库NIST14.L进行定性分析,面积归一化法进行定量分析,通过匹配度及CAS号判断可能的物质种类。
2 结果与分析
2.1 菌株分离情况
纯化得到1 株放线菌形态的微生物,R2A固体培养基上呈黄色、不产孢、质地坚硬、有基丝、表面有少许黏液状分泌物,嗅觉感官评判具有一定香味,记录菌号为12。对比不同培养基的形态特征,分析纯培养结果可知,在酒醅发酵3、15、27 d的样点中均分离到该菌株,且靠近酒池壁样品P3-B分离较多,共得到6 株;15 d酒池中间样品P15-Z分离到2 株;27 d酒池中间样品P27-Z分离到1 株。在0、48、60 d酒醅样品中均未分离得到。
老巴说:“我晓得。刚才四强来借轮椅,我叫他晚上来拿。搁在墙角,蛮久没有用,灰大。你拿出来,抹一抹给他。”
2.2 菌株形态
2.2.1 12 号菌株在不同培养基斜面的生长情况
如表2所示,在CDA、ISP2、ISP3、ISP4、ISP5、R2A上均有不同程度的生长,以R2A培养基生长最优,菌体为黄色,有基内菌丝,不分泌色素,无气生菌丝。

表2 12号菌株斜面生长情况Table 2 Growth conditions of strain 12
2.2.2 12 号菌株平板及光学显微镜形态特征
12号菌株为革兰氏阳性菌株,在R2A固体培养基上生长3 d的平板及光学显微镜形态如图1、2所示。菌落为黄色,无孢子,表面有分泌物,有基丝,难以挑取。40 倍光学显微镜显示,菌株呈不规则球状,且分泌有大量颗粒状胞外物质。
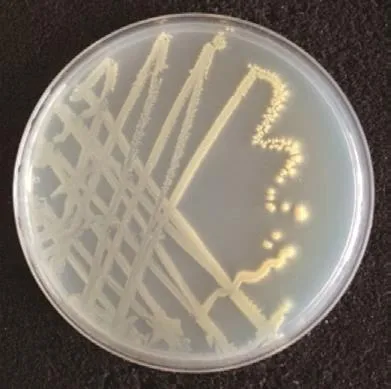
图1 12号菌株的平板菌落形态Fig.1 Plate colony morphology of strain 12
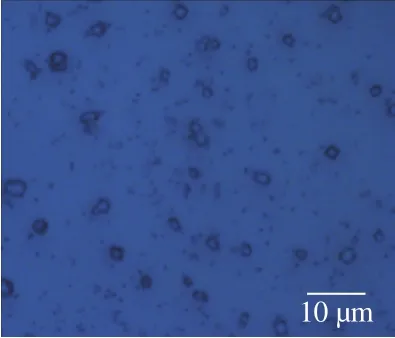
图2 12号菌株的相差显微镜形态Fig.2 Phase contrast microscope image of the morphology of strain 12
2.3 12号菌株16S rRNA基因分子鉴定及系统发育分析
16S rRNA基因比对结果表明:12号菌株与Cellulosimicrobium cellulans最为相似,相似度为99.72%,其次为C.aquatile(99.65%)、C.funkei(99.65%)、C.marinum(98.89%),初步判断12号菌株的分类地位为:细菌(Bacteria)、放线菌门(Actinobacteria)、放线菌纲(Actinobacteria)、微球菌目(Micrococcales)、原小单孢菌科(Promicromonosporaceae)、纤维微菌属(Cellulosimicrobium)。
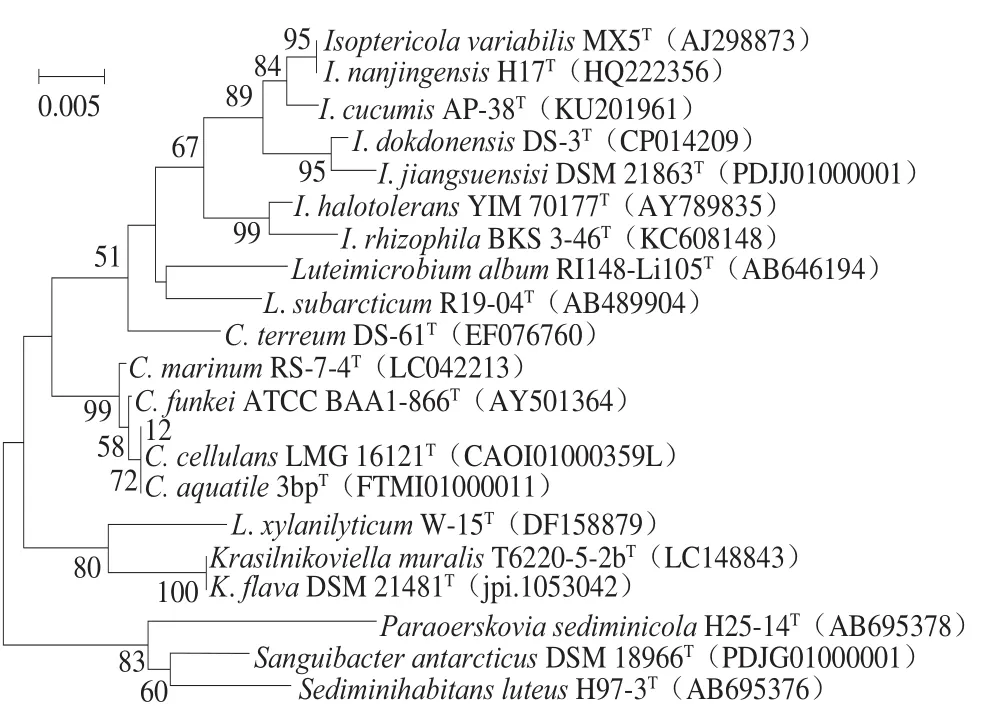
图3 12号菌株16S rRNA基因序列系统进化NJ树Fig.3 Neighbor-Joining phylogenetic tree based on nearly complete 16S rRNA gene sequence of strain 12
如图3所示,12号菌株与C.cellulans、C.aquatile共聚在一个分支上,说明在进化关系上与这两株菌较相近;3 株菌的共同分支与C.marinum、C.funkei分别位于不同的分支,5 株菌共同组成一个大的分支,综合16S rRNA基因序列比对结果,判断12号菌属于纤维微菌属(Cellulosimicrobium)。Schumann等[28]首次描述了纤维微菌属,目前为止,该属包括5 个生效发表种[29]:C.cellulans(2001)[28]、C.funkei(2006)[30]、C.terreum(2007)[31]、C.marinum(2016)[32]、C.aquatile(2015)[33]。该属的一个重要特征是具有纤维素分解活性。目前报道已经从临床样本[30]、土壤[31]、海底沉积物[32]、水库[33]、海洋海绵[34]、南极洲冰雪[35]等环境中分离到该类群。本次实验首次从宋河镇浓香型白酒酒醅中分离到纤维微菌属的菌株。
2.4 生理生化实验
2.4.1 温度耐受实验
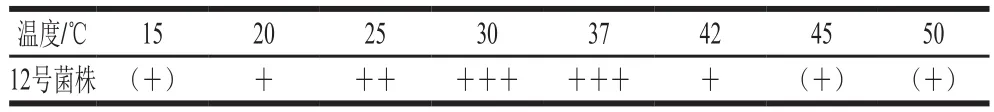
表3 12号菌株的温度生长情况Table 3 Growth of strain 12 at different temperatures
如表3所示,12号菌株的生长范围为15~50 ℃,最适生长温度为30~37 ℃。在20、25 ℃条件下生长较30 ℃与37 ℃时慢,感官判断香味较淡;在30~37 ℃生长趋势最好,感官判断香味较浓;42 ℃时生长开始减弱,45 ℃时生长受到高温抑制,50 ℃几乎不长。
2.4.2 抗生素实验
图4显示,卡那霉素、四环素、新生霉素、万古霉素、利福平、多黏菌素、氯霉素、庆大霉素、新霉素、红霉素这10 种抗生素对菌株具有明显抑制作用;诺氟沙星、氨苄西林、制霉菌素、杆菌肽这4 种抗生素对菌株没有抑制作用。
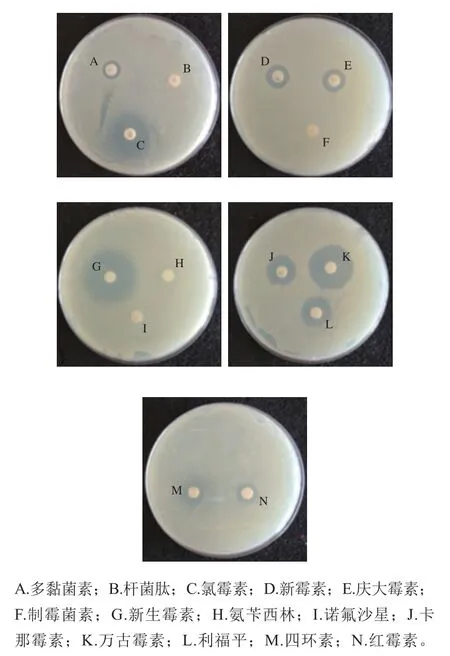
图4 12号菌株的抗生素实验Fig.4 Inhibitory effect of antibiotics on strain12
2.4.3 菌株酶活性特征
12号菌株在pH 7.0固体培养条件下,蛋白酶、氧化酶、过氧化氢酶为阳性;淀粉酶、纤维素酶、酯化酶均为阴性。不同的培养条件有可能会导致菌株的酶活性质发生变化,结合菌株的分离环境,选用液体条件下,以羧甲基纤维素钠、微晶纤维素、滤纸、淀粉、脱脂牛奶、三丁酸甘油酯,在不同的pH值条件下,测定其生长情况及相关酶活性性质。
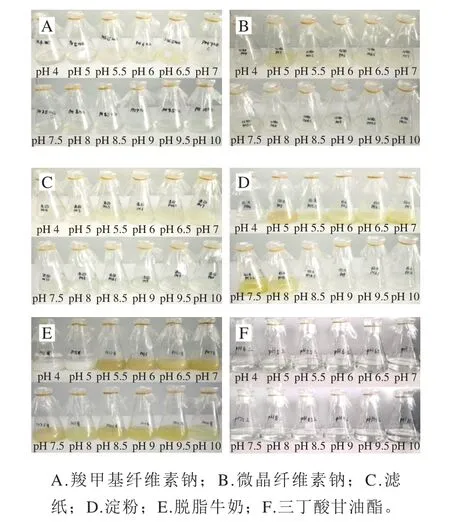
图5 12号菌株不同底物、不同pH值液体条件下生长情况Fig.5 Growth conditions of strain 12 in liquid medium with different substrates and at different pH values
如图5所示,以羧甲基纤维素钠为底物,4 d之后在pH 5.5~7.0范围内有明显生长现象;以微晶纤维素为底物,4 d之后在pH 5.5~7.0范围内有明显生长现象;以滤纸为底物,4 d之后在pH 5.5~7.0范围内有明显生长现象。采用3,5-二硝基水杨酸法测定还原糖结果表明,在以羧甲基纤维素钠为底物条件下,pH 5.5~6.0范围内还原糖检测反应为阳性;在以微晶纤维素为底物条件下,pH 5.0~6.5范围内还原糖检测反应为阳性;在以滤纸为底物条件下,pH 5.5~6.0范围内还原糖检测反应为阳性;3 种底物条件下能够在液体酸性条件下检测到菌株具有纤维素酶活性。菌株在以淀粉为底物的培养基中,1 d之后即有明显生长现象,pH 5.0~8.0之间均具有明显生长趋势,且各自表现出不同颜色,说明不同pH值条件下菌株以淀粉为底物发酵产物可能具有一定差异。牛津杯法检测发现pH 5.0~7.5的发酵液有淀粉酶活性。菌株在以脱脂牛奶为底物的培养基中,2 d能明显观察到生长现象,pH 5.0~10.0生长明显,牛津杯法检测发现pH 5.5~9.5的发酵液有蛋白酶活性。菌株在以三丁酸甘油酯为底物的培养基中,几乎观察不到生长现象,发酵7 d之后,牛津杯法检测不同pH值发酵液无酯酶活性。结合后续菌株API ZYM实验中,类脂酶(C14)活性为阴性,酯酶(C4)及类脂酯酶(C8)活性为阳性,有可能该菌株只能合成或分解较短的脂肪酸链,不能合成或分解较长的脂肪酸链。
2.4.4 12 号菌株API系统鉴定
2.4.4.1 12号菌株API 20NE检测结果
API 20NE结果表明,12号菌的硝酸盐还原、葡萄糖酸化、精氨酸双水解酶、脲酶、葡萄糖苷酶、明胶蛋白酶、半乳糖苷酶反应为阳性,色氨酸水解呈阴性,吲哚产生实验为阴性。碳水化合物同化实验中对硝基-D-甲基半乳糖、葡萄糖、阿拉伯糖、甘露糖、N-乙酰-葡萄糖胺、麦芽糖、葡萄糖盐酸同化实验为阳性,甘露醇、葵酸、己二酸、柠檬酸、苯乙酸同化实验为阴性。
2.4.4.2 12号菌株API 50CH检测结果
API 50CH结果显示,12号菌株能利用甘油、L-阿拉伯糖、D-木糖、半乳糖、葡萄糖、果糖、甘露糖、N-乙酰-葡糖胺、七叶灵、纤维二糖、麦芽糖、蔗糖、海藻糖、淀粉、肝糖、龙胆二糖、D-松二糖、D-米苏糖作为碳源生长且产酸。不能利用以下碳源产酸:赤藓醇、D-阿拉伯糖、核糖、D-木糖、L-木糖、阿东醇、β-甲基-D-木糖苷、山梨糖、鼠李糖、卫茅醇、肌醇、甘露醇、山梨醇、α-甲基-D-甘露糖苷、α-甲基-D-葡萄糖苷、苦杏仁苷、熊果苷、柳醇、乳糖、蜜二糖、菊糖、松叁糖、棉子糖、木糖醇、D-塔格糖、D-岩糖、L-岩糖、D-阿拉伯糖醇、L-阿拉伯糖醇、葡萄糖酸盐、2-酮基-葡萄糖酸盐、5-酮基-葡萄糖酸盐。结合菌株特殊的分离生境,菌株的产酸特性在酒醅发酵过程中可能具有重要的作用。具体产生何种酸及相关副产物有待于进一步分析。
2.4.4.3 12号菌株API ZYM检测结果
API ZYM结果显示,12号菌株的碱性磷酸盐酶、酯酶(C4)、类脂酯酶(C8)、白氨酸芳胺酶、缬氨酸芳胺酶、胰蛋白酶、胰凝乳蛋白酶、萘酚-AS-BI-磷酸水解酶、β-半乳糖苷酶、β-糖醛酸苷酶、葡萄糖苷酶、N-乙酰-葡萄糖苷酶反应为阳性。类脂酶(C14)、α-半乳糖苷酶、α-甘露糖苷酶、β-岩藻糖苷酶反应为阴性。
2.4.5 12 号菌株乙醇耐受实验
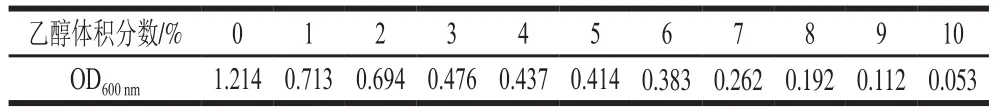
表4 12号菌株乙醇耐受实验OD600 nm值Table 4 OD600 nm values from tolerance of strain 12 to ethanol at different concentrations
选用刚加入菌液未发酵作为对照,测定其OD600nm为0.046。分析可知12号菌在0%~9%的乙醇体积分数下均具有一定的生长现象,但是随乙醇体积分数的进一步增加,菌株生长受到一定抑制(表4)。说明较高浓度的乙醇对菌株具有抑制作用,这也能够说明为何在48、60 d酒醅样品中并未分离到该菌株,而在3、15、27 d的酒醅样品中能够分离到该菌株。
2.5 菌株发酵液挥发性物质分析
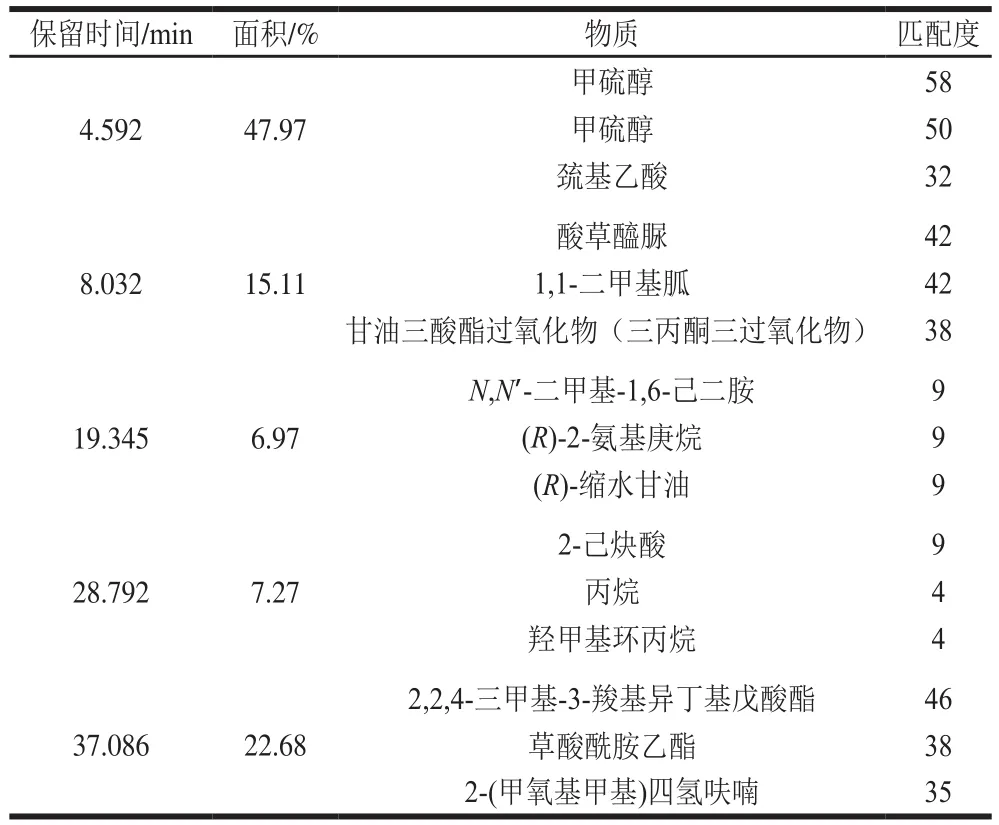
表5 12号菌株在有氧条件下挥发性物质检测结果Table 5 Analysis of volatile substances produced by strain 12 under anaerobic conditions
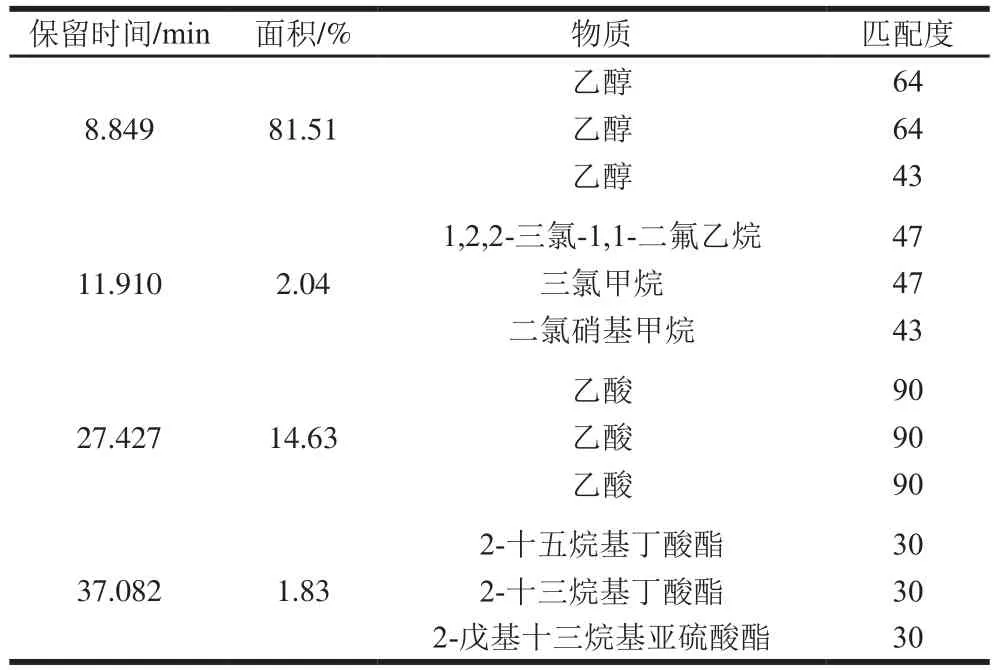
表6 12号菌株在厌氧(低氧)条件下挥发性物质检测结果Table 6 Analysis of volatile substances produced by strain 12 under aerobic conditions
白酒发酵过程既包含有氧也包含低氧条件,结合菌株在高氏培养基上能够闻到香味的特性,选用G培养基模拟在有氧及低氧条件下进行发酵,检测其中的挥发性物质。表5、6表明,在有氧条件下,淀粉为底物发酵液中检测到甲硫醇(匹配度58)、酸草醯脲(匹配度42)、2,2,4-三甲基-3-羧基异丁基戊酸酯(匹配度46),由于匹配度都较低,且对应结果的峰值过低,有可能是在发酵过程中大部分的挥发性物质已经散发,所以检测不到相关的风味物质。采用厌氧瓶密封发酵2 d,以淀粉为底物,检测到发酵液中可能含有乙醇(匹配度64)、醋酸(匹配度90)、1,2,2-三氯-1,1-二氟乙烷(匹配度47)、2-十五烷基丁酸酯(匹配度30)。相比较而言,菌株在低氧条件下主要是产酸及产乙醇,另外也有少量复杂化合物产生,在有氧条件下会更多地生成更为复杂的化合物,但是由于含量少或者是数据库未匹配到,所以目前未知其确切成分,有待于进一步分析。
3 结 论
12号菌株是分离自宋河镇浓香型白酒酒醅中的1 株产香放线菌,在酒醅发酵3、15、27 d的样点中均能分离得到,且在3 d样点中分离到的数目较多。12号菌株判断为纤维纤维微菌的一个菌株,首次在酒醅样品中分离得到,在R2A斜面培养基上生长最适合,其次是ISP3和ISP4。最佳生长温度为30~37 ℃,生长温度范围为15~50 ℃,乙醇耐受范围为0%~9%。菌株对诺氟沙星、氨苄西林、制霉菌素、杆菌肽不敏感,对卡那霉素、四环素、新生霉素、万古霉素、利福平、多黏菌素、氯霉素、庆大霉素、新霉素、红霉素等抗生素敏感。菌株在酸性或中性偏酸性液体条件下生长情况较好。菌株在液体条件下具有纤维素酶、淀粉酶、蛋白酶活性,在酸性条件下能够检测到以羧甲基纤维素钠、微晶纤维素、滤纸为底物纤维素酶活性;淀粉酶的活性主要是酸性条件下能够检测得到;蛋白酶的活性在酸性、中性及碱性条件下都能够检测得到;以三丁酸甘油酯为底物的酯酶活性在固体及液体条件下(pH 4.0~10.0)均未检测到。
微生物代谢参与了白酒发酵过程中复杂风味物质的形成,尤其是产香微生物,能够代谢产生香味物质或是香味物质的前体物质。本实验从宋河镇浓香型白酒酒醅样品中分离到12号菌株,通过感官评判,发现菌株能够产生一定的香味,通过进一步对菌株好氧及厌氧(低氧)条件下的挥发性物质进行检测,发现菌株在低氧条件下能够产生乙酸乙酯的前体物质乙醇、乙酸。结合API ZYM酶活性检测结果显示,菌株具有酯酶(C4)、类脂酯酶(C8)活性,无类脂酶(C14)活性;同时在以三丁酸甘油酯(C15)为底物的固体及液体条件下均未检测到酯酶活性,从而判断菌株可能合成或分解较短碳链的脂肪酸链,不能合成或分解较长的脂肪酸链。在后续的研究中,可以选择不同的碳源,添加适量氮源及延长发酵时间检测菌株的挥发性物质。同时可以对该菌株进行特定引物设计,利用免培养的手段从宋河镇浓香型白酒窖泥、酒醅、酒曲、环境等取样测定,探究菌株的来源。

