代谢工程改造谷氨酸棒杆菌生产甲硫氨酸
赵 兰,刘诗梦,秦汉雄,王亚南,樊占青,闵伟红
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
甲硫氨酸是生命体不可缺少的唯一含硫必需氨基酸,作为多种重要代谢物质的合成前体,参与机体细胞内转甲基和转硫基过程,对生物体新陈代谢起重要作用[1]。由于动物体内无法自身合成,必须从外部食物中获取,因此被广泛应用于食品、饲料、医药等多个领域,需求量巨大且附加值较高[2]。目前,甲硫氨酸的生产方法主要为化学合成法,该方法存在污染大、耗能高且产物不易分离等诸多不利因素[3],国内外研究学者及生产者不断寻求环境友好的微生物发酵法替代此方法生产。
但目前微生物发酵法难以实现工业化生产,其主要原因为微生物体内合成的代谢系统较为复杂,受到严格的调控作用,使得碳流竞争激烈无法为甲硫氨酸提供足够碳骨架[4-5]。甲硫氨酸合成途径中的关键酶,受到副产物赖氨酸及苏氨酸严格反馈抑制及反馈阻遏,影响了甲硫氨酸的合成[6]。需要改造具有解除末端氨基酸抑制作用的高酶活性突变菌,促使更多的碳流量进入甲硫氨酸合成途径。研究学者已相继解析了合成途径关键酶天冬氨酸激酶(aspartate kinase,AK)及高丝氨酸脱氢酶(homoserine dehydrogenase,HSD)的晶体结构、抑制方式、调节机制和效应物结合位点,为改造氨基酸生产菌株提供新的参考[7-11]。其次苏氨酸及赖氨酸支路对碳流量竞争激烈,影响了甲硫氨酸的合成。合成过程中,因碳流存在优先合成天冬氨酸半醛的调控机制使得苏氨酸与甲硫氨酸竞争更为激烈[12],又因单一敲除苏氨酸支路会导致菌株代谢不平衡,难以正常生长[13],因此可考虑采用系统代谢工程[14]获得弱化苏氨酸支路的生产菌株。使所合成苏基酸量仅供应菌株生长,同时解除其对AK及HSD的抑制作用,最终提高产量。本实验室以抗结构类似物北京棒杆菌(Corynebacterium pekinense)E31为基础,对天冬氨酸族氨基酸代谢途径的关键酶进行研究,发现了单体酶AK,筛选出影响AK及HSD活性的多个关键残基位点,构建了多株高酶活性且解除反馈抑制作用的菌株[15-17]。
谷氨酸棒杆菌具有代谢调控系统简单、遗传背景清晰且无致病性等优点,常被用来生产天冬氨酸家族氨基酸[18-21]。本研究对谷氨酸棒杆菌代谢途径进行改造,通过不同遗传操作手段逐步探究合成途径阻遏关键位点。在对合成途径关键酶AK、HSD及高丝氨酸乙酰基转移酶(homoserine acetyltransferase,HAT)[22]进行改造的基础上构建串联过表达载体,以增强各关键酶的表达量,最终通过实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)、高效液相色谱分析基因表达情况及氨基酸变化情况,探究碳流阻遏点。并对苏氨酸支路thrB的底物高丝氨酸结合位点A20进行酸性、碱性、极性和非极性4 种类型8 种不同氨基酸定点突变研究,筛选相比于原菌酶活性降低的突变体。以期为规模化微生物发酵法生产提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
谷氨酸棒杆菌ATCC13032、北京棒杆菌AS1.299、天冬氨酸重组载体(PET28a-lysC)及HSD重组质粒(PMD18T-hom)、克隆宿主大肠杆菌DH5α和表达宿主大肠杆菌BL21(DE3)均由实验室提供;穿梭表达载体PECXK99E 湖南丰晖生物科技有限公司。
1.1.2 试剂与培养基
MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0、ExTaq®Prime STAR®HS DNA Polymerase、T4 DNA Ligase、pMD™18-T Vector Cloning Kit、DpnI消化酶 TaRaKa(大连)有限公司;ClonExpress MultiS One Step Cloning Kit 诺唯赞生物科技有限公司;BamHI、EcoRI、HindIII、salI、sacI等限制性核酸内切酶 莫纳(苏州)生物科技有限公司;DiaSpin Plasmid Mini-Preps Kit、DiaSpin DNA Gel Extraction Kit生工生物工程(上海)股份有限公司;real-time PCR相关试剂盒TransGen Biotech试剂公司;丙基硫代-β-D-半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、氨苄霉素、卡那霉素 北京鼎国生物公司;SB C18柱(150.0 mm×4.6 mm,5 μm) 安捷伦科技(中国)有限公司。
LB培养基:蛋白胨10 g/L,酵母浸粉5 g/L,NaCl 10 g/L(固体培养基另外添加20 g/L琼脂糖)。种子培养基:葡萄糖25 g/L,玉米浆20 g/L,尿素1.25 g/L,KH2PO41 g/L,MgSO45 g/L,pH 7.2。发酵培养基:葡萄糖30 g/L、玉米浆10 g/L、生物素0.05 mg/L、KH2PO40.5 g/L、VB10.5 mg/L、VB63.0 mg/L、VB120.1 g/L、(NH4)2SO410 g/L、MnSO45 mg/L、FeSO45 mg/L、MgSO40.25 g/L及CaCO310 g/L,pH 7.2。谷氨酸棒杆菌感受态制备培养基:酵母浸粉2.5 g/L,蛋白胨10 g/L,NaCl 10 g/L,甘氨酸3 g/L,吐温80 0.1%。谷氨酸棒杆菌电转化恢复培养基:酵母浸提物2.5 g/L,蛋白胨5 g/L,NaCl 5 g/L,D-山梨醇91 g/L,脑心浸液18.5 g/L。固体培养基加入琼脂粉20 g/L。必要时添加质量浓度为30 μg/mL的卡那霉素。
1.2 仪器与设备
DYCP-31DN核酸电泳仪 北京市六一仪器厂;Research plus移液枪 德国Eppendorf公司;WFH-201BJ琼脂糖凝胶像成像仪 美国GE公司;TissuePrep快速组织细胞破碎仪 杰灵科技有限公司;Mx3000P荧光定量PCR仪、XDB-C18液相色谱柱 安捷伦科技有限公司;DL-CJ-2N荧光定量PCR工作台 北京东联哈尔仪器制造有限公司;ACQUITY高效液相色谱 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 载体与引物

表1 本研究构建质粒Table 1 Plasmids and strains used in this study
本实验构建载体如表1所示。NCBI数据库谷氨酸棒杆菌ATCC13032基因组序列为基础,利用Primer 5.0软件进行目的基因克隆引物设计,通过南京诺唯赞生物科技有限公司CE Design V1.04及Primer 5.0软件进行同源臂扩增引物设计,并由生工生物工程(上海)股份有限公司合成,具体引物设计如表2所示。
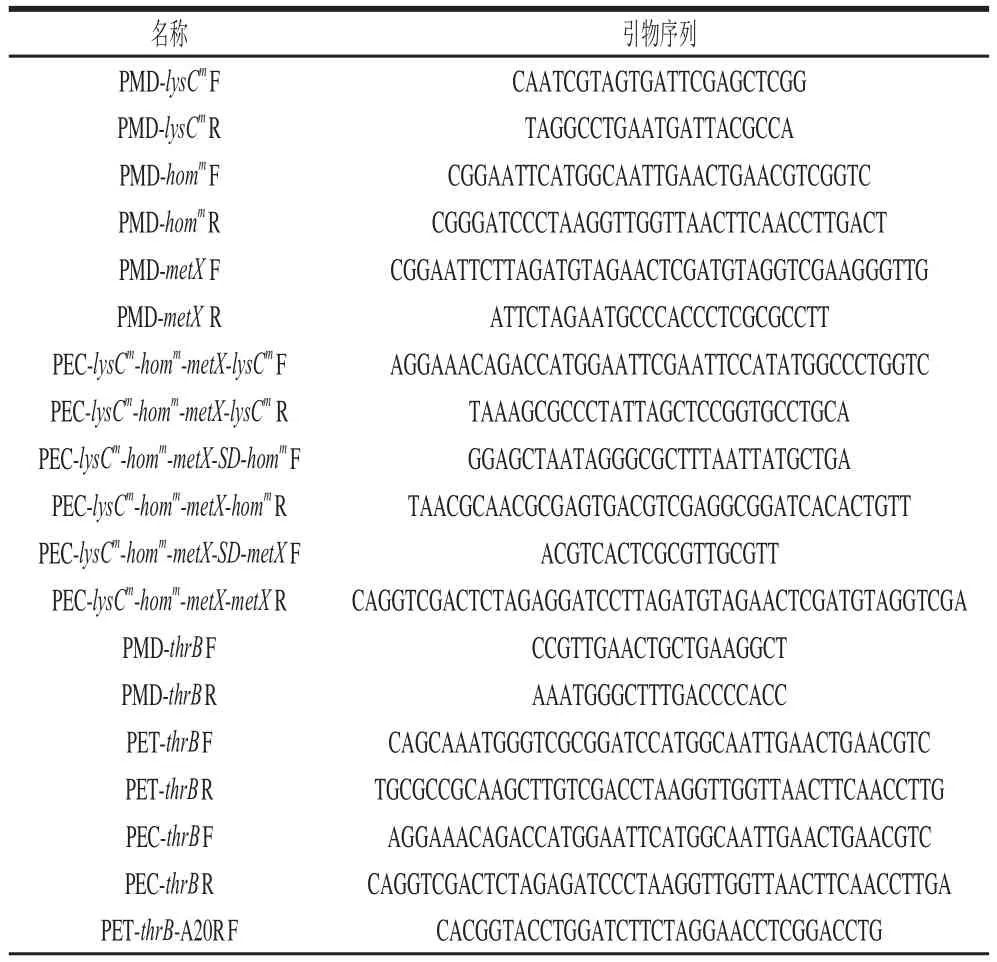
表2 PCR扩增引物Table 2 Sequences of primers used for PCR

续表2
1.3.2 关键酶过表达载体构建与发酵分析
(二)文艺影视及文学作品中的经典台词。影视作品的热播、文学作品出炉以及许多文艺节目的火爆,往往使其中的经典台词备受关注,成为流行语。如:
1.3.2.1 过表达载体构建
同源臂引物扩增实验室筛选并保存的北京棒杆菌高酶活性目的基因AKM372I/T379W(简称lysCm)及带有SD序列的目的基因homL206D(简称homm),从谷氨酸棒杆菌基因组上扩增HAT编码基因metX,并连接于PMD-18T重组载体上,重组载体上扩增带有SD序列的目的片段SD-metX。PCR条件:94 ℃预变性4 min,94 ℃变性45 s,48 ℃退火30 s,72 ℃延伸20 s,72 ℃终延伸5 min,4 ℃保存10 min。通过ClonExpress MultiS One Step Cloning Kit连接试剂盒构建重组载体PEC-lysCm-SD-homm-SD-metX,按照说明书添加相应试剂,混合后37 ℃反应30 min,立即置于冰上冷却,将待转入100 μL的DH5α感受态细胞置于冰上解冻,取10 μL重组产物反应液加入感受态细胞中,缓慢吹打混匀,冰上预冷30 min,42 ℃热激90 s后立即冰上孵育10 min,添加600 mL LB培养基中,水平摇床37 ℃、200 r/min振荡培养30 min后离心去上清液,剩余菌液涂布于含30 μg/mL卡那霉素抗生素平板上进行修复培养,挑取单菌落送于生工生物工程(上海)股份有限公司测序。并将测序成功的重组载体电转入谷氨酸棒杆菌。
1.3.2.2 real-time PCR分析
首先进行引物浓度优化,选择200 nmol/L为引物终浓度。选取经IPTG诱导后的菌体进行real-time PCR检测。利用液氮组织研磨机对菌株进行破碎处理,根据TransZol Up Plus RNA Kit细菌RNA提取试剂盒提取总RNA。测定RNA提取质量,选取R值在1.8~2.0之间质量较好的样品进行逆转录实验,获取cDNA模板进行realtime PCR验证。PCR条件:94 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s;72 ℃终延伸5 min。其中步骤2~4重复40 个循环,采集退火时间段内荧光信号。参照-2-ΔΔCt模型处理数据。
1.3.3 过表达菌株发酵高效液相色谱分析
对构建的过表达菌株WTg1/PEC-lysCm-SD-homm-SD-metX和野生WTg1进行72 h发酵培养,每6 h留取样品,测定还原糖含量及生长曲线[23-25]。对谷氨酸棒杆菌天冬氨酸家族几种重要的氨基酸变化情况进行分析,寻找代谢途径阻遏原因。
配制天冬氨酸、苏氨酸、赖氨酸、甲硫氨酸和异亮氨酸标准品,每种氨基酸浓度为10 nmol/μL,根据安捷伦提供advance Bio AAA试剂和标准品说明书配制17 种氨基酸混合标准品。以邻苯二甲醛及9-氯甲酸芴甲酯进行发酵液柱前衍生,17 种氨基酸混合标准品进行液相色谱条件摸索,直到在38 min内各峰均分离良好。流动相A、B见表3,A、B相均用0.45 μm再生纤维素膜过滤,超声处理充分混合。柱温40 ℃,流速1.2 mL/min,检测波长338 nm(高丝氨酸265 nm),进样量9 μL。具体的梯度洗脱程序如表3所示。
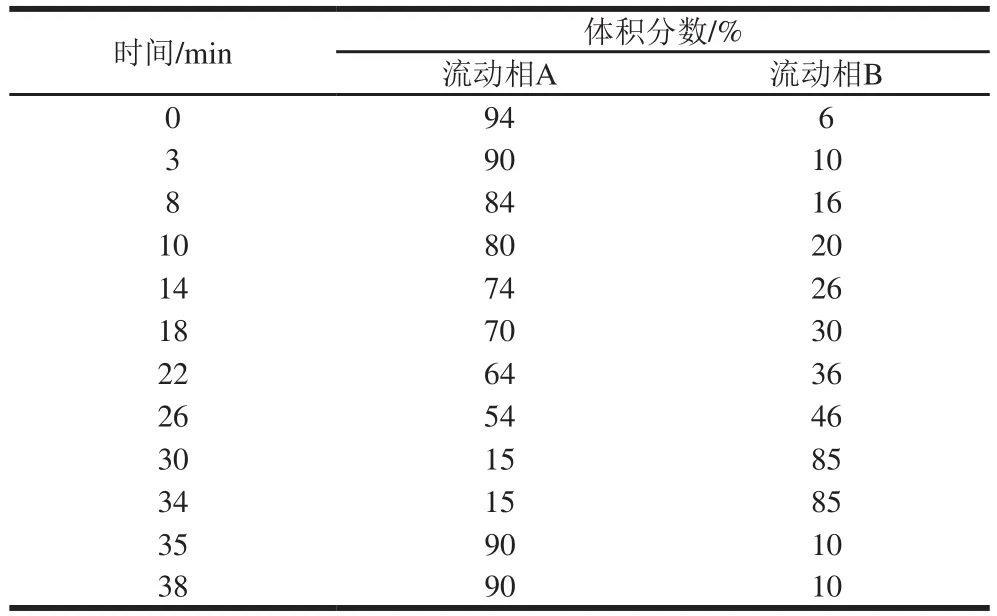
表3 梯度洗脱程序Table 3 Gradient elution program
1.3.4 苏氨酸支路thrB突变体酶活性分析
1.3.4.1 HSK体外载体构建
采用常规CaCl2法制备BL21宿主感受态,提取谷氨酸棒杆菌基因组,同源臂引物扩增thrB目的基因并与带有组蛋白(His)的原核表达质粒PET-28a连接,构建重组表达载体PET-thrB。
根据谷氨酸棒杆菌ATCC13032的thrB基因序列及其与大肠杆菌共同偏好密码子设计引物,对thrB重组载体的底物高丝氨酸结合位点A20定点突变[26],经DpnI消化后热激法转入BL21感受态,活化培养后送于生工生物工程(上海)股份有限公司测序。
1.3.4.2 酶促动力学分析
将测序成功菌株按2%接种量转接到100 mL LB摇瓶内进行扩大培养。当菌体浓度(OD600nm)达到0.6时,添加终浓度为1 mmol/L的IPTG诱导蛋白表达,25 ℃、130 r/min过夜培养,4 ℃、8 000 r/min离心10 min收集菌体,加入10 mL预冷磷酸盐缓冲溶液重悬菌体,超声破碎离心后取上清液进行0.22 μm滤膜处理即为AK粗酶液,通过非变性镍柱不同浓度咪唑溶液梯度洗脱去除杂蛋白,最后经500 mmol/L咪唑洗脱得到的溶液即为thrB突变体纯化液[27]。对野生型和突变体分别进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)[28]分析。
HSK活性测定参照Lee等[29]方法略有改动,每组3 个平行实验。测定0.5~15 mmol/L不同底物浓度条件下thrB突变体纯化酶活性,以米氏方程进行非线性拟合,得到酶动力学曲线。300 μL反应终浓度体系:0.5 mmol/L NADH,10 mmol/L MgSO4,1.2 mmol/L磷酸烯醇丙酮酸,7 mmol/L KCl,3 mmol/L ATP,10 U丙酮酸激酶,15 U乳酸脱氢酶,50 mmol/L Tris-HCl(pH 8.4),3 mol/L高丝氨酸。25 ℃温育10 min连续监测法实时监测OD340nm的降低,进而确定HSK催化L-高丝氨酸的反应速度,每分钟催化1 μmol高丝氨酸转化O-磷酸高丝氨酸所需酶量为1 个酶活性单位,计算Vmax及Km值。其中Vmax表示在一定酶量下的最大反应速率,即酶完全被底物饱和时的反应速度,与酶浓度呈正比。Km值表示酶促反应的初速率为Vmax一半时的底物浓度,单位为mmol/L。
1.3.4.3 酶学性质表征
最适温度:野生型纯化后WT-thrB酶活性最适温度为25 ℃,反应体系不变的情况下,在不同温度(18、20、24、28、32、36、 40、44、48 ℃)下连续监测反应30 min,每组样品3 次平行,最高酶活性定义为100%。
最适pH值:野生型纯化后WT-thrB酶活性最适pH 8.0,反应体系不变的情况下,调节反应体系中Tris-HCl缓冲液pH值(6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0),连续监测反应30 min,每组样品3 次平行,最高酶活性定义为100%。
稳定性:在最适温度和最适pH值下,将thrB突变体纯化酶加入反应体系中,反应连续4.5 h内测定酶活性,初始酶活性定义为100%,并以时间为横坐标,相对酶活性为纵坐标,每隔30 min检测酶活性,每组样品3 次平行。
1.4 数据统计分析
2 结果与分析
2.1 过表达连接及real-time PCR分析
本研究组已对北京棒杆菌AS1.299基因组AK及HSD进行克隆、突变和筛选研究,并对所得突变体进行酶动力学分析,其中AK M372、T379位点是抑制剂赖氨酸结合口袋的关键残基且高度保守,突变体AKM372I/T379W有效削弱了赖氨酸与结合口袋附近残基的结合,解除了赖氨酸对AK的反馈抑制作用,突变后最适pH值减小,耐受范围变广,半衰期有所延长,相比WT AK活性提高36.37 倍。HSD第206位点在家族中高度保守,参与底物的结合,突变成异亮氨酸后侧链官能团减小,空间位阻降低,更有利于与底物结合,HSDL200D相比于WT HSD活性提高了17.68 倍[30]。基因扩增及载体构建结果如图1所示。图1A中,扩增AK目的基因lysCm为1 274 bp,扩增HSD目的基因homm为1 338 bp,扩增HAT目的基因metX为1 140 bp。扩增所得长度与目的片段大小相符,证明各连接目的片段扩增成功。图1B中,穿梭表达载体PECXK99E大小为7 018 bp,重组载体扩增得到4 000 bp左右lysCm-SD-homm-SD-metX连接片段,证明过表达载体构建成功。
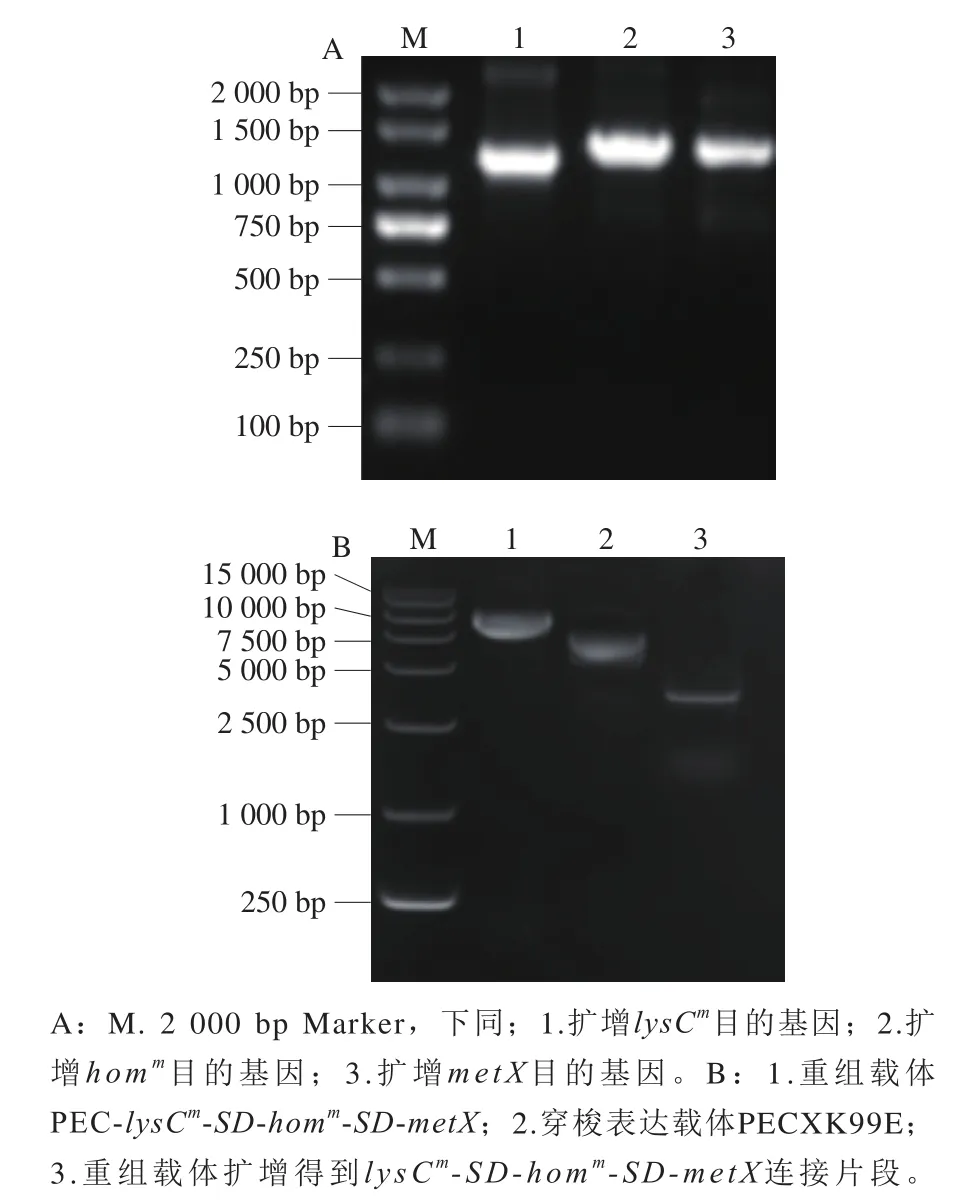
图1 过表达基因扩增(A)及载体构建核酸电泳验证(B)Fig.1 Amplification of the overexpressed genes (A) and nucleic acid electrophoresis verification of the constructed vector (B)
以谷氨酸棒杆菌的DnaE基因作为内参基因,对野生型谷氨酸棒杆菌WTg1及过表达菌株WTg1/PEC-lysCm-SD-homm-SD-metX中lysC、hom和metX基因进行real-time PCR分析。结果显示,WTg1/PEC-lysCm-SD-homm-SD-metX中lysC、hom和metX的表达量分别为出发菌株WTg1中对应基因表达量的6.896、2.378 倍和1.659 倍,表明AK、HSD及HAT基因串联过量表达有效。
2.2 过表达菌株高效液相色谱分析
分别对野生型菌株WTg1和过表达菌株WTg1/PEC-lysCm-SD-homm-SD-metX进行微生物发酵培养,并对72 h发酵上清液进行反相高效液相色谱检测[31-34],结果如表4所示。过表达菌株天冬氨酸、谷氨酸积累量降低显著,无明显积累;苏氨酸和异亮氨酸产量同步降低;赖氨酸产量相应提高,甲硫氨酸产量明显提高。

表4 发酵液氨基酸质量浓度Table 4 Concentrations of amino acids in fermentation broths g/L
过表达AK使得碳源流经三羧酸循环后更易流经天冬氨酸下游支路氨基酸的合成,使得Glu产量由原菌的1.45 g/L减少到0.07 g/L。real-time PCR分析可见过表达后HSD转录水平提高到2.378 倍,使得天冬氨酸积累量降低至0.09 g/L,碳流量途经中间酶AK及HSD不会产生过多积累,更有利于下游氨基酸的合成。过表达HAT使苏氨酸由原菌2.93 g/L降至1.61 g/L,赖氨酸产量变化不大,甲硫氨酸产量相比原菌提高到2.26 倍,达到4.14 g/L。
结合real-time PCR及液相色谱氨基酸分析,改造并过表达甲硫氨酸支路关键酶可有效促进碳流量,减少谷氨酸棒杆菌代谢途径中主要谷氨酸积累,提高了甲硫氨酸产量。同时发现,经改造后菌株WTg1/PEC-lysCm-SD-homm-SD-metX代谢途径中苏氨酸积累量过多,是甲硫氨酸合成途径碳流竞争的第一大氨基酸。推测如果有效减少苏氨酸产量将更有利于提高甲硫氨酸产量,故本实验试图对苏氨酸支路首个关键酶thrB进行弱化研究。
2.3 thrB突变载体构建
本实验从谷氨酸棒杆菌基因组上扩增HSK目的基因thrB进行PET-28a表达载体连接。进行1%琼脂糖核酸电泳验证,图2A中,基因组扩增thrB靶片段为1 000 bp,重组载体PET-thrB为6 369 bp,连接载体双酶切验证,两条明显条带分别于1 000 bp及5 000 bp左右,这与目的片段及线性化载体大小相符。图2B为重组载体突变后PCR扩增电泳,证明质粒在引物作用下实现了大量的复制。目的片段送于生工生物工程(上海)股份有限公司测序,连接成功。
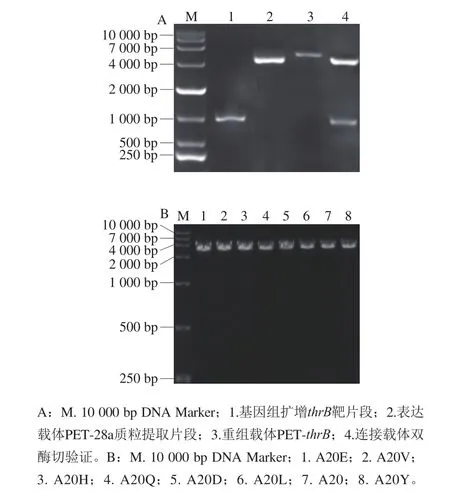
图2 载体构建(A)及突变PCR产物(B)琼脂糖核酸电泳Fig.2 Agarose gel electrophoresis of PCR products of the constructed vector (A) and site-directed mutations (B)
2.4 thrB突变株酶活性筛选及分析
野生型和突变体经非变性镍柱纯化后进行12% SDSPAGE验证实验(图3)。野生型和突变体纯化酶在12%SDS-PAGE的37 kDa左右处均存在单一明亮条带,表明thrB突变体蛋白在诱导剂IPTG的作用下表达成功,可用于酶动力学测定及酶学性质表征。
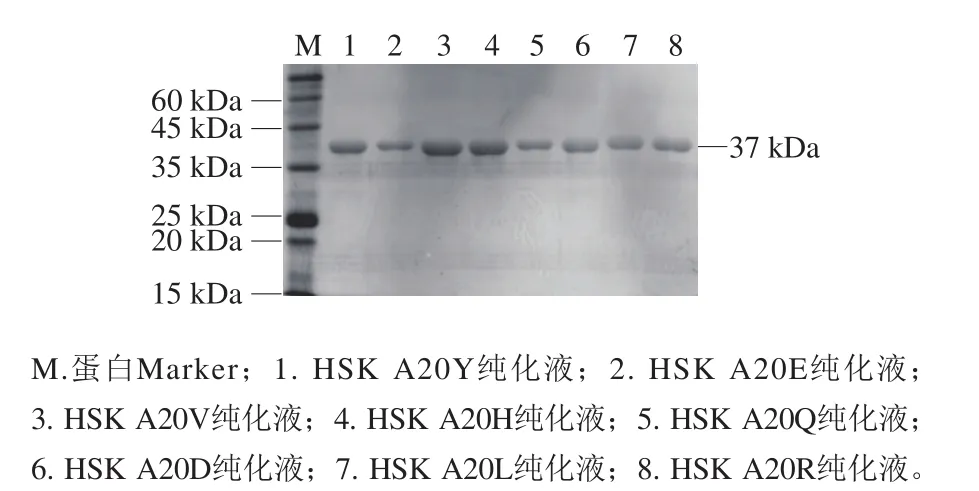
图3 12%SDS-PAGE分析Fig.3 12% SDS-PAGE analysis of the overexpressed protein
本实验对thrB进行酸、碱、极性和非极性4 种性质8 种氨基酸进行定点突变,并对突变体进行酶动力学研究及酶学性质表征,结果如表5所示。HSK 20位点丙氨酸突变成8 种不同氨基酸后酶活性多数降低,由各菌株Vmax可以看出其中突变体thrB-A20H及thrB-A20Y的酶活性降低较为显著,分别为WT-thrB的43%及39%,最适温度升高至30 ℃和35 ℃。碱性氨基酸组氨酸最适pH值增加至8.5,半衰期延长,更有利于微生物发酵生产蛋氨基酸。
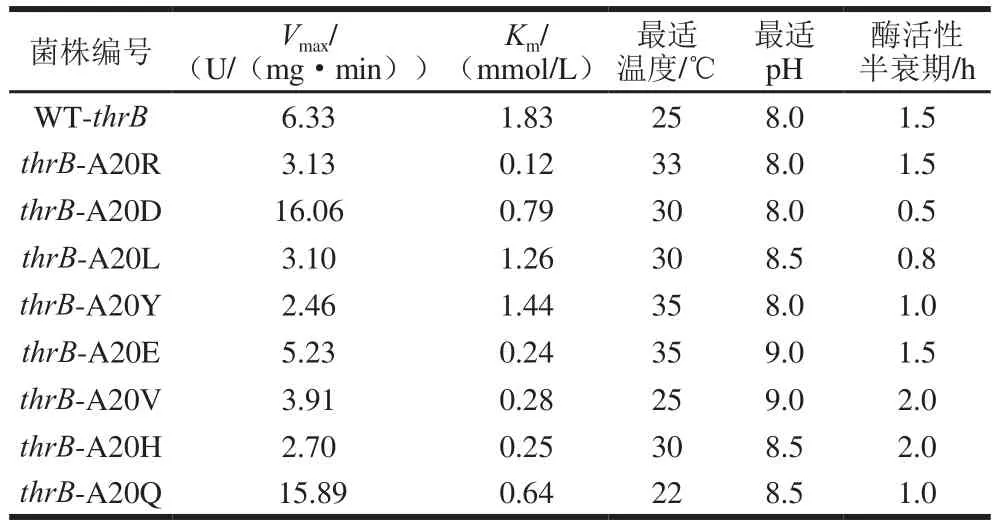
表5 各菌株HSK活性Table 5 HSK activity of each strain
突变体thrB-A20Y酶活性降至原菌39%,酶活性降低最为显著,对该突变位点进行原子间静电力及Pymol图谱分析,见图4。静电势由±74.552 kJ/mol变为±74.573 kJ/mol,这可能是由于非极性氨基酸丙氨酸突变为极性氨基酸酪氨酸,导致氢键供体数增加,极性表面积增大。酪氨酸侧链较大,与底物高丝氨酸的空间位阻增大距离变远,导致高丝氨酸不能很好地进入底物结合口袋,影响酶与底物结合效率,使酶活性降低。
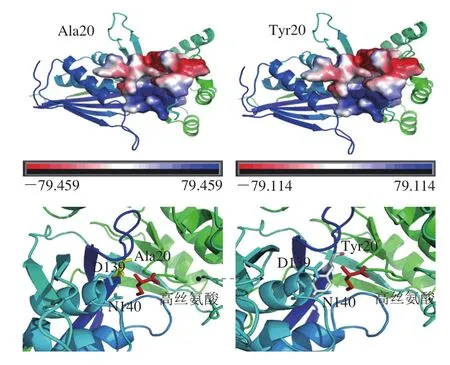
图4 thrB-A20Y突变后氨基酸静电势及与底物之间Pymol图Fig.4 Electrostatic potential of amino acids and Pymol diagram between amino acids and substrate after thrB-A20Y mutation
3 结 论
本实验通过在谷氨酸棒杆菌内串联表达合成途径关键酶基因LysCm、homm和metX,获得菌株WTg1/PEC-lysCm-SD-homm-SD-metX,有效增加了合成途径的碳流量,使积累量大幅度提高,达到4.14 g/L,实现了产量的提高。实验对苏氨酸支路关键酶thrB基因进行定点突变研究,获得多株酶活性降低突变株,其中thrB-A20Y活性降至原菌39%,为微生物体内弱化苏氨酸支路、增强甲硫氨酸积累提供理论基础。

