pH值对米糠清蛋白和球蛋白的结构、溶解性及表面疏水性的影响
杨 健,富天昕,张 舒,冯玉超,王长远,,
(1.国家杂粮工程技术研究中心,黑龙江 大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
米糠是稻米加工的副产品,其营养物质丰富,是我国一种量大面广的可再生资源。米糠蛋白生物效价高,其中必需氨基酸的组成平衡合理[1],接近FAO/WHO推荐模式,是公认的优质植物蛋白质[2]。米糠蛋白组分复杂,溶解性较差,所以其加工性能差,米糠分离蛋白的提取率低、产品的功能性质不佳,极大地限制了米糠蛋白的工业化生产[3-4],因此米糠蛋白质的提取和改性工作成为研究的重点。碱溶法是提取米糠蛋白的适合方法[5-7],说明pH值对米糠蛋白的提取影响较大。pH值的改变不仅会影响蛋白质的带电性质,改变蛋白质功能基团的电离作用,还会影响蛋白质之间的相互作用,从而影响蛋白质的溶解性及其他功能性质。因此了解米糠蛋白质的功能性质以及结构随pH值变化的规律,有利于米糠蛋白的提取,以及在生产过程中对食品感官特性的保护和营养价值的保留。王长远等[8]利用不同pH值的缓冲液处理米糠蛋白发现,pH值对米糠蛋白的荧光光谱有一定影响,并且在酸性环境中,米糠蛋白的亚基组成变化明显。另外,蛋白质结构相关研究方法中,改变蛋白溶液的pH值是常用技术之一,当介质的pH值处于蛋白质等电点附近发生变化时,电荷斥力有所增加,迫使蛋白分子发生部分展开。有研究表明,经过不同pH值处理后,蛋白质结构及其相关功能特性会发生显著改善[9]。
米糠蛋白可分为清蛋白、球蛋白、谷蛋白和醇溶蛋白,其中清蛋白和球蛋白的含量所占比重达73%[10],因此将其作为本研究的2 个目标蛋白。研究pH值对米糠清蛋白和球蛋白结构、溶解性及表面疏水性影响,有利于了解米糠蛋白亚基组分和空间构象与其加工处理条件的关系,对解决米糠蛋白提取率不高、加工性能不佳等问题具有指导意义,也为今后开发米糠蛋白产品的高效提取分离及加工提供理论依据。
1 材料与方法
1.1 材料与试剂
原料米糠购自黑龙江省农垦总局查哈阳农场(水稻品种为空育131);米糠清蛋白、球蛋白为实验室自制。
Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三(羟甲基)氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、过硫酸铵、四甲基乙二胺、β-巯基乙醇、尿素美国Sigma公司;蛋白Marker(SM0431) 加拿大富酶泰斯公司。
1.2 仪器与设备
1100 型氨基酸自动分析仪 美国Agilent公司;Mini-Protean 4电泳仪 美国Bio-Rad公司;ZetaPALS-激光粒度分析仪、ZetaPALS-Zeta电位仪 美国布鲁克海文仪器公司;AKTA-蛋白质纯化仪 美国GE公司;PE Pyris6差示扫描量热仪 美国Pulus TA.XT公司。
1.3 方法
1.3.1 原料米糠的脱脂处理
取原料米糠过60 目筛,按照1∶10(V/V)加入正己烷,室温下不断搅拌脱脂4 h,其间换正己烷(石油醚)2~3 次,4 000 r/min离心10 min,上清液用蒸馏法回收正己烷,脱脂后将米糠置于通风橱中挥发48 h,脱脂米糠粉装入具塞试剂瓶中,置于冰箱4 ℃保存备用。
1.3.2 米糠蛋白组分提取及含量测定
采用Osbrone方法[11]提取米糠中的清蛋白和球蛋白。在室温下,将100 g脱脂米糠与0.4 mol/L的NaCl溶液按1∶5(g/mL)的料液比混合,磁力搅拌1 h,4 500 r/min离心15 min,收集上清液,沉淀重复提取1 次,将2 次提取的上清液合并后抽滤,在4 ℃对蒸馏水透析48 h后离心,上清液为清蛋白,沉淀为球蛋白,冷冻干燥,所得蛋白干粉于-20 ℃冷冻保存备用。用Lowry法测定提取液中蛋白质含量[12]。
1.3.3 米糠蛋白亚基组成的测定
参考Laemmli[13]的SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)不连续电泳方法。分离胶质量分数为12%,浓缩胶质量分数为4%。蛋白质质量浓度为1 mg/mL,上样量10 μL,电泳前在95 ℃加热5 min。电泳开始时电流为10 mA,样品进入分离胶后为20 mA。染色剂为0.1%考马斯亮蓝R-250,脱色剂为(甲醇-冰乙酸-水(4∶1∶5,V/V))混合溶液。
1.3.4 米糠清蛋白及球蛋白的不同pH处理
配制10 mmol/L pH 2的甘氨酸-盐酸缓冲液,pH 4~6的柠檬酸-柠檬酸钠缓冲液,pH 7~9的Tris-HCl缓冲液,pH 11的甘氨酸-氢氧化钠缓冲液(0.05 mol/L)。准确称取一定量的蛋白质样品,溶于不同pH值(按照蛋白的等电点,共设计5 个pH值梯度)的缓冲液中,调节各溶液终质量浓度到1 mg/mL,室温下放置一定时间后,冷冻干燥,所得蛋白样品干粉于-20 ℃冷冻保存备用。
1.3.5 溶解性的测定
参考张相伦[14]的方法,用氮溶解指数(nitrogen solubility index,NSI)表示溶解性。称取100 mg蛋白样品分散于10 mL的去离子水中,磁力搅拌30 min,20 ℃、12 000×g离心20 min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。氮溶解指数计算如下:

1.3.6 表面疏水性的测定
采用8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针参考周麟依等[15]的方法对米糠蛋白组分进行表面疏水性测试。ANS标记液浓度为8 mmol/L,依据浓度梯度法建立荧光强度-底物浓度线性关系,进而确定蛋白质表面疏水性。
1.3.7 流体动力学半径及其分布的测定
采用ZetaPlus粒度分析仪测定米糠蛋白的流体动力学半径及其分布径。将米糠蛋白样品用50 mmol/L pH 7.0的磷酸缓冲液稀释蛋白质质量分数至0.2%。过0.45 μm醋酸纤维膜(水系),于室温进行测量,取3 次测量的平均值[16]。
1.3.8 Zeta电位的测定
将米糠蛋白样品用50 mmol/L pH 7.0的磷酸缓冲液稀释蛋白质质量分数至0.2%。上样体积为1 mL,测定温度为25 ℃。重复测量6 次,计算平均值为测定值[16]。
1.3.9 圆二色谱(circular dichroism,CD)的测定
参考Greenfield[17]和张涛等[18]的方法。采用远紫外区域CD研究不同品种蛋白的二级结构。扫描波长范围200~250 nm,(25±1)℃,扫描速率为100 nm/min,样品池光程为0.1 nm,灵敏度为100 mdeg/cm。米糠蛋白质量浓度为0.4 mg/mL,用pH 7.0,0.01 mol/L的磷酸缓冲液配制。用平均摩尔椭圆率(θ)表示CD数据,单位为deg·cm2/dmol。通过CDPRO软件分析CD色谱图数据,使用的算法为CONTIN/LL,使用的参考蛋白为SMP56,取蛋白平均残基含量为115 g/mol,计算波长范围为200~240 nm,计算α-螺旋、β-折叠、β-转角与无规卷曲的含量[19]。
1.3.10 拉曼光谱的测定
将米糠蛋白粉末直接平铺在载玻片上进行拉曼测定,激发光波长为785 nm,激光功率为300 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10 次,4 次扫描进行累加[20]。以苯丙氨酸(1 003 cm-1)作为归一化因子,得到米糠蛋白的拉曼光谱。
1.3.11 氨基酸组成的测定
参考黄友如[21]的酸水解方法。首先将蛋白样品经氯仿-甲醇(2∶1,V/V)的混合溶液进行脱脂处理,然后将蛋白样品置于水解管中,加入6 mol/L的盐酸溶液,在110 ℃密闭条件下水解1 d,冷却后定容、过滤、蒸干,再加入0.02 mol/L的盐酸溶液,在真空中放置30 min,采用1100型氨基酸自动分析仪测定除色氨酸以外的其他氨基酸的含量。
1.3.12 酪氨酸残基分子数计算
本实验利用式(2)和式(3)进一步精确地计算分子内部包埋和分子表面暴露的酪氨酸残基分子数N[22]。
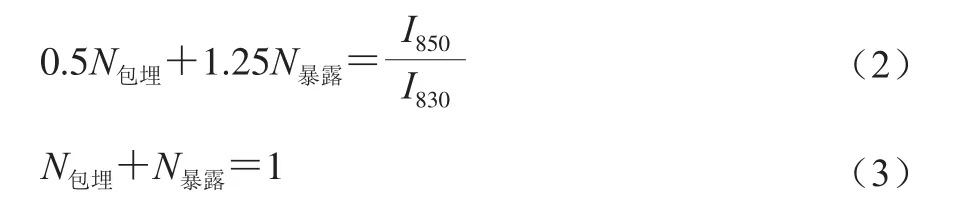
由于方程适用于I850/I830比值为0.5~1.25,对实验测定结果计算发现比值符合上述范围,故采用上述方程进行计算分析。
1.4 数据统计及分析
每个实验重复3 次,数据统计分析采用SPSS 20.0软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异。采用Origin 8.0软件、PeakFit 4.12软件、CDPro软件包分析等进行图谱分析处理和图表制作。
2 结果与分析
2.1 米糠成分的测定

表1 米糠基本化学组成分析Table 1 Chemical components of rice bran%
由表1可知,新鲜米糠中脂肪质量分数为26.7%,经正己烷脱脂后米糠的脂肪质量分数为3.92%,脱脂率为85.31%。脱脂后蛋白质质量分数高达15.76%,高于精白米本身的蛋白质质量分数(6%~10%)[23-25],可见脱脂米糠是大米加工的副产品,是良好的植物蛋白资源。
2.2 米糠清蛋白、球蛋白的检测
Lowry法[12]测定提取液中蛋白质含量结果表明,在脱脂米糠中球蛋白提取率为30.5%,清蛋白提取率为34.6%;球蛋白的蛋白质纯度为78.2%,清蛋白的蛋白质纯度为65.7%。
2.3 米糠清蛋白、球蛋白的SDS-PAGE分析
由图1可以看出,米糠清蛋白主要亚基的分子质量分布于32、31、22、17、14 kDa,以及部分大于35 kDa的亚基归属谱带;米糠球蛋白主要亚基的分子质量分布于63、53、49、36、21 kDa。可见清蛋白和球蛋白均以中小分子质量的亚基为主。苏慧敏等[24]研究结论表明,米糠中清蛋白、球蛋白的分子质量范围分别为10~100、10~153 kDa;王艳等[25]提取制备的谷蛋白电泳分析结果表明,酸性亚基的分子质量为8.9~31.0 kDa,碱性亚基为21.1~23.9 kDa,且存在少量分子质量>58 kDa和<14 kDa的组分,并推测这些大分子是清蛋白和球蛋白,而小分子是醇溶蛋白;还有研究指出大米清蛋白分子质量为60 kDa,大米球蛋白12~20 kDa[26],与本实验结果一致。
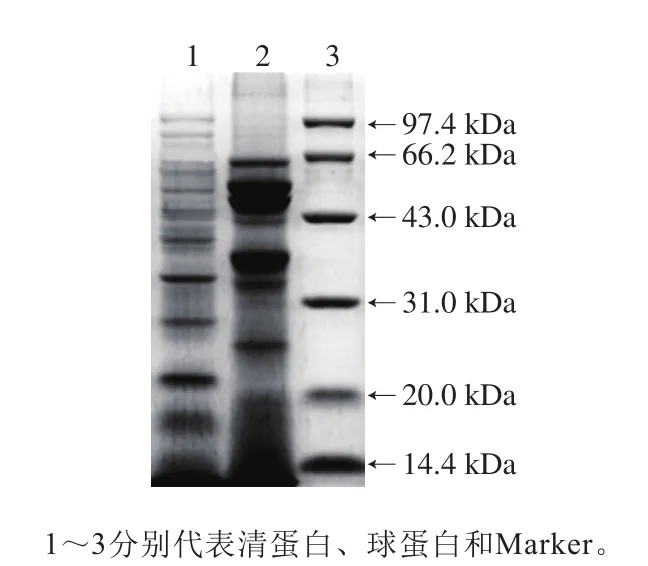
图1 米糠清蛋白和球蛋白的SDS-PAGE图谱Fig.1 SDS-PAGE profile of rice bran protein concentrate and its components
2.4 pH值对米糠清蛋白及球蛋白溶解性的影响
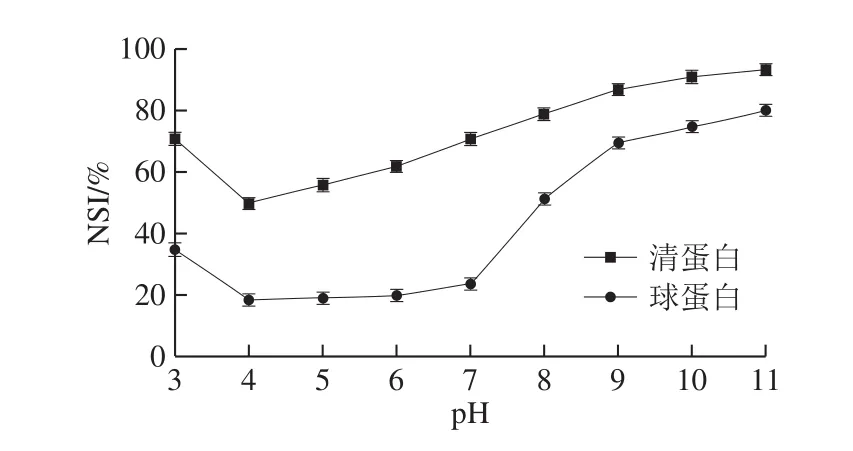
图2 pH值对米糠清蛋白及球蛋白溶解性的影响Fig.2 Effect of pH on solubility of rice bran albumin and globulin
如图2所示,随着pH值的增加,米糠清蛋白及球蛋白溶解性总体均呈现先下降后上升的趋势。当pH值为4时,清蛋白的溶解度最低,当pH值在4~5左右时,球蛋白的溶解度最低,此时2 种米糠蛋白均接近自身的等电点,从而使得溶解度变差。但可发现,米糠清蛋白在等电点附近的溶解性要显著高于米糠球蛋白的溶解性。这种溶解度的变化反映了酸碱处理对蛋白质二、三级构象的改变作用[27-28]。有研究指出,米糠蛋白溶解性较差的原因在于米糠蛋白结合了植酸、纤维素和其他成分[29],而碱性环境对植酸、纤维素等组分的部分降解作用可弱化其对米糠蛋白结合作用,增强米糠球蛋白及清蛋白的溶解性。
由于pH<6时,米糠清蛋白及球蛋白的溶解性都较差,因此在接下来的研究中,选取pH 7~11条件下溶解性相对较好的样品作为研究对象。
2.5 pH值对米糠球蛋白及清蛋白表面疏水性的影响
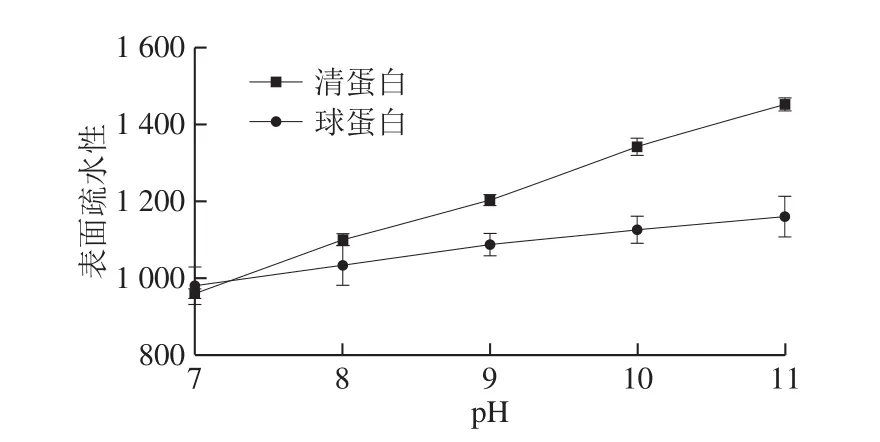
图3 pH值对米糠清蛋白及球蛋白表面疏水性的影响Fig.3 Effect of pH on surface hydrophobicity of rice bran albumin and globulin
由图3可知,米糠清蛋白与球蛋白的表面疏水值均随着pH值的增大呈上升趋势,且清蛋白表面疏水值要显著大于球蛋白的表面疏水值。在pH值为7~7.25之间时,米糠球蛋白的表面疏水值略大于清蛋白,随着pH值的增大,米糠清蛋白的表面疏水性逐渐大于米糠球蛋白。由此推测,米糠清蛋白在碱性条件下随着pH值增加而呈现的表面疏水性增大主要与清蛋白亚基解离有关。另外,碱性处理可以导致植酸的解离,使得蛋白分子结构更易展开,增加疏水性[30]。
2.6 pH值对米糠清蛋白及球蛋白粒径分布的影响
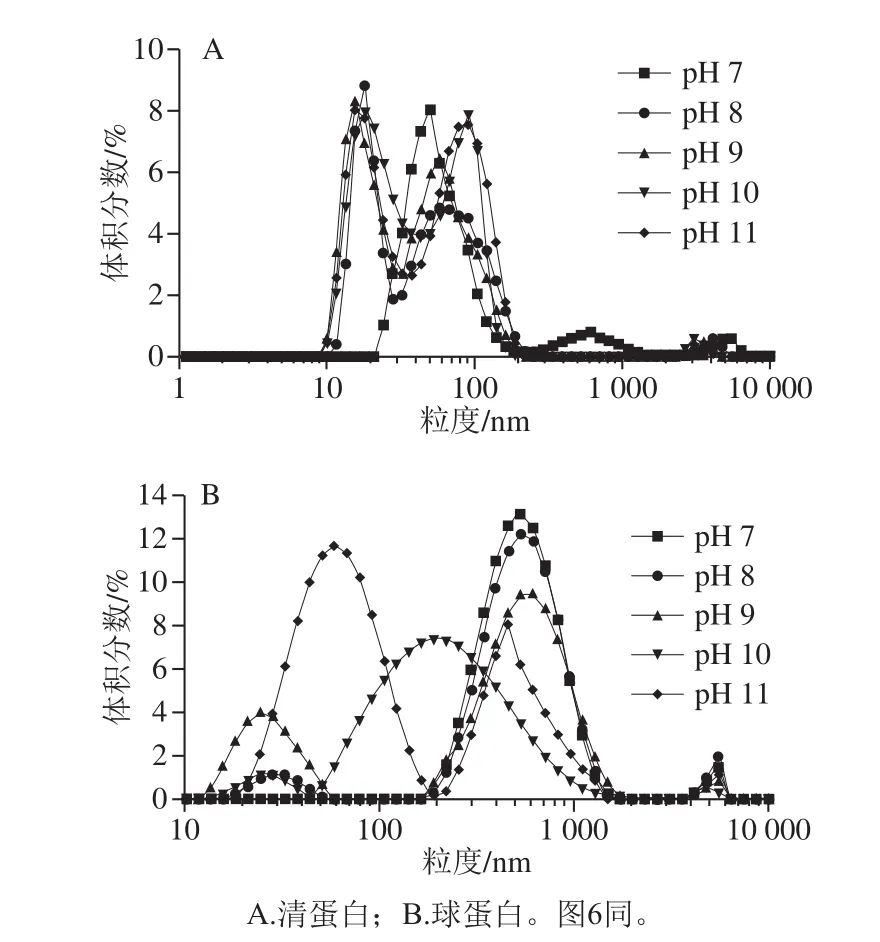
图4 pH值对米糠清蛋白及球蛋白粒径分布的影响Fig.4 Effect of pH on particle size distribution of rice bran albumin and globulin
由图4可知,米糠清蛋白的表观流体力学直径分布平均值为134.3 nm,米糠球蛋白表观流体力学直径分布平均值为484.7 nm,并整体呈单粒径峰分布。随着pH值的增加,米糠清蛋白和球蛋白的流体动力学直径分布均呈降低趋势,米糠清蛋白的主峰逐渐解离呈2 个并肩粒径峰,而球蛋白的主粒径峰逐渐减小,并同步形成了一个20~70 nm的粒径分布峰。这主要是由于碱性环境下米糠球蛋白及清蛋白均发生了亚基解离,并明显表现为大粒径聚集体粒子降解形成更多的小粒径粒子,故而随着pH值的增加米糠清蛋白及球蛋白呈降低的变化趋势。清蛋白5 000 nm的粒径峰向低粒径方向移动,而球蛋白在此位置的粒径峰并未发生明显变化。由此可以推测,米糠清蛋白归属于可溶性聚集体的大粒径峰部分解离为小粒径亚基,而球蛋白的可溶性聚集体解离现象并不显著。推测碱性条件下米糠清蛋白及球蛋白亚基解离是溶解性提高的原因之一。
2.7 pH值对米糠清蛋白及球蛋白Zeta电位的影响
在米糠蛋白分子侧链包含许多极性基团和非极性基团。在水溶液中,米糠蛋白的亲水基团暴露在蛋白表面,从而使蛋白质表面带有电荷。蛋白质表面氨基酸所带电荷的多少和电荷的正负性影响着蛋白质表面电位,从而影响了蛋白质溶液的Zeta电位值。一般来说,蛋白质表面带正电荷的氨基酸多于带负电荷的氨基酸时,蛋白质溶液Zeta电位为正值;反之,蛋白表面带负电荷的氨基酸多于带正电荷的氨基酸时,蛋白质溶液Zeta电位为负值[28]。由图5可知,随着pH值的增大,米糠球蛋白及清蛋白Zeta电位绝对值均呈增大的变化趋势。这是由于Zeta电位绝对值越大,表面所带的负电荷越多,更多的同性电荷间的相互排斥会使蛋白质溶液更稳定,蛋白的聚沉减少,蛋白质溶解度变大,因此米糠蛋白Zeta电位绝对值的增大是米糠蛋白溶解性增加的原因之一。

图5 pH值对米糠清蛋白及球蛋白Zeta电位的影响Fig.5 Effect of pH on zeta potential of rice bran albumin and globulin
2.8 pH值对米糠球蛋白及清蛋白结构影响的CD分析
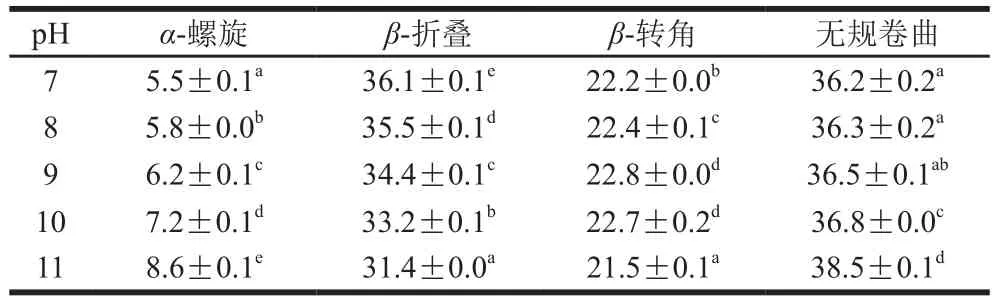
表2 pH值对米糠清蛋白二级结构影响Table 2 Effect of pH on secondary structures of rice bran albumin%
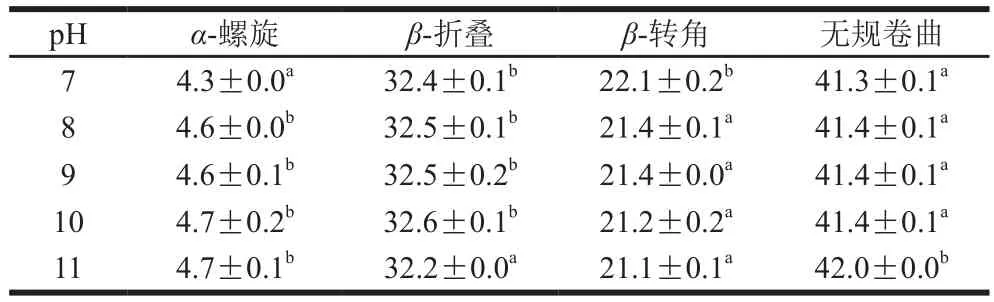
表3 pH值对米糠球蛋白二级结构影响Table 3 Effect of pH on secondary structures of rice bran globulin%
由表2、3可知,米糠清蛋白随着pH值升高,α-螺旋含量呈逐渐增大,β-折叠则逐渐降低,无规卷曲含量逐渐增大,而米糠球蛋白随着pH值的升高,其主要的二级结构单元含量未发生显著变化。球蛋白中多数二级结构为无规卷曲和分子内的大量反β-折叠,而清蛋白多为α-螺旋和分子内有序的β-折叠。可见米糠蛋白的二级结构与很多植物蛋白相似,即含有较少的α-螺旋,大量的β-折叠和无规卷曲[28]。
2.9 pH值对米糠球蛋白及清蛋白结构影响的拉曼光谱分析
谱线参比苯丙氨酸进行归一化处理,通过比对归一化谱线强度,分析确定对应基团的微环境及分子构象变化[31]。如图6所示,随着pH值增大,米糠球蛋白α-螺旋及β-转角含量均未变化,但却发生由β-折叠向无规卷曲的部分转变。由此可知米糠球蛋白在实验条件下二级结构较为稳定,而清蛋白二级结构单元发生了由β-折叠向α-螺旋与无规卷曲的转变。米糠清蛋白在拉曼光谱分析中尽管各结构单元组分含量与CD的结果有所出入,但变化规律均相似。
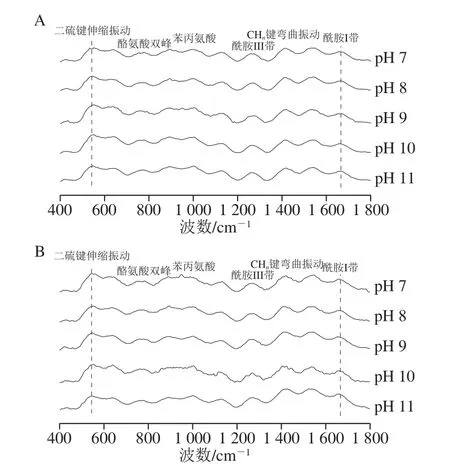
图6 pH值对米糠球蛋白及清蛋白结构影响的拉曼光谱分析Fig.6 Effect of pH on Raman spectra of rice bran albumin and globulin
2.10 pH值对主链结构影响的分析
米糠蛋白的二级结构组成主要由酰胺I带确定,酰胺I带拉曼特征峰位置为:α-螺旋1 645~1 660 cm-1;β-折叠1 665~1 680 cm-1;β-转角1 680~1 690 cm-1;无规卷曲1 660~1 670 cm-1[32-33]。由表4、5基于拉曼光谱酰胺I带拟合分析得出的米糠球蛋白及清蛋白二级结构结果可以看出,在所测范围内,随着pH值的增大,米糠球蛋白α-螺旋及β-转角含量均无显著变化(P>0.05),而β-折叠含量降低趋势,无规卷曲含量呈增大趋势。与CD的结果相比有所差异,这种构象的转变可能与碱性条件下亚基解离有关。
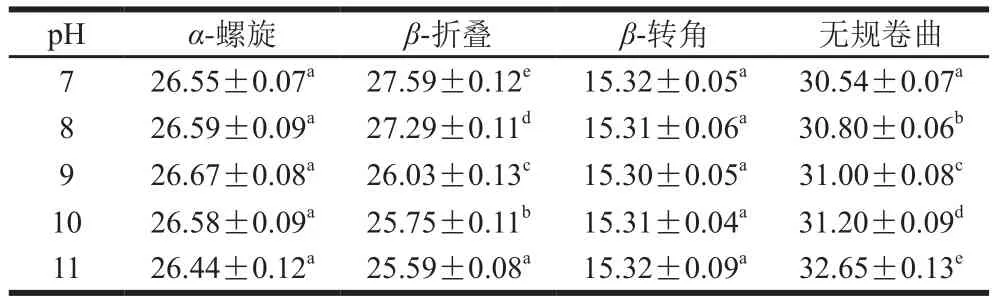
表4 利用酰胺I带拟合米糠清蛋白二级结构结果Table 4 Contents of secondary structures of rice bran albumin determined by amide I band curve fitting%
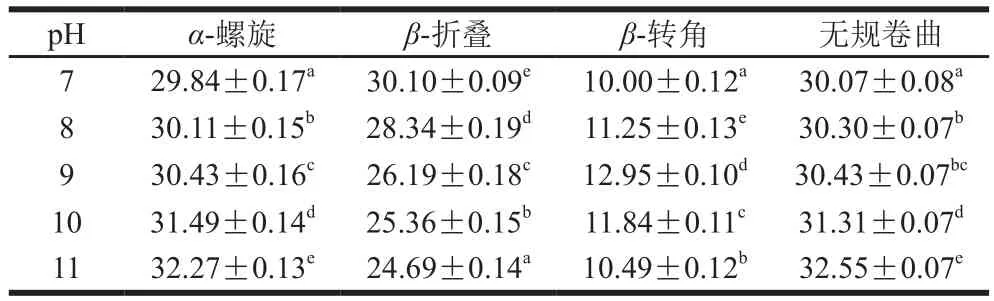
表5 利用酰胺I带拟合米糠球蛋白二级结构结果Table 5 Contents of secondary structures of rice bran globulin determined by amide I band curing fitting%
2.11 pH值对侧链结构影响的分析
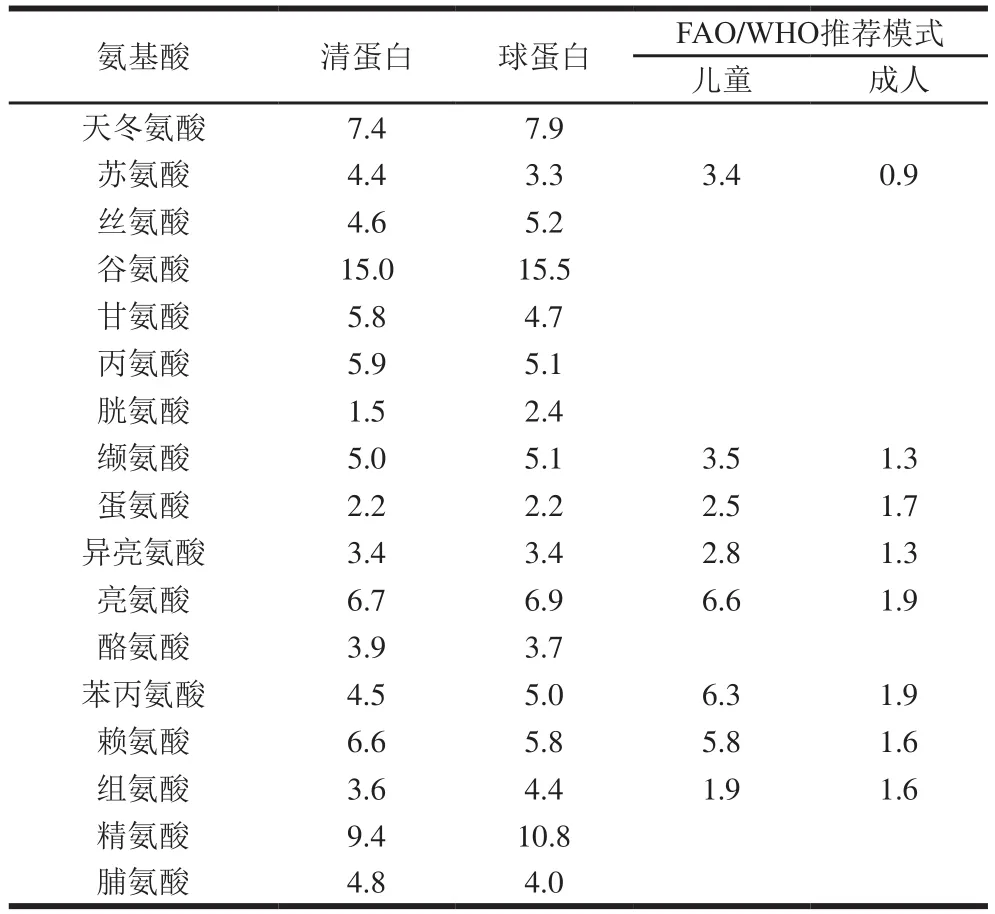
表6 米糠蛋白及4 种蛋白的氨基酸组成分析Table 6 Amide acid composition of rice bran albumin and globulin%
如表6所示,米糠清蛋白中的极性中性氨基酸相对含量最低(15.1%),其他类型的氨基酸含量适中;米糠球蛋白含有较高的碱性氨基酸(22.0%),非极性氨基酸相对含量最少(40.0%)。以上氨基酸分析结果与Hudsona[34]报道的结果较为相似。
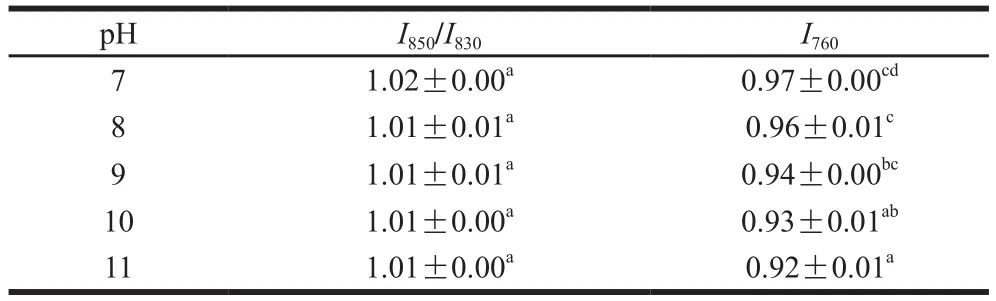
表7 pH值对米糠清蛋白侧链结构的影响Table 7 Effect of pH on side chains of rice bran albumin
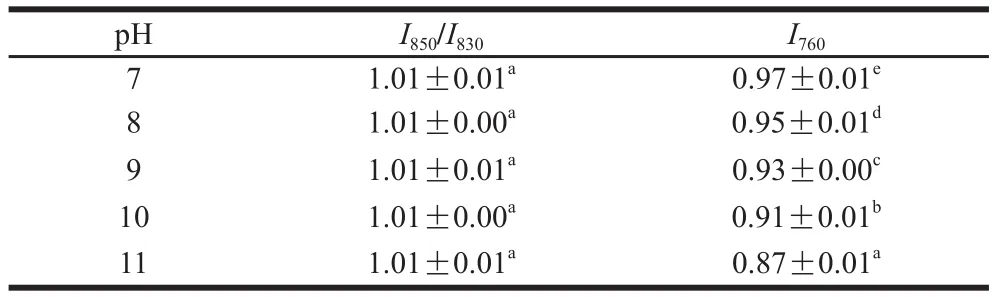
表8 pH值对米糠球蛋白侧链结构的影响Table 8 Effect of pH on side chains of rice bran globulin
由表7、8可知,在所测pH值条件下米糠球蛋白及清蛋白的酪氨酸残基趋向于“暴露式”,结合对残基暴露与包埋分子数看出,酪氨酸残基较多暴露于分子的表面,并作为氢键的供体或受体与水相互作用。随着pH值的增大,米糠清蛋白及球蛋白的酪氨酸费米共振线I850/I830及残基暴露与包埋分子数的比值均未发生显著变化(P>0.05)。
760 cm-1附近的拉曼谱带归属为色氨酸侧链,随着pH值的增大,米糠清蛋白和球蛋白色氨酸侧链归属谱带强度均呈下降趋势,Surewicz等[35]研究表明760 cm-1附近区域的拉曼峰强度降低与色氨酸残基由原本“包埋式”转变为“暴露式”有关。还有研究表明蛋白质变性造成的结构解折叠常会引起色氨酸残基的暴露,在拉曼谱图中表现为色氨酸谱带强度的降低[36-37]。结果表明,随着pH值的增大,米糠清蛋白及球蛋白结构趋于“暴露”态。说明米糠清蛋白及球蛋白随着pH值的增高亚基解离相伴形成的分子结构解折叠以及碱性pH值对稳定米糠蛋白内部结构作用力的弱化作用使得在碱性pH值诱导下色氨酸残基更趋于“暴露”态。
3 结 论
本研究通过蛋白质化学理论和谱学分析技术手段探究了pH值对米糠清蛋白及球蛋白结构、溶解性及表面疏水性的影响。随着pH值的增大,米糠清蛋白、球蛋白的流体动力学直径分布均呈降低趋势,米糠清蛋白归属于可溶性聚集体的大粒径峰部分解离为小粒径亚基,而球蛋白的可溶性聚集体解离现象不显著;米糠球蛋白、清蛋白Zeta电位绝对值均呈增大的趋势。进一步得出,pH值的改变影响着米糠清蛋白中α-螺旋、β-折叠以及无规卷曲结构的含量;米糠清蛋白及球蛋白的色氨酸残基趋近于“暴露”态。最终在碱性条件下,米糠球蛋白保留了大部分二级结构、亚基解离诱导的蛋白质三级结构解折叠小幅提高了其表面疏水性;而米糠清蛋白的二级结构单元的无序性转变、亚基解离诱导的蛋白结构解折叠却增大了其表面疏水性;亚基解离成小粒径以及碱性条件赋予米糠蛋白电荷增加了米糠清蛋白及球蛋白的溶解性。

