微波辅助同步提取苦荞中黄酮和多糖的工艺优化
张欢,杨芙莲,董丹
(陕西科技大学 食品与生物工程学院,西安 710021)
苦荞麦属于双子叶廖科(Polygonaceae)荞麦属(Fagopyrum),又名鞑靼荞麦、乌麦或三角麦,既是一种重要的小宗杂粮作物,又是药食两用植物[1-3]。苦荞麦的营养丰富,有碳水化合物、蛋白质、葡萄糖、植物固醇、多酚类、维生素、亚油酸、油酸、类胡萝卜素、矿物质等,均远远高于其他作物,其中黄酮类化合物、多糖和蛋白质是主要的生物活性成分,具有降血糖、抗肿瘤、抗氧化、抗病毒和预防心脑血管疾病等生物学功能[4-6],且提取出来的黄酮和多糖可广泛应用于调味食品、保健食品等食品加工中,广受人们的欢迎。目前苦荞中黄酮类化合物的提取方法有:热水提取、超声波提取、微波提取和酶解等方法[7-9];苦荞中多糖的提取方法有:热水提取、超声波辅助提取和碱水提取等方法[10-12],其提取物质较单一,对于两种物质的同步提取研究较少。因此,本文以苦荞为原料,采用微波辅助同步提取黄酮类化合物和多糖,为具有高营养附加值的苦荞产品研究提供了依据。
1 材料与方法
1.1 材料与试剂
苦荞麦:横山县陕北大地农业科技发展有限责任公司;芦丁标准品:源叶生物有限公司;亚硝酸钠(分析纯):天津市福晨化学试剂厂;氢氧化钠、硝酸铝、无水乙醇(分析纯):天津市天力化学试剂有限公司;葡萄糖(分析纯):天津市科密欧化学试剂有限公司;浓硫酸、苯酚(分析纯):天津市恒兴化学试剂制造有限公司。
1.2 仪器与设备
仪器与设备见表1。
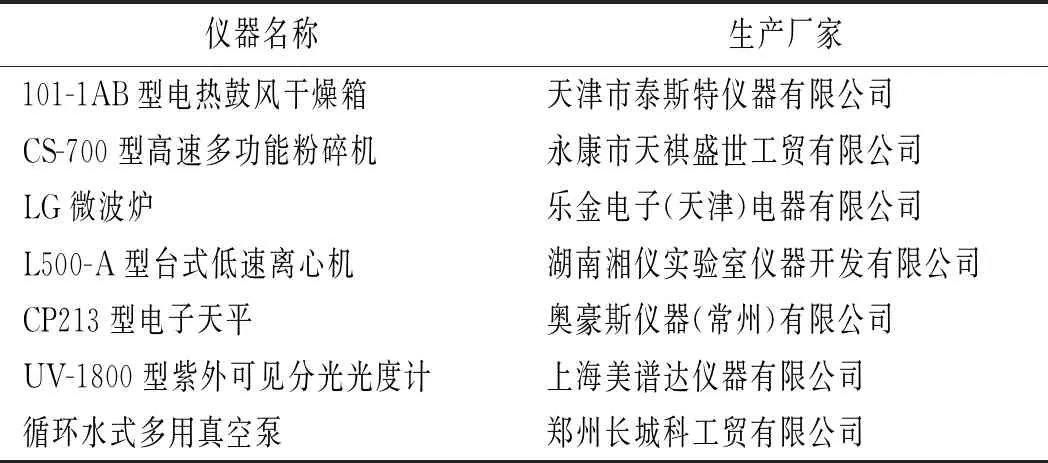
表1 仪器与设备表Table 1 Instrument and equipment
1.3 试验方法
1.3.1 工艺流程
苦荞→清洗→干燥→粉碎→过筛→烘烤→微波提取→离心→上清液→含黄酮和多糖的溶液。
1.3.2 操作要点
1.3.2.1 粉碎
将挑选无霉、完好的苦荞清洗,干燥后用粉碎机粉碎过筛。
1.3.2.2 烘烤
将经粉碎后的苦荞细粉鼓风干燥120 ℃烘烤30 min,可以增加苦荞茶的香气,但是要严格控制烘烤时间。
1.3.3 微波辅助苦荞总黄酮和多糖同步提取的单因素试验
1.3.3.1 液料比的选择
在粉碎粒度为100目,微波功率为360 W,时间为90 s时,考察液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1 (mL/g)时对苦荞总黄酮和多糖得率的影响。
1.3.3.2 粉碎粒度的选择
在液料比为20∶1 (mL/g),微波功率为360 W,时间为90 s时,考察粉碎粒度分别为40,60,80,100,120目时对苦荞总黄酮和多糖得率的影响。
1.3.3.3 微波功率的选择
在液料比为20∶1 (mL/g),粉碎粒度为100目,时间为90 s时,考察微波功率分别为180,360,540,720,900 W时对苦荞总黄酮和多糖得率的影响。
1.3.3.4 微波时间的选择
在液料比为20∶1 (mL/g),粉碎粒度为100目,微波功率为360 W时,考察时间分别为30,60,90,120,150 s时对苦荞总黄酮和多糖得率的影响。
1.3.4 微波辅助苦荞总黄酮和多糖同步提取的响应面试验
根据以上的单因素试验,采用Box-Behnken试验设计方法,选取粉碎粒度、微波功率、微波时间3个因素,以苦荞中黄酮和多糖得率为响应值,运用响应面分析法进行试验,以获取最佳工艺参数。数据处理采用Design-Expert 8统计软件。因素水平编码设计见表2。
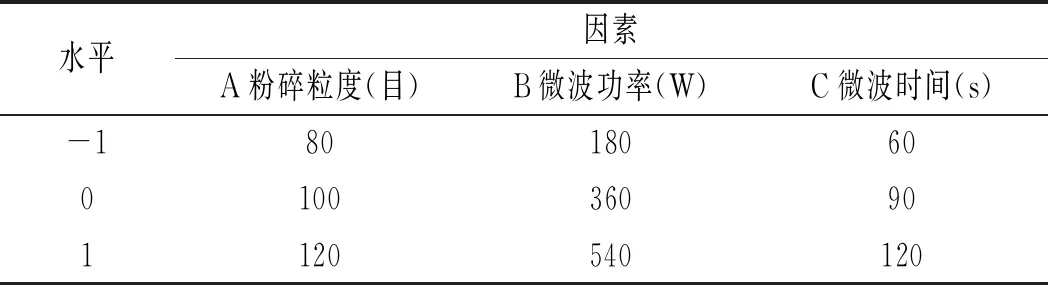
表2 响应面优化试验因素水平编码表
1.3.5 黄酮和多糖得率的测定
黄酮含量的测定采用NaNO2-Al(NO)3比色法;多糖的测定采用苯酚硫酸法。
1.3.6 待测样品的制备
称取一定量的苦荞粉,用蒸馏水溶解,置于微波炉中进行微波提取,离心得到上清液,于100 mL容量瓶定容得到黄酮待测液;另外将粗多糖的提取液加入4倍体积的无水乙醇,静置24 h,抽滤并收集沉淀,将沉淀于60 ℃烘干,得到苦荞粗多糖,溶解后测多糖得率。
2 结果
2.1 标准曲线的绘制
2.1.1 黄酮类化合物标准曲线的绘制
以吸光度为纵坐标,芦丁浓度为横坐标,绘制标准曲线(见图1),经最小二乘法可得到吸光度与芦丁浓度之间的回归方程为:A=12.585x-0.006,R2=0.9992,根据回归方程计算总黄酮得率。
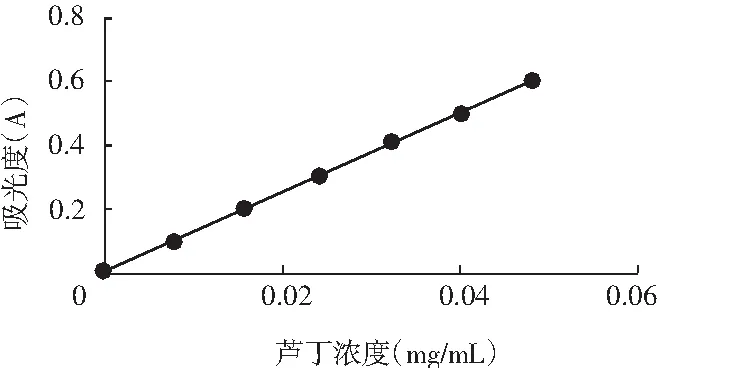
图1 黄酮类化合物的标准曲线图Fig.1 Standard curve of flavonoids
2.1.2 多糖标准曲线的绘制
以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线(见图2),经最小二乘法可得到吸光度与葡萄糖浓度之间的回归方程为:A=1.7257x+0.0347,R2=0.9995,根据回归方程计算多糖得率。

图2 多糖的标准曲线图Fig.2 Standard curve of polysaccharides
2.2 微波辅助苦荞中总黄酮和多糖同步提取条件的选择
2.2.1 单因素试验结果
2.2.1.1 液料比的选择

图3 液料比对总黄酮和多糖得率的影响Fig.3 Effect of liquid-to-solid ratio on the yield of total flavonoids and polysaccharides
由图3可知,随着液料比的不断增大,黄酮得率开始快速上升,当液料比高于20∶1 (mL/g)后,上升速度变缓,可能是因为液料比过大时,黄酮不能充分地溶解;多糖得率随着液料比的增大逐渐下降,在液料比为20∶1 (mL/g)之前,缓慢下降,之后快速下降,因为随着水添加量的增多,使得其中的其他杂质大量溶出,则多糖得率逐渐减小。随着液料比的增加,多糖得率下降,这可能是因为随着液料比的增大,黄酮的溶出量增加,部分多糖随之溶出,造成沉淀中多糖增加,致使多糖得率降低[13]。综合考虑,选择液料比为20∶1 (mL/g)较适宜。
2.2.1.2 粉碎粒度的选择

图4 粉碎粒度对总黄酮和多糖得率的影响Fig.4 Effect of crushing particle size on the yield of total flavonoids and polysaccharides
由图4可知,总黄酮和多糖得率均随着粉碎粒度的减小先增大后减小,当粉碎粒度大于100目时,苦荞中的黄酮和多糖得率逐渐增大;当粉碎粒度为100目时,黄酮和多糖的得率都达到最大值;粉碎粒度小于100目时,黄酮和多糖的得率均开始下降,其中黄酮下降较平缓。
2.2.1.3 微波功率的选择
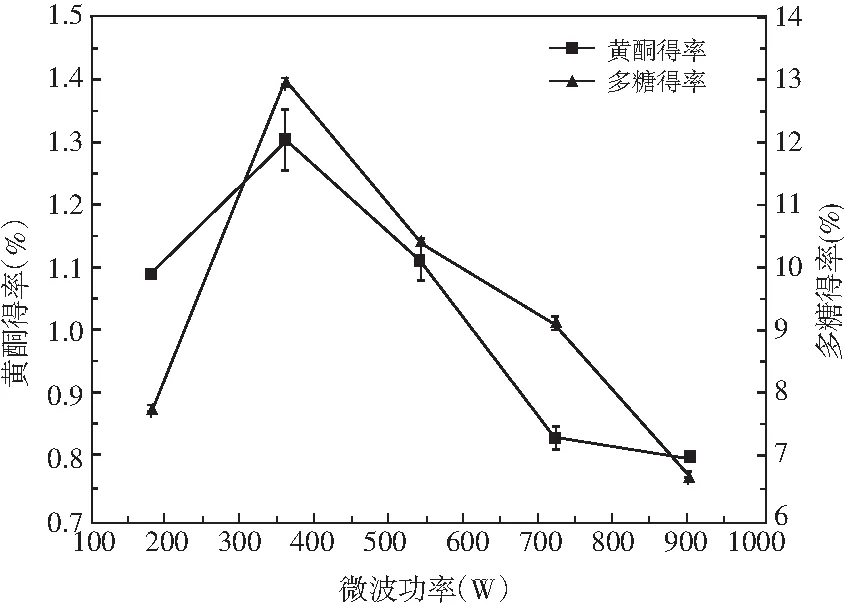
图5 微波功率对总黄酮和多糖得率的影响Fig.5 Effect of microwave power on the yield of total flavonoids and polysaccharides
由图5可知,苦荞黄酮和多糖得率在微波功率为360 W时达到最大值,其随着微波功率的增大呈先增大后减小的趋势。这可能是通过电磁波的辐射作用,使得物料的温度升高,且压力增大,进而使细胞破碎,其有效成分流出并溶解,但功率过大,微波作用会破坏细胞结构,使一些除黄酮和多糖之外的物质溶解度增大,且温度升高,导致部分多糖发生水解,进而使得黄酮和多糖的得率下降[14]。
2.2.1.4 微波时间的选择
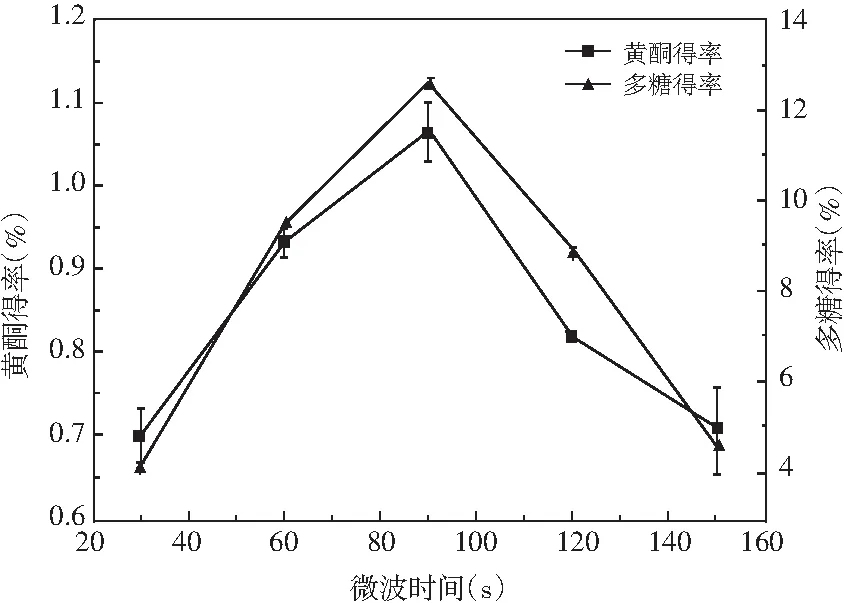
图6 时间对总黄酮和多糖得率的影响Fig.6 Effect of time on the yield of total flavonoids and polysaccharides
由图6可知,苦荞黄酮和多糖在微波时间为90 s时达到最大值,而后开始下降。这可能是因为一定时间的微波辐射导致细胞破碎,黄酮和多糖溶出量增大,但微波时间较长使得黄酮和多糖的稳定性降低,并且微波时间延长,热量聚集,破坏了黄酮和多糖的结构,进而其得率减小[15]。
2.2.2 响应曲面优化试验
在单因素试验基础上,确定液料比的条件,根据Box-Behnken试验设计原理,选择粉碎粒度(A)、微波功率(B)、时间(C)进行三因素三水平的响应面分析,确定总黄酮和多糖的最佳同步提取条件。试验设计及结果见表3。
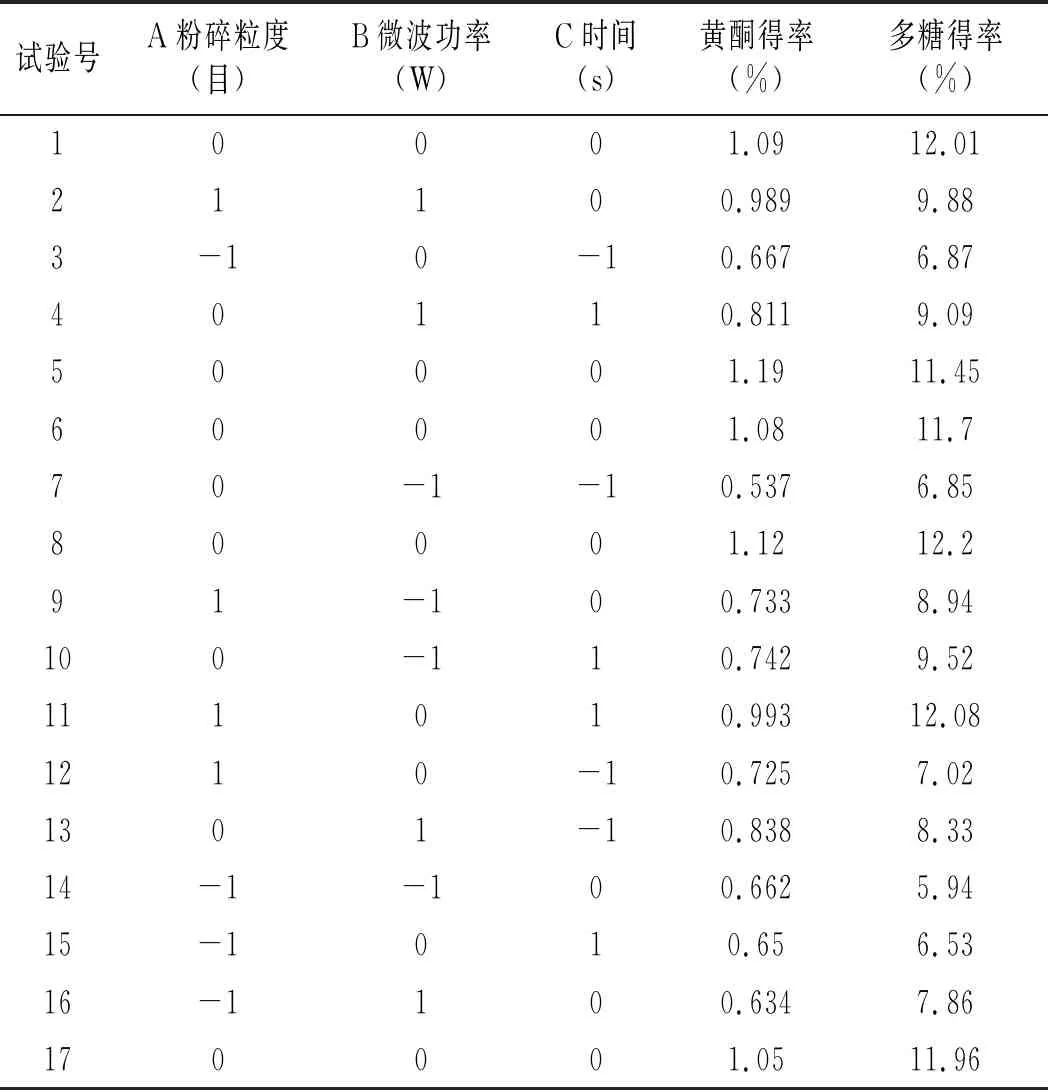
表3 苦荞黄酮得率响应面分析方案及结果Table 3 Response surface analysis scheme and results of tartary buckwheat flavonoids’ yield
2.2.3 建立模型方程与显著性检验
对该回归模型进行方差分析,结果见表4和表5。采用Design-Expert 8软件进行统计分析,得到苦荞黄酮和多糖得率二次多项回归方程:黄酮得率=1.11+0.10A+0.075B+0.054C+0.071AB+0.071AC-0.058BC-0.16A2-0.19B2-0.18C2;多糖得率=11.78+1.34A+0.49B+1.02C-0.25AB+1.35AC-0.48BC-2.02A2-1.70B2-1.73C2。
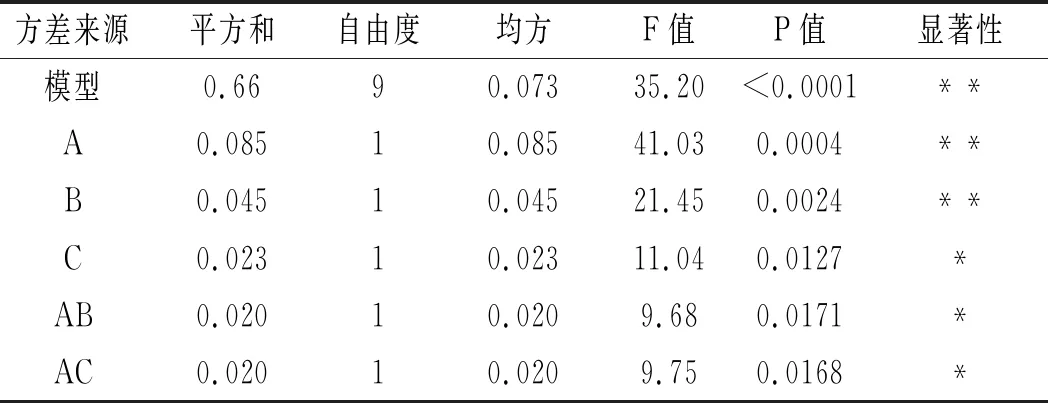
表4 黄酮得率回归模型方差分析Table 4 Variance analysis of regression model of flavonoids' yield
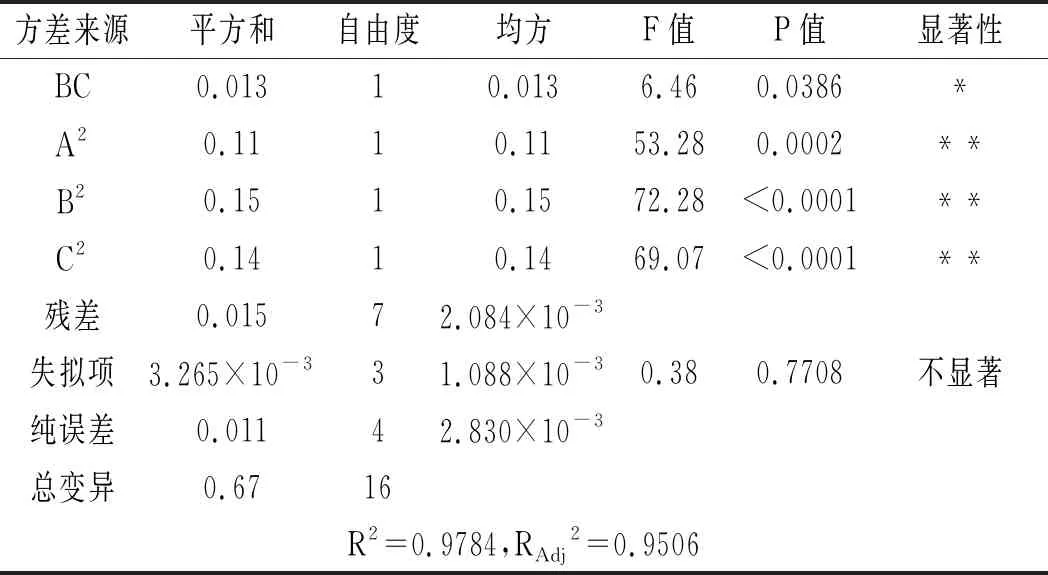
续 表

表5 多糖得率回归模型方差分析 Table 5 Variance analysis of regression model of polysaccharides’ yield
由回归模型的方差分析结果可知,粉碎粒度、微波功率和二次项A2、B2、C2对黄酮得率的影响极显著,时间和交互项AB、AC、BC对黄酮得率的影响显著;因素A,B,C和交互项AC以及二次项A2、B2、C2对多糖得率的影响极显著,交互项BC对多糖得率的影响显著,而交互项AB对多糖得率的影响不显著。
由表4和表5可知,黄酮和多糖的P值均<0.0001,表明响应面回归模型极显著,具有统计学意义。黄酮的信噪比Adeq Precision的值很高,为16.007,即该模型可用于预测;失拟项的F值为0.38,表明使用该方程进行拟合的效果较好;模型的校正确定系数R2=0.9784,说明预测值与试验值之间有较好的相关性,试验误差小。另外,多糖的信噪比Adeq Precision的值很高,为19.754,即该模型可用于预测;失拟项F值为2.60,表明使用该方程进行拟合的效果较好;模型的校正确定系数R2=0.9873,说明预测值与试验值之间有较好的相关性,试验误差小;因此,可用此模型对不同提取条件下苦荞总黄酮得率进行预测。
2.2.4 响应曲面分析
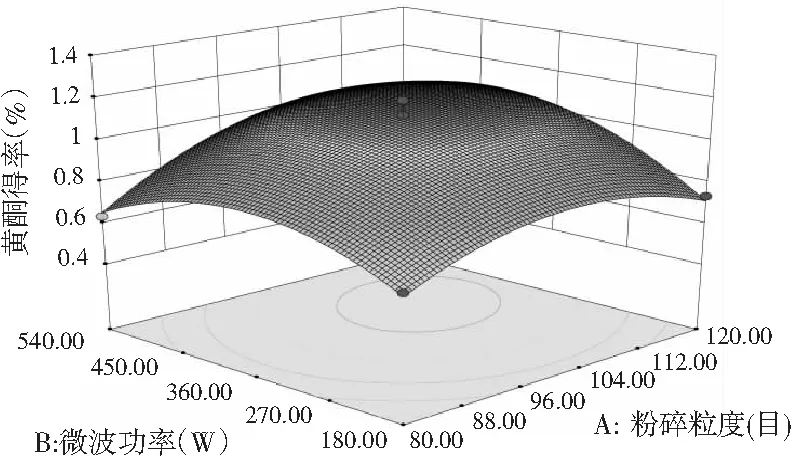

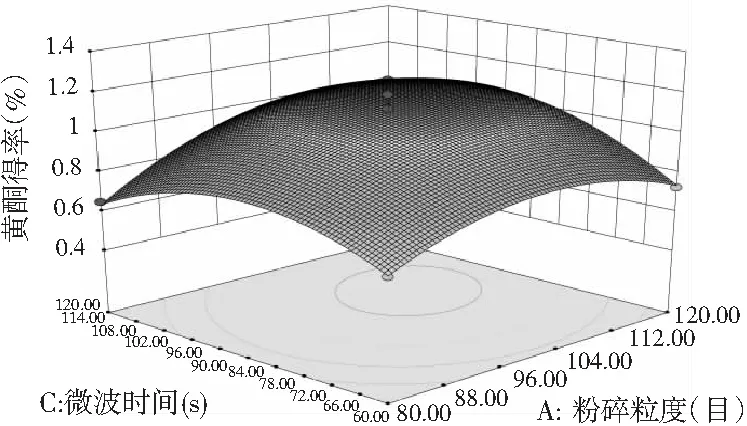
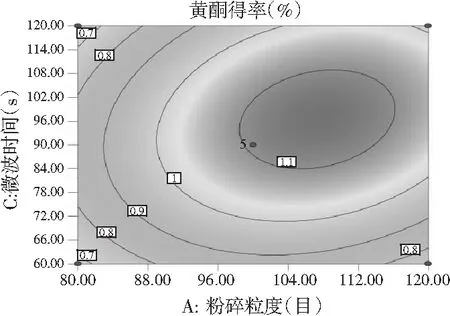
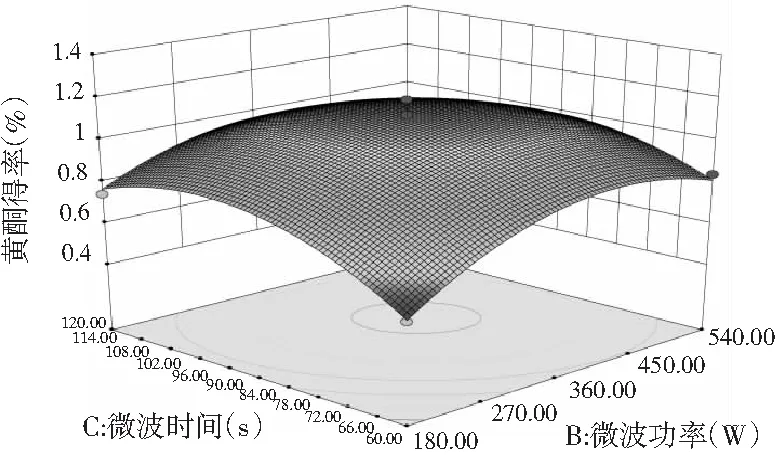

图7 各因素间交互作用对黄酮得率的响应面和等高线图Fig.7 Response surface and contour plots of interaction between factors on flavonoids’ yield
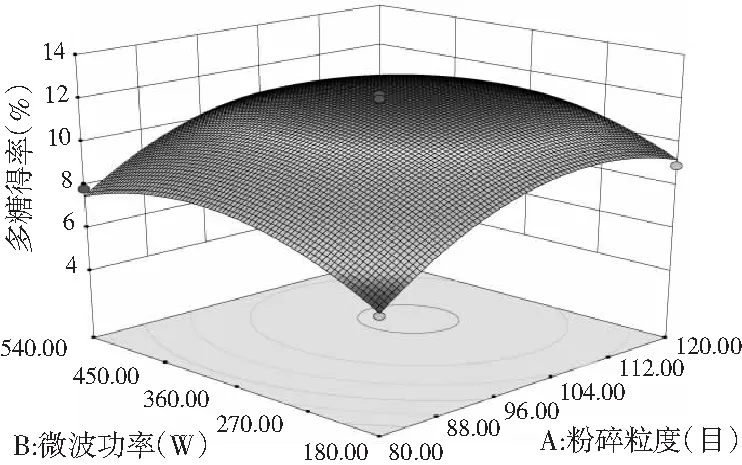
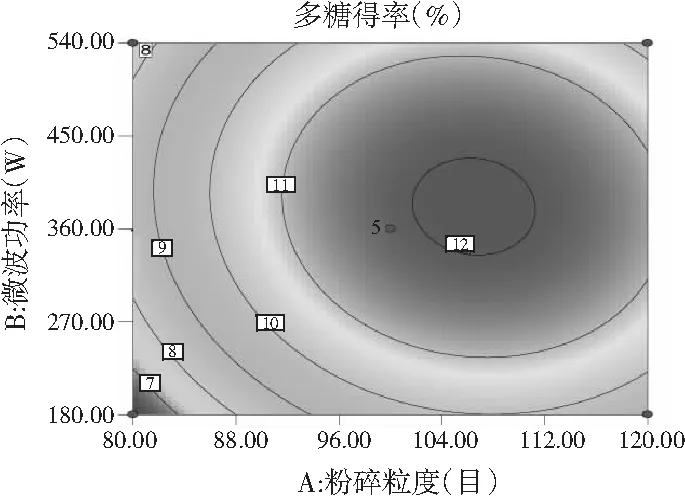
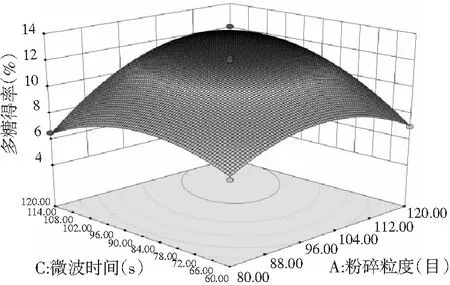
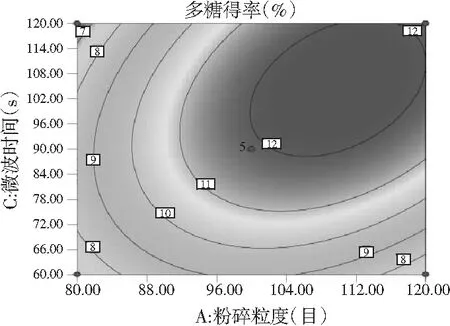

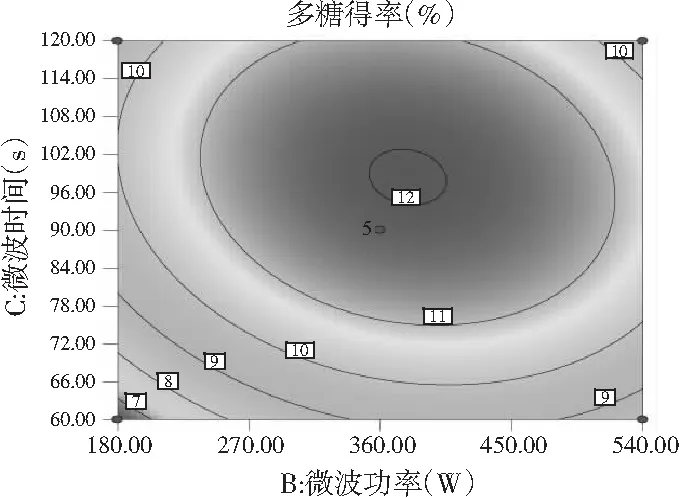
图8 各因素间交互作用对多糖得率的响应面图和等高线图Fig.8 Response surface and contour plots of interaction between factors on polysaccharides’ yield
由图7和图8可知,响应面图及等高线图比较直观地反映了各因素及两因素间的交互作用对黄酮和多糖得率的影响。由两两因素的交互作用的3D响应面图可知,各因素间的交互作用较强,其中曲线走势越陡峭表明对响应值的影响越显著;反之越平滑影响越小[16]。其中黄酮和多糖的响应面都有极值,也就是都有最高点。
通过Design-Expert 8软件进行统计分析,苦荞黄酮和多糖的最佳同步提取条件为:液料比20∶1 (mL/g)、粉碎粒度为108目、微波功率为388 W、时间为99 s,得到的预测黄酮得率为1.138%,多糖得率为12.4%。考虑实际操作,将试验条件修正为:液料比20∶1 (mL/g),粉碎粒度为100目,微波功率为360 W,时间为99 s。
2.2.5 苦荞黄酮和多糖最佳同步提取条件验证试验
在液料比20∶1 (mL/g)、粉碎粒度为100目,微波功率为360 W,时间为99 s的条件下,重复提取3次,测得黄酮得率为1.126%,多糖得率为12.38%,与预测值基本吻合,偏差较小。说明得到的回归模型与实际情况拟合很好,进一步验证了该模型的可行性。
3 结论
通过单因素和响应面分析,得到了苦荞黄酮和多糖的同步最佳提取工艺条件为:液料比20∶1 (mL/g)、粉碎粒度为100目、微波功率为360 W、时间99 s,苦荞黄酮得率为1.126%,多糖得率为12.38%。利用微波辅助同步提取苦荞黄酮和多糖,相对于热水提取来说,大大地缩短了提取时间,降低了提取成本,增加了经济效益,为进一步研究苦荞黄酮和多糖的同步提取提供了有益的参考。

