超声E成像在非酒精性脂肪性肝病诊断中的应用
张 冉, 徐异彩, 刘 琪, 师朝岭, 杨晓青*
(1. 石家庄市第一医院 超声科, 河北 石家庄 050011; 2. 石家庄市第四医院 医务处, 河北 石家庄 050000;3. 石家庄市第三医院 超声科, 河北 石家庄 050011)
脂肪肝是导致慢性肝脏疾病最为常见的原因,随着病情的不断发展,肝脏组织经历肝细胞单纯性脂肪变性、非酒精性脂肪肝性疾病(NAFLD)、肝纤维化,以及肝硬化。虽然非酒精性单纯性脂肪肝是相对良性的病变,可长时间内无进展,但是随着病情的发展,非酒精性单纯性脂肪肝可进展为非酒精性脂肪肝炎(NASH),最终可能恶化为肝硬化或肝细胞癌[1-3]。近年来,伴随着人口老龄化和人们生活质量的提高,我国NAFLD发病率快速上升[4,5]。由于NASH是病情进展为肝硬化及肝癌的独立危险因素,因此,对NAFLD的早期精确鉴别诊断具有十分重要的意义[6,7]。目前,临床主要采用肝活检区分非酒精性单纯性脂肪肝和非酒精性脂肪肝炎,并判断NAFLD的严重程度,虽然肝活检为NAFLD诊断的黄金标准,但因其有创及取样误差等缺点,临床应用受到一定限制,而超声E成像在肝脏弹性监测上具有良好的一致性,但是,国内通过超声E成像对NAFLD 所处的疾病阶段进行无创诊断,仍处于摸索阶段,未见详细报道。本研究旨在应用超声E成像技术对NAFLD进行检测,探讨超声E成像在NAFLD诊断中的价值。
1 方法
1.1 研究对象
选择2018年1月~2019年12月石家庄市第一医院消化科非酒精性脂肪肝患者120例,作为NAFLD组,另选择同期健康体检者50例,作为健康对照组。NAFLD组:男性77例、女性43例;最小年龄42岁,最大年龄67岁,平均(49.21±8.35)岁;合并糖尿病患者34例、合并高血压患者29例、合并高血脂患者32例;BMI范围26.06~31.86 kg/m2,平均(28.09±3.76)kg/m2。健康对照组:男性32例、女性18例;最小年龄43岁,最大年龄68岁,平均(47.32±9.15)岁;BMI范围25.04~33.25 kg/m2,平均(28.31±3.80)kg/m2。两组一般资料无显著性差异。
纳入标准:(1)符合NAFLD诊断标准[8],经肝活检确诊;(2)均接受超声E成像检查;(3)年龄≥18岁。排除标准:(1)酒精性肝病;(2)患有恶性肿瘤;(3)先天代谢性肝病者;(4)严重肾脏疾病;(5)男性每天饮酒含乙醇量超过20 g,女性每天饮酒含乙醇量超过10 g;(6)药物中毒性肝损伤;(7)1个月内使用过影响肝脏代谢的药物;(8)抗乙型肝炎病毒或抗丙性肝炎病毒表面抗原呈现阳性;(9)病毒性肝炎;(10)全胃肠外营养及自身免疫性肝损伤者。本研究经医院伦理委员会批准,所有患者均签署书面知情同意书。
1.2 超声E成像检查
由同一名经验丰富的医师对所有研究对象进行诊断。指导待检测者取仰卧位并合理暴露待诊断区域。采用AixPlorer 型 ShearWaveTM 实时剪切波弹性超声诊断仪(Supersonic Imagine,法国)线阵探头进行常规肝脏超声检查,避开囊性病灶区域及钙化区,选取实性病变区域,定位感兴趣区并行超声E成像检查。超声探头选择最合适的测量切面,调节取样框并选择,在取样框中选定ROI, 指导待检测者屏住呼吸保持静止,稳定图像5s并保存图片,对ROI内平均杨氏模量值进行记录。
1.3 肝组织学活检
经超声E成像进行病灶定位后,采用 STK一次性活检针(海派医药,中国)对NAFLD患者进行肝组织学活检。肝活检标本要求长度>15 mm , 至少包括5个汇区。
参考《2017年美国肝病学会非酒精性脂肪性肝病诊疗指导》[8]对脂肪肝病理组织学进行诊断,并依据中华医学会肝脏病学的《非酒精性脂肪性肝病诊疗指南》[9]分期标准,将肝组织病理标本分期为肝硬化、肝纤维化及肝炎。
1.4 统计学处理
2 结果
2.1 两组超声E成像检查杨氏模量值比较
NAFLD组患者超声E成像检查杨氏模量值高于健康对照组,差异有统计学意义(P<0.05)。见表1、图1。

表1 两组杨氏模量值比较
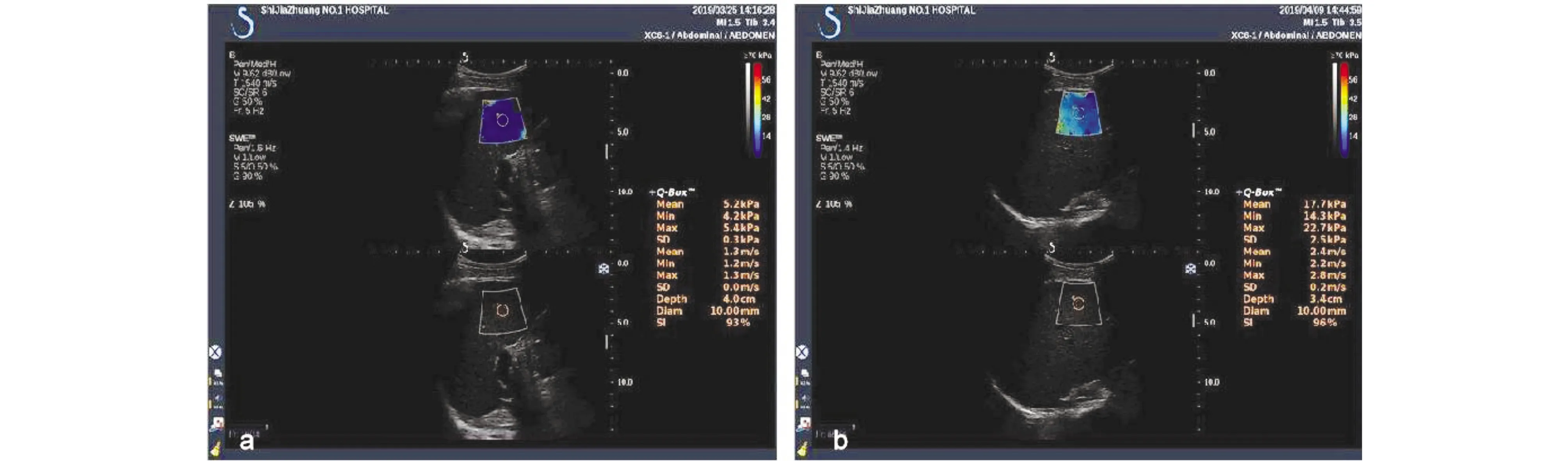
图1 a. 健康对照组,超声E成像检查杨氏模量值为5.2 kPa; b. NAFLD组,超声E成像检查杨氏模量值为17.7 kPa,NAFLD组超声E成像检查杨氏模量值更大,肝脏软硬程度更硬
2.2 超声E成像对NAFLD诊断价值
绘制ROC曲线,结果发现,杨氏模量值诊断NAFLD的曲线下面积为0.8633,诊断临界值为5.691 kPa,敏感度为79.17%,特异度为100%,约登指数为0.7917。见图2。

图2 超声E成像对NAFLD诊断价值
2.3 不同病理NAFLD患者杨氏模量值比较
病理为肝硬化、肝纤维化、肝炎NAFLD患者的杨氏模量值显著高于单纯脂肪肝患者,肝硬化、肝纤维化NAFLD患者杨氏模量值显著高于肝炎患者,肝硬化显著高于肝纤维化,差异均有统计学意义(P<0.05),见表2。

表2 不同病理NAFLD患者杨氏模量值比较
2.4 超声E成像对NAFLD不同病理诊断的价值分析
分别绘制杨氏模量值对肝硬化、肝纤维化、肝炎不同病理诊断的ROC曲线,见图3~图5,诊断的临界值、敏感度、特异度和约登指数和曲线下面积见表3。

表3 超声E成像对NAFLD不同病理诊断的价值分析
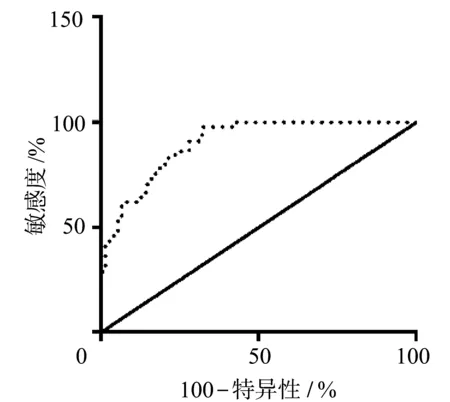
图3 超声E成像对病理为肝硬化NAFLD患者的诊断

图4 超声E成像对病理为肝纤维化NAFLD患者的诊断

图5 超声E成像对病理为肝炎NAFLD患者的诊断
3 讨论
脂肪肝是指肝细胞内的脂肪异常蓄积,NAFLD 可以从简单的脂肪变性到非酒精性脂肪性肝炎,同时伴随纤维化和不可逆性肝硬化[8-10],其中NASH是NAFLD病程发展中的关键环节,只有当NAFLD患者进展为NASH,才可能发展为肝硬化甚至肝癌,因此,及早进行准确诊断,区分出非酒精性脂肪性肝炎和非酒精性单纯性脂肪肝,具有十分重要的意义[10-13]。
目前,临床往往采用受控衰减参数(CAP)、肝组织活检、计算机断层摄影术(CT)、磁共振成像(MRI),以及多普勒超声进行脂肪肝的诊断。虽然CAP相对于传统超声检查易于执行,操作简化,瞬时结果,但易受BMI及皮肤到肝包膜距离等因素的影响,当BMI>35 kg/m2,CAP的四分位间距≥45 dB/m,或皮肤至肝包膜距离>30 mm时,CAP 对NAFLD诊断的准确性显著下降,而CT检查的辐射及费用昂贵等缺点限制其临床应用[14,15]。肝组织活检虽然为NAFLD诊断的黄金标准,但是存在侵袭性和取材误差,磁共振检查费用较为昂贵难以普及,而最为广泛应用的多普勒超声技术,其特异性和敏感性尚不能满足临床要求,此外,准确分析检测结果对操作者要求较高[16,17],因此,对NAFLD的无创精准诊断进行深入研究非常重要。
超声E成像技术又称超声实时剪切波弹性成像,是近年来新发展的一种临床超声弹性成像技术,通过对设定的测量区域内肝脏组织弹性模量值进行精确定量,同时以二维影像为基础进行弹性成像,可用于定量评价组织的软硬程度[18,19]。目前,临床已经广泛采用超声E成像技术诊断肝脏弥漫性病变,也可用于定量评价肝脏弥漫性病变[20,21]。微观层面上,细胞内的分子微细结构、胞质和细胞间隙内胶原蛋白的含量决定肝脏组织的弹性模量值,随着肝脏细胞的损伤、凋亡、自噬,肝脏组织内脂肪细胞缓慢变性和坏死,纤维结缔组织逐渐增生,发生不可逆的肝纤维化[22,23],而肝组织的弹性变化可由超声E成像技术检测,并由肝脏弹性值反映,因此,本研究应用超声E成像技术检测肝组织弹性值,对NAFLD 的病变程度进行评估,结果表明,NAFLD组杨氏模量值显著高于健康对照组,且随着病理分期的加重,杨氏模量值逐渐升高,可能是随着NAFLD恶化为肝纤维化时,肝脏组织内脂肪细胞外基质沉积逐渐增加,胶原含量缓慢升高,导致肝组织逐渐变硬,最终反应为肝组织弹性值的变化,而其变化程度与肝脏组织内脂肪细胞外基质沉积和胶原蛋白含量密切相关[24]。
本研究ROC曲线分析杨氏模量值用于NAFLD诊断,结果显示,杨氏模量值诊断NAFLD的敏感度为79.17%,特异度为100%,其中,对肝纤维化患者鉴别诊断敏感度为100%,对肝炎患者鉴别诊断的特异度为100%,证实了超声E成像对NAFLD早期诊断的精准性,在一定程度上证实了超声E成像用于NAFLD早期诊断的潜在价值,为临床NAFLD的无创精准诊断提供了新的方向。但是,由于肝脏脂肪组织对低频超声波及剪切波具有强烈的衰减作用,导致本研究中有两例健康体检者因衰减较严重,致使其弹性值测量结果存在一定误差,相信随着超声E成像测量准确度的提高,超声E成像技术在不同程度非酒精性脂肪肝的鉴别诊断等方面将展现更重要的作用。

