19F磁共振成像造影剂研究进展
孟凡强, 刘 燕, 吴勇杰, 陶 可, 孙 康
(上海交通大学 材料科学与工程学院 金属基复合材料国家重点实验室, 上海 200240)
作为一种具有高分辨率、高灵敏度、无组织损伤且能深层穿透的诊断方法,磁共振成像(magnetic relaxation imaging,MRI)被广泛地应用于医学研究领域[1-3]。1973年Lauterbur[4]首次提出将氢原子用于磁共振成像,其原理是施加脉冲磁场扰乱已经在磁场中达到平衡的氢原子,利用撤销脉冲磁场后氢原子恢复到基态的差异产生影像信号。目前临床及医学研究中使用的核磁共振造影方法主要是1H MRI。1H MRI利用组织中氢原子的不同弛豫特性来提供具有空间分辨率和软组织对比度的生理学和解剖学信息[5-9],同时引入的对比剂(contrast agent,CA)能够局部改变氢质子的弛豫使影像信号增强,从而进一步提高1H MRI的分辨率[1]。但由于生物体内的含水量高(>60%),组织内部及不同组织间的磁共振影像信号容易相互干扰,引起高的背景噪声,降低影像的分辨率。此外,近年来1H MRI对比剂的安全性问题也引起广泛的关注。研究发现1H MRI对比剂会在体内残余并积累,尤其是反复使用对比剂后,MRI或其他影像方法可以直接检测到对比剂在人体部位如大脑的齿状核和苍白球部位[10]的残余。内源性1H MRI背景噪声和对比剂的安全性问题促进了非氢核核磁影像技术的发展,其中19F MRI因其特点引起广泛关注。
19F具有和1H相似的核磁共振谱线(nuclear magnetic relaxation, NMR)[11];19F自旋比为1/2;磁旋比与1H接近(19F: 40.08 MHz/T, 1H: 42.58 MHz/T);敏感度是1H的83%; 化学位移分布在较宽范围(> 350 ppm)[11];另外,19F在人体内的含量很少,而且主要被固定在固相的骨骼和牙齿中,使得其横向弛豫时间(或自旋-自旋弛豫时间,T2)非常短,信号远低于MRI仪器检测极限[12]。所以,内源的19F不会在成像过程中产生背景信号,使得19F MRI造影剂呈现“热点”性质(在磁共振影像中只有造影剂显影而呈现出一种亮点状态)[13]。
目前,19F磁共振造影技术已经被应用于各个研究领域,其中广泛使用的19F MRI造影剂主要是全氟化碳类(perfluorocarbons,PFCs)有机物,这类有机造影剂能够通过19F原子取代或支链化获得更高的19F原子载量和更合适的弛豫时间。近年来也有研究提出无机氟化物纳米粒子可以用作19F MRI造影剂[14]。本文主要介绍19F MRI造影剂的特点、研究进展和应用前景。
1 19F MRI造影剂研究进展
1.1 19F磁共振成像性能
19F MRI的成像机理和1H MRI相似,同样利用撤销脉冲磁场后原子恢复到基态过程中磁场的变化产生影像信号。在自旋回波序列中,19F MRI影像强度的公式见式(1)[15]。
(1)
其中,I是影像强度,N(F)是核磁成像仪器成像单元体素中含有氟原子的浓度,TR和TE是脉冲序列重复时间和回波时间,T1是自旋-晶格弛豫时间,T2是自旋-自旋弛豫时间。
为了提高MRI成像性能,19F MRI造影剂应该具有以下几个特点[8]:
(1) 高19F含量。
(2) 短T1和长T2。短的T1时间有助于19F MRI在单位时间内进行更多次的信号采集而增强信噪比;同时延长T2时间意味着减小偶极-偶极之间的相互作用,可以保证采集信号的强度[15,16]。
(3) 简单的19F NMR谱线、尽可能尖锐的单峰。单个19F NMR谱线峰可以避免出现化学位移伪影[17],同时NMR谱峰越尖锐,意味着T2时间可能越长[18]。
(4) 高生物相容性和稳定性。
(5) 尽可能简单的合成方法。
1.2 有机19F MRI造影剂
有机19F磁共振造影剂主要是全氟化碳类(PFCs)。全氟化碳是一类由19F原子全部或部分取代1H原子的有机物[12]。PFCs作为19F MRI造影剂有诸多优点:高的19F载量[12]、稳定的生物和化学性质[19]、较长的T2,有利于信号的采集和处理[20]。但大多数有机氟化物憎水,并且生物体内缺乏其降解相关的酶和通路,所以有机氟化物会在体内大量聚集[21]。目前使用最多的PFCs造影剂有三种:全氟辛基溴(perfluorooctyl bromide, PFOB)、全氟十五冠醚(perfluoro[15]-crown-[5]ether, PCE)和线性全氟聚醚(perfluoropolyethers, PEPEs)[21]。其中,PFOB和PCE分子量比较小。因其憎水特性,在应用PFCs造影剂时需要使用表面活性剂和先进的分散设备[22,23]将其分散在水系溶液中形成稳定的乳液(图1)[24]。
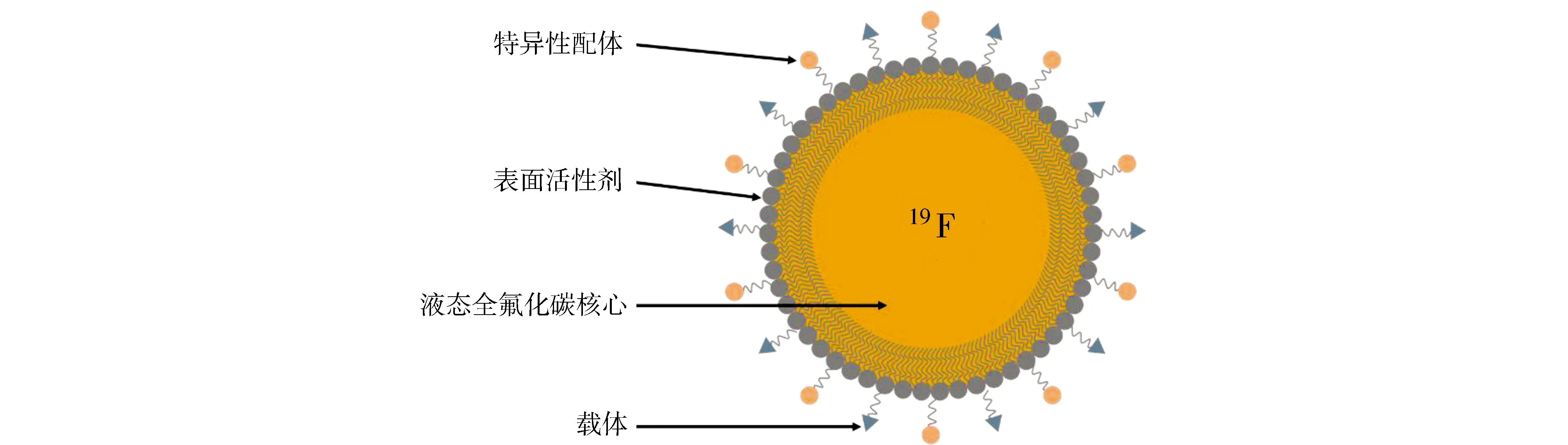
图1 乳液中全氟化碳纳米液滴的结构示意图单层表面活性剂将液态的全氟化碳包裹在纳米液滴核心中,常见的核心是PFOB、PCE等。核心中也可以包含其他造影剂或顺磁性化合物等。特异性的配体可以是抗体、酶等,用于体内成像时的特异性结合或体内特异性的检测。载体可以用来承载药物或其他功能性基团[24]
1.2.1小分子全氟化碳(PFOB,PCE)
全氟辛基溴(perfluorooctyl bromide, PFOB, 图2a)是含有8个碳原子、氢原子全部被氟原子取代的直链烷基溴化物。最早由Ratner等[25]提出将PFOB用于网状内皮系统的19F MRI。利用PFOB造影时,往往需要加入表面活性剂使其形成稳定的乳液。其中,表面活性剂可以与荧光剂、超声剂等复合实现“多模式”造影[26-29]。另外,PFOB也可以和功能性的高分子,例如聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]结合。PLGA包裹的PFCs具有更好的尺寸稳定性,并且能够提供更加稳定的表面便于与抗体结合[30]。在Pisani等[28]的研究中,PLGA包裹液态的PFOB可以制备出粒径不同、包裹厚度和半径比变化的微球(图2b),并实现体外超声(图2c)和19F MRI(图2d)双模态显影。近年来有研究人员提出用微囊化技术[31,32]将干细胞与全氟化碳结合,然后将被标记的细胞注入动物体内,利用氟化物的“热点”效应[33]研究细胞的移植率、分布、存活率等问题[34-36]。在最近Fu等[37]的研究中,研究人员通过微囊化技术将干细胞、PFOB以及海藻酸盐等相结合,用于解决干细胞移植率低等问题并追踪植入的细胞及其分布。其中PFOB标记的间充质干细胞19F载量提高了近10倍[35,36],并且即使在缺血性组织中也能够保持细胞活性;同时与未被PFOB标记的间充质干细胞相比,具有更高的体内活性。但由于PFOB化学结构中所有的19F原子处于非对称结构,在19F NMR上表现为多个磁共振谱线峰,而多个谱线峰在MRI图像编码和重构时容易相互干扰而增加化学位移伪影出现的可能[17],故其应用受到了一定的限制。

图2 a. PFOB结构示意图; b. PFOB微囊TEM照片; c. PFOB微囊注入小鼠体内后肝部超声影像; d. 粒径150 nm,浓度50 mg/mL的PFOB微囊水溶液19F MRI图像(左上角插入的是纯PFOB 19F MRI),标尺是1 cm[28]
相对于PFOB,环状全氟化碳类化合物具有更好的氟原子等价性、更为单一的核磁谱线,也被广泛应用于磁共振造影剂。其中,最常用的是全氟十五冠醚(perfluoro[15]-crown-[5]ether, PCE),见图3a[21]。PCE中20个氟原子处于化学结构对称的位置,使得PCE核磁共振谱线只有一个峰,极大程度地减小了化学位移伪影出现的可能,并提高了19F MRI灵敏度[8],因此被用于体内外的细胞示踪等研究。Nöth等[38]用19F MRI技术观察了PCE标记的巨噬细胞在过敏性脑脊髓炎侵袭等阶段中的表现。Kaneda等[24]分别用PFOB和PCE标记细胞以实现同时对不同细胞的体内示踪,这也是首次利用不同的氟化物同时标记细胞进行体内示踪的研究,实验证实了在没有使用转染试剂的条件下干细胞对两种PFCs的乳液具有高的吞噬率并保留了高的细胞活性和体内功能性,实现了体内细胞的标记示踪;并通过核磁共振波谱(magnetic resonance spectroscopy,MRS)进行了细胞量化。在最近的研究中,磁共振造影剂还被赋予“智能化”的功能。Guo等[39]将钆离子[Gd(Ⅲ)]和PCE用磷脂封装制备成用于检测磷脂酶活性的智能开关(图3b和c)。当Gd(Ⅲ)和PCE被封装在磷脂壳层内部时,Gd(Ⅲ)顺磁增强效应(顺磁性离子因其具有较大的电子磁矩而改变一定距离内与之接触的造影剂弛豫速率的现象)使得PCE磁共振影像信号快速衰减呈现“关”的状态;但当磷脂被周围环境中的磷脂酶分解后,Gd(Ⅲ)与PCE被释放出来,它们之间的距离变大,顺磁弛豫增强效果减弱,使得PCE重新具有磁共振影像信号呈现“开”的状态,由此可检测磷脂酶的活性(图3d)。

图3 a. PCE结构示意图; b. 智能磷脂酶19F MRI造影剂开关示意图; c. 磷脂包裹的PCE纳米球TEM照片; d. 不同浓度磷脂酶存在下的智能开关19F MRI[39]
除了PFOB 和PCE 以外,其他小分子全氟化碳也可作为磁共振影像造影剂,比如六氟苯(Hexafluo-robenzene)[40,41]、全氟萘烷(Perfluorodecalin)[42,43]和全氟壬烷(Perfluorononane)[44]等。但这些小分子氟化物本身的一些性质限制了它们在MRI造影剂中的应用,比如PFOB多个共振峰可能引起化学位移伪影;PCE难以改性修饰,如果采用共价修饰会破坏PCE的对称性,将产生多个共振峰;由于全氟化碳的疏水特性需使用表面活性剂而使得制备流程十分复杂;造影效果通常受到乳液不稳定性,如絮凝、聚结、纳米液滴的奥斯特瓦尔德熟化(一种分子扩散现象,较大颗粒吞噬较小颗粒而逐渐生长)等影响[1,22,23,45,46]。
1.2.2高分子和支链聚合物(PEPEs)
提高19F MRI灵敏度的方法之一是提高造影剂的氟含量,聚合线性氟化物是实现造影剂氟含量增加的最简单的选择。它们可以是单一聚合物或以全氟聚醚为基础衍生的多分散混合物[8]。高分子聚合物磁共振成像造影剂的代表是线性全氟聚醚(perfluoropolyethers, PFPEs),见图4a,其中所有的氢原子都被氟原子取代。这些化合物物理化学性质相似,即高度疏水、轻微疏油、高沸点、低表面张力、高分子量(> 1700 Da)、高氟原子密度等[8]。最早,Ahrens等[1]提出用PEPEs标记树突细胞进行体内细胞的示踪和量化。高分子全氟化碳分子链上有更多的结合位点,可以与其他功能性分子相结合用于多模式显影。Janjic等(图4b)[26]将PFPEs和荧光染料相结合,合成了高稳定、无毒双模式纳米乳剂,在不使用转染试剂的情况下能够有效地标记吞噬和非吞噬细胞,其中荧光基团的引入有助于鉴定和识别由于细胞凋亡、分化等原因造成的19F MRI信号损失,进一步提高了细胞体内示踪的准确性。Zhang等[47]以PFPEs为基,通过修饰亲水性基团、荧光染料和特异性的肽适体,制备了具有高19F MRI灵敏度的双模式造影剂(HBPFPE-apt,HBPFPE-non,见图5c),用于乳腺癌检测。研究证实了此种造影剂比以丙烯酸三氟乙酯为基的高分子造影剂具有更好的横向弛豫时间和磁共振影像灵敏度(图5d)。同时,特异性肽适体的修饰提高了乳腺癌细胞的靶向率,并缩短了体内循环的半衰期,有利于体内快速清除,降低了生物毒性。

图4 a. PFPEs结构示意图; b. 从左到右分别是荧光染料和PFPE双模式造影剂示意图、荧光标记细胞的共聚焦图像和体内1H/19F MRI[26]; c. HBPFPE-apt结构示意图; d. HBPFPE-apt和HBPFPE-non的荧光和19F MRI[47]
另外,可以采用超支链化方法提高磁共振成像造影剂中氟原子的含量。在Thurecht等[48]的研究中,通过可逆加成断裂链转移聚合反应引入功能性分子,并在水溶性条件下充分水合丙烯酸酯和极性重复单元,使化合物具有更高的19F含量和分子移动性。反应中单体的随机支化阻碍了氟化链段的聚集,同时掺入高浓度的氟化物单体。高氟原子含量和分子移动性使造影剂在10 min内有清晰的体内影像,这也是首个将可功能化制备的共聚物用于体内19F MRI的例子。另一个典型的超支链氟化物造影剂是由Jiang等[49]提出的19FIT(19F imaging tracer,见图片5a和5b),它有27个等效的氟原子,在核磁共振谱线上呈现单峰,并且具有短的纵向弛豫时间。超支链氟化物含有大量易于修饰的表面官能团,从而可以和功能性分子结合实现双模式或多模式显影[20,50-55]。Wang等[56]合成了一系列支链氟化物并结合荧光染料分子,实现双模式体内显影和定量分析。Chen等[2]通过“一步包封”的方法将氟化物连接在Cu1.75S纳米粒子上,同时结合了功能性分子和二氧化硅,实现了19F MRI、光热成像和光动力治疗相结合的多模成像和诊疗一体化设计。另外,也可以通过调节弛豫时间提高19F MRI灵敏度。Kislukhin等[18]将顺磁性钆离子、铁离子引入到PFPEs中,提高了纵向弛豫速率进而提高了磁共振成像的灵敏度。此研究表明铁离子结合的PFPEs纳米乳液具有低细胞毒性(<20%)和优异的MRI灵敏度;且其纵向弛豫时间可以通过改变铁离子的化学计量来调控,优化后的造影剂弛豫时间能够降低一个数量级,灵敏度可以提高3~5倍。
近年来有研究将医用体内支架材料进行氟化处理,用于检测支架在体内的存在状态。Lammers等[57]首次将热塑性聚氨酯无定形氟化聚合物(thermoplastic polyurethane, 19F-TPU)用于制备组织工程中的血管移植物(图5c,5d),其19F MRI证明了19F-TPU具有作为可成像血管移植物材料和组织工程治疗基础材料的潜能。另外,Fu等[58]通过调节氟化物链段的移动性将造影剂制备成对活性氧敏感的“开关”,用于改善具有高水平活性氧疾病的诊断和治疗精确度。在一项相似的研究中,Huang等[59]利用巯基和氟化物的相互作用,使造影剂中的氟化物分子移动性呈现不一样的状态,实现“开关”功能。该纳米探针对生物硫醇具有高灵敏度和选择性,可实现谷胱甘肽的细胞内和瘤内成像。

图5 a. 19FIT结构示意图; b. 小鼠体内1H/19F MRI叠加影像[49]; c. 19F-TPU结构示意图;d. 19F-TPU 体外1H MRI和19F MRI以及1H/19F MRI[57]
1.3 无机氟化物造影剂
自19F MRI技术被提出以来,19F MRI造影剂主要是有机物,无机物造影剂研究处于空白状态。原因在于结晶度高的无机化合物中氟原子被规律地固定在晶格中,使横向弛豫时间T2很短,传统的检测仪器无法检测到[59,60]。但结合高性能19F MRI造影剂的特点[8],无机物可控的化学成分、大小、形状、表面性质和物理特性、简单的结构、高的对称性[61,62]等特点都有利于高性能19F MRI成像。2018年Ashur等[14]将UTE(ultrashort echo time,超短回波时间,核磁影像技术中一种信号采集方法)技术用于CaF2纳米粒子19F MRI,该技术极大缩短了核磁影像仪器信号采集中的回波时间,减少了造影剂T2时间短对信号采集的影响,成功观察到无机氟化物造影剂在体内外的影像。
Ashur等[14]将无机氟化钙纳米粒子用于19F MRI,并通过对比不同晶格结构纳米粒子的19F MRI,提出面心立方的晶格结构是无机纳米粒子具备19F MRI造影能力的关键性因素。另外,研究测得柠檬酸包覆的CaF2纳米粒子(CFP)具有较长的纵向弛豫时间(T1=9.74 s)和短的横向弛豫时间(T2=2.9 ms)。实验采用较小的翻转角,并使用UTE技术减小T1较长和T2较短对成像的不利影响,成功获得了荧光素修饰的CFP在体内的19F MRI影像(图6e),证明了CFP用于体内19F MRI造影剂的潜力。
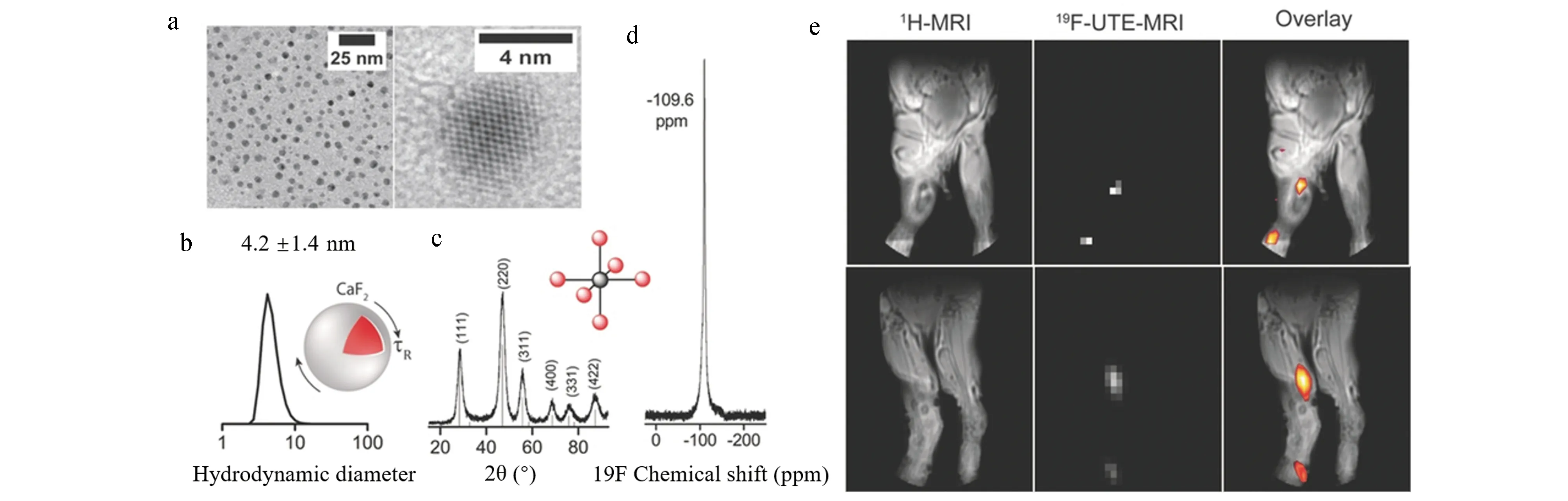
图6 a. CF-Cit 透射电镜照片; b. CF-Cit流体动力学直径; c. CF-Cit X射线衍射图谱和以Ca2+为中心的配位示意图(Ca2+为灰色,F-为红色); d. CF-Cit 19F NMR; e. 荧光素修饰CFP小鼠体内1H MRI和19F MRI[14]
总之,不同的19F MRI造影剂因具有不同的特点(表1)[8,14,63]而被逐渐应用于解决不同的医学研究问题。

表1 19F MRI造影剂对比
2 结论与展望
近年来,研究人员对于19F MRI广泛关注,发现了19F MRI在体内外非损可视化显影中的巨大潜力。与传统的1H MRI相比,无背景噪声的优点使得19F MRI成为生物医学领域的研究热点。19F MRI造影剂可与靶向剂结合,实现体内特异性显影;并可以通过结合1H MRI,精确地显示其解剖学位置;或通过修饰其他造影剂实现多模式显影。经过多年的研究、开发和改良,有机氟化物造影剂已经被用于解决医学研究中体内外细胞的显影、追踪、量化等关键性问题。无机氟化物造影剂的出现进一步挖掘了19F MRI的潜能,拓展了19F MRI造影剂的应用前景。19F MRI也存在一些问题,比如灵敏度仍需进一步提升,因此需要进一步开发新一代造影剂或优化现有造影剂,比如利用超支链化反应进一步提高有机氟化物中19F等价性和19F含量以增加影像信噪比;提高有机物中原子的移动性,增加影像信噪比;将顺磁离子修饰在无机晶体造影剂表面或内部,利用顺磁增强弛豫效应缩短自旋-晶格弛豫时间,以增加影像信噪比;或将无机氟化物和功能性分子结合,实现19F MRI造影剂的多功能化以及多模式造影等。可以期待,随着对19F MRI造影技术和造影剂更加深入的了解,19F MRI将会被应用于更加广泛的领域。

