乳腺X线摄影及动态增强MRI对BI-RADS 4-5微钙化病变的诊断价值
徐金亮, 滕心瑞*, 刘宝良, 马 捷
(1. 深圳市龙岗区第三人民医院, 广东 深圳 518115; 2. 深圳市人民医院, 广东 深圳 518020)
乳腺癌是女性最常见的恶性肿瘤,发病率逐年上升,发病年龄趋于年轻化,严重影响女性健康。影像学检查可以早于临床检出病变,其中乳腺X线摄影(mammography,MG)对钙化最为敏感,钙化是乳腺X线摄影最常见征象,它可单独或伴随其它征象出现。约40%的乳腺癌在MG上伴有钙化[1],约50%的非肿块型乳腺疾病都伴有钙化[2]。80%乳腺导管原位癌(breast ductal carcinomainsitu, DCIS)仅表现为MG上的微钙化,因此,微钙化在MG上是一个重要的影像学标志[1,3]。 动态增强MRI(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)对软组织具有良好的分辨率,有报道DCE-MRI[4,5]对导管原位癌的诊断检出率及诊断准确性均高于其他影像学方法,但MRI不能检出微钙化。本文探讨DCE-MRI对乳腺影像报告及数据系统(BI-RADS)评估需要组织学诊断的仅表现为微钙化的病变的诊断价值,并对比MG检查,旨在提高对乳腺病变诊断的准确性,减少不必要的活检及手术。
1 资料与方法
1.1 患者资料
收集深圳市龙岗区第三人民医院2014年7月~2018年10月符合以下标准的患者资料,纳入标准:(1)乳腺X线摄影评估为BI-RADS 4A、4B、4C、5的仅表现为微钙化病变;影像资料完整(包括所有患者的MG图像与52组DCE-MRI图像);(2)所有患者均进行穿刺活检或放置钢丝引导手术切检,获得组织学诊断,病理资料完整;(3)单侧乳腺可疑微钙化病变患者。排除标准:(1)图像不清晰;(2)乳腺X线摄影BI-RADS评估分类0类病例;(3)隆胸后与假体重叠,难以区分钙化来源的患者;(4)肿块及结构扭曲征像。最终,298例病例298个微钙化病变纳入本次回顾性分析研究中,其中52例在MG检查后一周内行DCE-MRI检查。患者年龄23~72岁,中位年龄45岁,平均44.58岁。
1.2 检查方法
MG检查:采用德国Siemens Mammomat Inspiration数字乳腺机X射线系统,投照体位包括双侧乳腺首尾位(CC)及内外斜位(MLO)摄片,部分对微钙化加照局部点压放大摄影。工作站:ASG-340V2H 读片报告台,Version 1.6。显示器:Siemens高分辨率专业图像显示器。
MRI检查:采用 SIEMENS Skyra 3.0T 超导核磁共振扫描仪,应用 4 通道乳腺。扫描序列包括常规MRI平扫(T1WI、T2WI、T2WI压脂)、弥散加权成像(DWI)、动态增强磁共振成像。①DWI采用单次激发自旋回波平面成像(SE-EPI)序列,b值分别取 50、400、800 s/mm2,扫描时间3 min 54 s)。②DCE-MRI采用3D扰相梯度回波FLASH序列,共扫描6次,每次扫描时间1 min左右。注射对比剂前先扫描蒙片(第一次扫描),嘱患者保持原体位不变,扫描蒙片后,中间暂停30 s,暂停开始后立即采用高压注射器团注造影剂(Gd-DTPA),30 s暂停结束后,连续扫描5次,每次3D动态序列扫描时间为1 min 1 s,动态增强总时间为6 min 33 s。
1.3 图像分析
MG图像及MRI图像由2名从事乳腺影像诊断的放射科医师(工作年限分别6年和15年)在不知道病理诊断结果下独立阅片、分析,意见不一致时请1名具有30年乳腺影像诊断经验的放射科医师判定达成一致意见。根据第5版乳腺影像报告及数据系统(BI-RADS)评估病变。MRI将BI-RADS 1~3类归为阴性,BI-RADS 4~5类(建议组织学诊断)为阳性,MG检查因BI-RADS 4A恶性可能较低,影像学分析将其归为阴性,BI-RADS 4B、4C、5归为阳性。分别将影像学评估与病理组织学进行对照分析。
1.4 统计学方法
采用SPSS 21.0统计软件对数据进行统计分析,采用四格表的统计学方法,分别计算灵敏度、特异度、阳性预测值、阴性预测值、似然比及准确性,进行比较。运用并联方法计算MG及DCE-MRI的灵敏度、特异度及准确性。
2 结果
2.1 病理结果
本研究的298个微钙化病变中,良性238例(乳腺腺病153例、乳腺纤维腺瘤36例、纤维囊性乳腺病13例、平坦型不典型增生26例、导管内乳头状瘤10例),恶性60例(浸润性癌6例、浸润性癌伴导管原位癌13例、导管原位癌41例)。因乳腺导管原位癌需要免疫组化进行分子分型及进一步治疗评估治疗方案,本研究将其归入恶性组。
2.2 乳腺X线摄影的诊断结果
MG诊断为BI-RADS 4A 159例、BI-RADS 4B 85例、BI-RADS 4C 51例、BI-RADS 5 类3例,即所有患者中MG诊断阴性为159例,阳性为139例。MG诊断的灵敏度为56.7%(34/60),特异度为55.9%(133/238),阳性预测值为24.5%(34/139),阴性预测值为83.6%(133/159),阳性似然比为1.01,准确性为56.0%(167/298)。见表1。

表1 乳腺X线摄影对可疑微钙化病变的诊断结果
2.3 乳腺动态增强MRI诊断结果
DCE-MRI组52例中,病理确诊良性36例、恶性16例。DCE-MRI诊断为BI-RADS 1~3类24例、BI-RADS 4类24例、BI-RADS 5类4例。DCE-MRI检查的灵敏度为81.3%,特异度为58.3%,阳性预测值为46.4%,阴性预测值为87.5%,阳性似然比为1.95,准确性为65.4%。见表2。

表2 动态增强MRI对可疑微钙化病变的诊断结果
乳腺X线摄影与动脉增强MRI微钙化病变影像图像,见图1~图3。与乳腺X线摄影相比,动态增强MRI显示病变范围与病理更相符(图1)。对X线上BI-RADS 4B可疑微钙化病变,当MRI不出现异常强化,可能是低级别DCIS(图3)。

图1 女,38岁,左侧乳腺Paget病伴导管原位癌图1a为左侧内外斜位MG图像,图1b为局部点压放大图像,图1a、1b显示左乳上份区域样分布细小多形性钙化(↑),BI-RADS评估为4B;图1c为MRI的MIP图像,可见左乳呈区域性分布的非肿块样强化,病灶累及乳头,BI-RADS评估为4C;图1d病理:乳腺乳头及乳晕为Paget病,在乳头输乳导管内见有导管原位癌
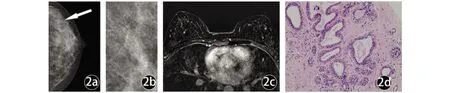
图2 女,24岁,左侧乳腺腺病图2a为左侧首尾位MG图像,图2b为局部点压放大图像,图2a、2b显示左乳区域性分布无定形钙化(↑),BI-RADS评估为4A;图2c 为MRI增强图像,未见明显异常强化,BI-RADS评估为2类;图2d病理:乳腺腺病,局灶导管上皮柱状细胞变伴大汗腺化生,个别管腔内可见钙盐沉积
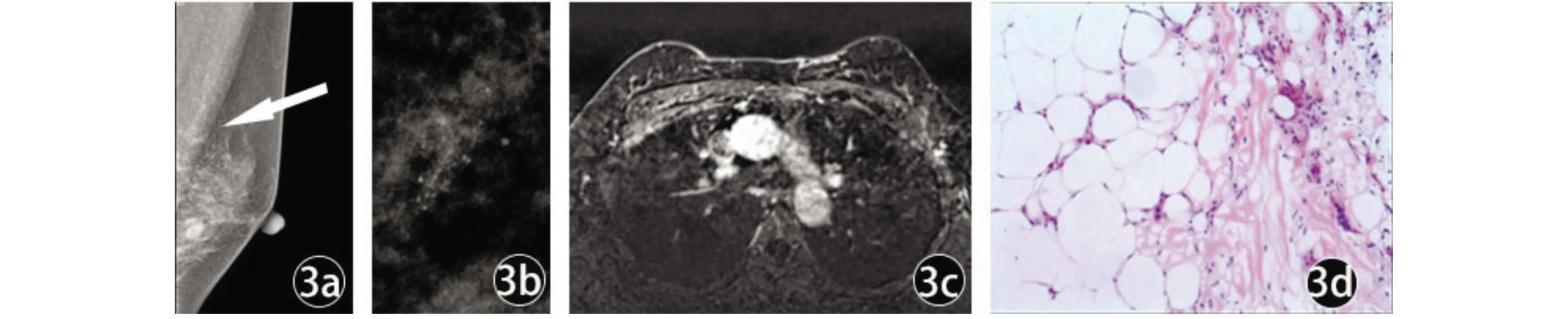
图3 女,43岁,左乳低级别导管原位癌图3a为左乳内外斜位MG图像,图3b为局部点压放大图像,图3a、3b显示左侧乳腺内上象限簇状无定形钙化,细小密集,BI-RADS评估为4B(↑);图3c为MRI增强图像,未见明显异常强化,BI-RADS评估为 3类,图3d病理:低级别导管原位癌
2.4 动态增强MRI与乳腺X线摄影联合诊断结果
DCE-MRI与MG联合诊断,指两项检查中有1项为阳性即为阳性,本研究52例中,真阳性14例,假阴性15例,灵敏度87.5%,特异度41.7%,见表3。DCE-MRI联合MG诊断BI-RADS 4~5类可疑微钙化病变的灵敏度,以及阴性预测值,均比单独使用DCE-MRI及MG检查高,各检查模式的诊断结果见表4。

表3 动态增强MRI联合乳腺X线摄影对可疑微钙化病变的诊断结果

表4 动态增强MRI、乳腺X线摄影及两者联合的诊断效能
3 讨论
乳腺X线摄影是唯一被FDA(美国食品药品监督管理局)认可用于筛查乳腺癌的影像学方法,可以有效检出乳腺内微钙化,80%乳腺导管原位癌仅表现为微钙化。钙化是MG检查中常见的征象,美国放射学会ACR将钙化分为两类:典型良性、可疑恶性。其中,最终BI-RADS评估为BI-RADS 4类和5类的钙化需要进一步组织学诊断,即需要穿刺活检或切检,此类评估中,恶性可能在2%~95%或超过95%。有研究表明,BI-RADS 3~5类微钙化特异度在23%~61.5%,准确率42.9%~69.2%[6-8]。本研究MG的特异度及准确率分别为55.9%和56.0%,与上述报道基本一致。当MG图像出现微钙化,不伴有肿块或结构扭曲征象时,需要立体定位穿刺活检或置入金属钢丝引导手术切检,当伴有肿块或结构扭曲时,其恶性可能会由于伴随征象而评估升级,本组资料探讨仅表现为微钙化的病变,剔除伴随征象对病变评估的影响。微钙化在MG中较低的特异度会导致大量穿刺活检及钢丝定位切检。
MG对乳腺微钙化较敏感,MRI虽然不能很好地显示微钙化,但对软组织具有良好的分辨率,可以提供高分辨率的形态和功能信息,如癌灶的血管生成、肿瘤灌注和血管分布形态,据报道,MRI上能够看到2~3 mm的病灶,相应微钙化区域MRI可较好显示病灶[9-11]。Kuhl等[12]报道MRI对DCIS的检测灵敏度,尤其是对高级别病变的检测灵敏度超过MG(92%比56%)。目前,虽然很多学者尝试研究MRI对MG上可疑微钙化的诊断效能,但是由于结果不同,迄今未达成共识。Bazzocchi等[8]研究发现,对4~5类微钙化的MRI的敏感性为87%,特异性为68%,准确率为80%。有研究发现对微钙化病变MRI的灵敏度在45% ~100%,特异度在37% ~ 95%[13],本研究乳腺DCE-MRI灵敏度81.3%,特异度58.3%,与该文献基本一致。乳腺微钙化是活性肿瘤组织的分泌物,肿瘤细胞迅速生长,单纯细胞周围的组织难以维持肿瘤细胞生长所需的营养,导致周围血管的增生。微钙化灶虽难以发现,但肿瘤组织早期血管生成所导致的病灶血流动力学改变,可以通过DCE-MRI扫描的信号变化反映出来[14]。对于恶性病变,MRI敏感性较高,表现为肿块样强化、非肿块强化或肿块样强化伴周围非肿块强化。对于良性病变,MRI检查大部分表现为无强化。然而,部分良性乳腺病变也会在MRI上变现为强化[15],如乳腺腺病可表现为非肿块强化。
乳腺微钙化其主要成分为草酸钙和磷酸钙[16]。乳腺微钙化可发生于活性肿瘤细胞的分泌物,也可形成于坏死的肿瘤细胞碎片内。乳腺DCE-MRI虽然难以显示乳腺的微小钙化,但根据良恶性病灶的血供差异,动态增强扫描能很好地显示病灶的形态及血流动力学参数,它对乳腺良恶性病变的定性诊断具有重要意义。本研究结果显示乳腺DCE-MRI对可疑微钙化的灵敏度、特异度及准确性均高于MG,表明对于BI-RADS 4~5类微钙化病变,乳腺DCE-MRI诊断效能较MG好,可以提高X线检出BI-RADS 4~5类可疑微钙化病变的准确性,进一步的DCE-MRI检查对微钙化病变诊断具有补充作用。BI-RADS 4类微钙化病变部分患者可以通过MRI检查降级到BI-RADS 1~3类,6个月后再进行随访观察病变,从而减少穿刺活检。本组研究DCE-MRI检查,对BI-RADS 4~5类微钙化病变阴性预测值高达87.5%,表明进一步MRI检查可以排除恶性肿瘤可能。对于良性病变,MRI上可能表现为无强化,BI-RADS评分降级,患者可进行随访,避免不必要活检。据报道,MRI降低乳腺微钙化的潜在价值(例如避免良性微钙化的活检)高于假阳性带来的恶性影响[10]。Boetes等[17]报道MRI对病变范围的评估与病理学判定病变范围的符合率比MG高21%。DCE-MRI检查能发现额外的病灶,如多灶多中心病变或双侧乳腺病变,对临床手术方案的制定更加重要[18]。乳腺DCE-MRI显示病变范围与病理更相符,有助于临床手术方式的选择。
本研究中两例低级别DCIS患者,MG评估为BI-RADS 4B,而DCE-MRI仅评估为1和3类,可能是乳腺腺体实质背景强化(BPE)掩盖了相应病变区域的强化。有研究认为对于低级别的DCIS,MRI可表现为无强化[19],本研究中两例DCIS都在DCE-MRI表现为无强化。Kuhl等[12]研究表明,低级别DCIS微血管密度显著远低于高级别DCIS。而MRI上BPE明显,可能会掩盖病变,造成假阴性。明显的BPE会降低MRI检查的灵敏度和特异性[20,21]。BPE会减少病灶与周边正常组织强化后的信号差异[22],正常纤维腺体组织周边明显及快速的强化会遮挡潜在的恶性病灶,造成假阴性。故MG上BI-RADS 4~5类可疑微钙化病变,当DCE-MRI检查降级为BI-RADS 1~3类时,也有可能会带来假阴性的结果,所以DCE-MRI与MG联合应用意义重大。结合微钙化的分布信息,动态增强MRI成像能够提供更准确的诊断,特别是对于非肿块增强的微钙化病变[23]。本组DCE-MRI与MG联合应用灵敏度为87.5%,高于单独DCE-MRI(81.3%)和MG检查(56.7%),其阴性预测值为88.2%,高于单独动态增强MRI(87.5%)和MG检查(83.6%)。二者联合检查后灵敏度及阴性预测值升高,能有效避免一些微钙化患者恶性病灶漏检,且能减少不必要的活检。
本研究局限性是:(1)本次研究入组DCE-MRI病例数量有限,样本量较小,且未能对乳腺病变的形态、信号及分布等情况进行深入探讨;(2)纳入MG及DCE-MRI组病例数相差太大,对结果存在偏倚;(3)BI-RADS 5类微钙化样本量少;(4)本文为回顾性研究,望今后可进行前瞻性研究,并纳入超声检查,完善微钙化病变在多种研究方法中诊断价值的研究。
综上,MG与动态增强MRI联合应用可以提高对需要组织学诊断的微钙化病变的灵敏度和阴性预测值,从而对乳腺良恶性病变的定性诊断提供有效帮助。对MG评估需要组织学活检时,DCE-MRI评估为阴性时,可进行随访,避免不必要的穿刺活检或切检。

