加热联合酶解大豆7S蛋白的分子结构及抗原性研究
朱 丽,孔祥珍,华欲飞
(江南大学 食品学院,江苏 无锡214122)
大豆是一种营养价值较高的家庭用或工业加工用食品材料,应用性极广[1]。但大豆作为八大食物致敏原之一,轻者可出现过敏性皮炎、腹痛腹泻、恶心呕吐等过敏反应,严重者会休克甚至死亡[2-3]。大豆中的过敏成分主要来源于大豆球蛋白和β-伴大豆球蛋白,β-伴大豆球蛋白是伴大豆球蛋白(7S)的主要存在形式,且后者比前者更易引起过敏反应[4],研究发现组成β-伴大豆球蛋白的3种亚基——α′、α及β亚基都具有致敏性[5]。
热处理是食品加工中最常用的工序之一。加热处理能够引起蛋白质的变性,由于分子相互作用发生聚集和/或二硫键重排等导致蛋白质构象表位的破坏,在某些情况下大豆致敏性可因此被降低[6],但之后的研究发现新暴露出的IgE的结合位点会导致大豆致敏性增加[7]。所以,加热处理对于大豆致敏性的降低并不是很理想。蛋白酶酶解常用于降低抗原蛋白的致敏性,其通过使肽段断裂,从而最大程度地破坏蛋白的线性表位及构象表位。Keum等[8]研究发现,大豆7S蛋白经过胃蛋白酶酶解,其抗原性降低了50%以上。黄婷等[9]用碱性蛋白酶处理β-伴大豆球蛋白40 min,β-伴大豆球蛋白抗原抑制率为33.48%。Wang等[10]用胰蛋白酶酶解豆粕12 min,β-伴大豆球蛋白抗原性残留率约为30%,但碱性蛋白酶酶解10 min,抗原性残留率仅为4%。目前关于大豆蛋白经加热预处理后,再进行蛋白酶酶解对其分子结构及抗原性的影响方面报道较少。
本研究采用不同的加热条件联合不同的酶解方式考察大豆7S蛋白分子结构及抗原性的变化。采用SDS-PAGE考察酶解后大豆7S蛋白的降解情况,采用间接竞争ELISA法考察酶解物的抗原性,并通过质谱鉴定抗消化肽段的蛋白来源,旨在为脱敏食品的加工处理提供一定的理论基础。
1 材料与方法
1.1 实验材料
低温脱脂豆粕,山东禹王生态食业有限公司;胃蛋白酶(≥1 200 U/g)、胰蛋白酶(1∶250)、氢氧化钠、浓盐酸、浓硫酸、亚硫酸氢钠、氯化钠、氯化钾、五水硫酸铜、过硫酸铵、甘氨酸、乙酸、甲醇、十二烷基磺酸钠(SDS)、2,4-二硫苏糖醇(DTT)、考马斯亮蓝R-250、三氯乙酸(TCA),国药集团化学试剂有限公司;丙烯酰胺(Acr),北京百灵威科技有限公司;β-伴大豆球蛋白定量检测试剂盒,上海酶联生物技术公司。
Himac CR21 GII 冷冻离心机,日本日立公司;K9840半自动凯氏定氮仪;酶标仪,Thermo Scientific公司;SC-15 智能节能恒温槽;pH计,梅特勒-托利多公司;垂直电泳仪、凝胶成像仪,伯乐生命医学产品有限公司。
1.2 实验方法
1.2.1 大豆7S蛋白的提取
参照Nagano等[11]的方法并做适当修改。将低温脱脂豆粕与10倍体积去离子水室温低速搅拌混合1 h,两层纱布过滤去除残渣,上清液在4℃下15 800g离心30 min,加入亚硫酸氢钠溶液使其质量浓度为0.98 g/L,然后调节pH至6.4,静置过夜, 4℃下12 000g离心20 min,收集上清液。在上清液中加入氯化钠使其浓度为0.25 mol/L,调节pH至5.0,4℃下15 800g离心30 min,再次收集上清液,加入等体积4℃预冷去离子水,调pH至4.8,4℃下12 000g离心20 min,收集沉淀,调pH至7.0,浓缩干燥,得大豆7S蛋白,4℃储藏备用。
1.2.2 蛋白质含量的测定
按照GB 5009.5—2016中凯氏定氮法进行蛋白质含量测定。
1.2.3 加热处理
配制3%的大豆7S蛋白溶液,于70、80、90℃恒温水浴中分别加热10、20 min,加热完毕后置于冰水浴中迅速冷却,4℃保存待用。
1.2.4 蛋白酶酶解
配制大豆7S蛋白溶液,调节各蛋白酶酶解最适温度和最适pH,按照酶底比1∶50加入蛋白酶,酶解过程中保持pH稳定。反应10~120 min分别取样,调pH至7.0,95℃水浴10 min灭酶,冰水冷却,待用。
1.2.5 热处理联合胰蛋白酶酶解
将1.2.3中加热后的大豆7S蛋白溶液调节pH至7.5,温度37℃,按照酶底比1∶50加入胰蛋白酶,酶解过程中保持pH稳定。分别在反应10、20、30、60、120 min时取样,调节pH至7.0,95℃水浴10 min灭酶,冰水冷却,待用。
1.2.6 热处理联合胃蛋白酶酶解
将1.2.3中加热后的大豆7S蛋白溶液调节pH至1.5,温度37℃,按照酶底比1∶50加入胃蛋白酶,酶解过程中保持pH稳定[12]。分别在反应30、60、120 min时取样,调节pH至7.0,95℃水浴10 min灭酶,冰水冷却,待用。
1.2.7 SDS-PAGE
将大豆7S蛋白和酶解后的大豆7S蛋白酶解液分别用纯水稀释至蛋白质含量0.4%,与等量的蛋白质溶解液、0.1%溴酚蓝、0.3%DTT混合,于100℃加热10 min。凝胶电泳以电压260 V、电流13 mA运行2 h,取出胶条,浸泡于固定液(7%乙酸,40%甲醇)中1 h,用考马斯亮蓝R-250染色至少2 h,然后于去离子水中脱色至背景清晰[13-14]。
1.2.8 质谱鉴定抗消化肽段
采用MALDI-TOF/TOF质谱联用技术对大豆7S蛋白酶解物中的抗消化肽段进行鉴定。用串联飞行时间质谱仪(AB SCIEX 5800 MALDI-TOF/TOF)进行测试,Flex Analysis和Bio tools软件进行分析。肽段由NCBI数据库匹配[15]。
1.2.9 ELISA法分析抗原性
按照β-伴大豆球蛋白定量检测试剂盒的使用说明书进行实验。根据试剂盒提供的线性范围,将处理好的样品用样品稀释液稀释一定的倍数,96孔酶标板加入50 μL/孔稀释样,再加入50 μL/孔的抗体工作液,轻轻晃匀,37℃温育30 min;弃液,加洗涤液300 μL/孔,保持10 s,洗涤4次,用吸水纸拍干;加入HPR标记二抗100 μL/孔,37℃温育30 min;同上洗涤、拍干后,加入混好的显色液100 μL/孔,37℃温育15 min,最后加入终止液50 μL/孔,轻晃混匀后,立即于酶标仪450/630 nm读取OD值,根据标准曲线计算过敏原含量。以抗原性降低率表示各处理方法降低抗原的效果,按下式计算。
抗原性降低率=(对照组的过敏原含量-酶解物中的过敏原含量)/对照组中的过敏原含量×100%
1.2.10 数据处理
采用Image Lab软件分析SDS-PAGE图谱;实验数据均取3次测得的平均值,采用SPSS软件分析其差异性,P< 0.05表示差异显著;采用Excel、Origin8.5软件作图。
2 结果与讨论
2.1 胰蛋白酶酶解大豆7S蛋白的相对分子质量分布及抗原性变化
2.1.1 胰蛋白酶酶解大豆7S蛋白的SDS-PAGE分析(见图1)
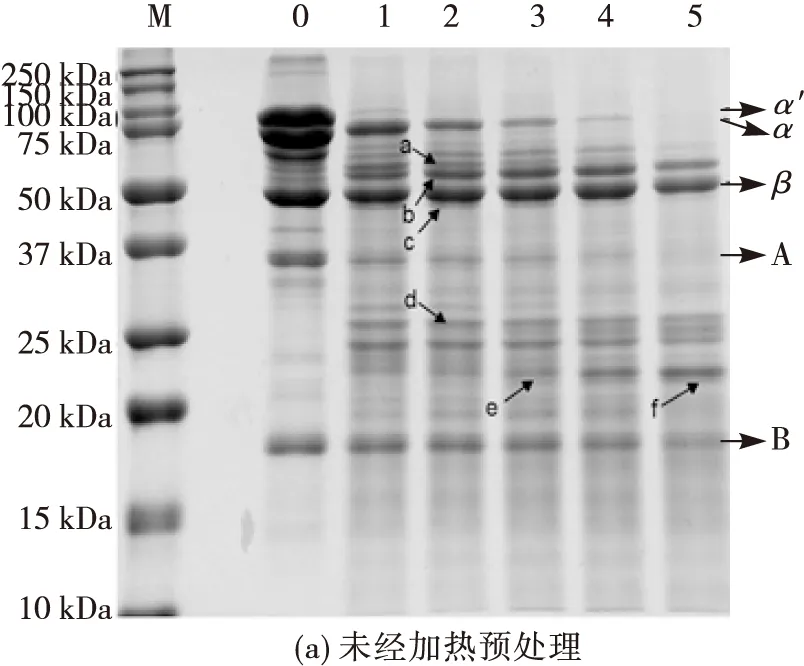
注:M为Marker;0为未经任何处理的大豆7S蛋白;图(a)的1~5为未经加热预处理的大豆7S蛋白分别酶解10、20、30、60、120 min;图(b)、(c)、(d)中1~5为加热预处理10 min后再分别酶解10、20、30、60、120 min;1′~5′为加热预处理20 min后再分别酶解10、20、30、60、120 min。图1 不同酶解条件下制备的大豆7S蛋白胰蛋白酶酶解物的SDS-PAGE谱图
实验室制备的大豆7S蛋白的蛋白质含量为91.18%。由图1(a)可知,条带0经Image Lab分析可得大豆7S/11S蛋白的比值为2.97,与吴超[16]的结果一致。胰蛋白酶能专一性地酶解由精氨酸、赖氨酸的羧基端形成的肽键。随着胰蛋白酶酶解,未经加热预处理的大豆7S蛋白的α′亚基快速降解,α亚基呈规律性地被降解,直至120 min时完全消失,而β亚基则表现出较高的消化稳定性,这与王锦欣等[17]的结论基本一致。此时产生的新条带质谱鉴定结果如表1所示。由表1可知,在50~75 kDa之间产生的一些新条带主要来自α′亚基和α亚基,在20~25 kDa之间产生的一些新的条带主要为sucrose-binding protein-like(d)、α′亚基(e)及β亚基(f),且在β亚基位置出现降解的α亚基(c)。
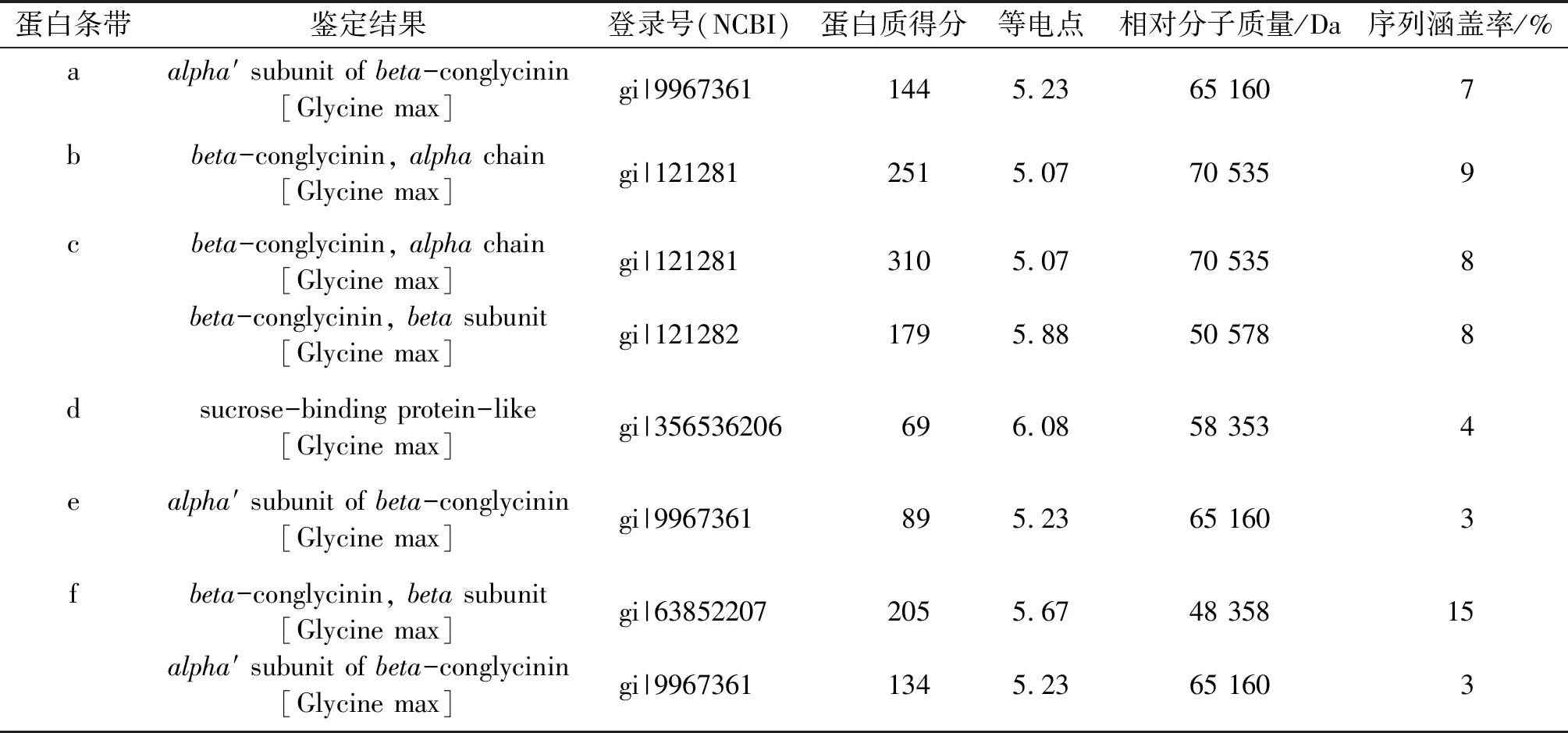
表1 胰蛋白酶酶解物的质谱鉴定结果
从图1(b)可知,与图1(a)相比,α′亚基依然很快被降解至消失,而α、β亚基的降解程度均加大,且主要产生20~25 kDa间的条带,以及15 kDa下的小分子肽段。70℃加热预处理10 min和20 min再酶解的电泳图谱差异不大,说明两种预处理方式导致的蛋白结构展开程度相近。由图1(c)可知,由于大豆7S蛋白变性温度接近80℃[18],当酶解10 min时,α′、α及β亚基基本都被降解, 只产生约25 kDa的新条带。由图1(d)可知,蛋白降解情况与图1(c)基本一致,且在酶解60、120 min时,靠近25 kDa的新条带灰度有所减弱,逐渐出现相对分子质量约20 kDa的新条带,大量酶解小肽都集中在15 kDa以下。
2.1.2 胰蛋白酶酶解大豆7S蛋白的抗原性变化(见图2)
由图2(a)可知,随着酶解时间的延长,β-伴大豆球蛋白的抗原性显著降低(P<0.05),在酶解120 min后,抗原性降低率约为40%。从电泳图上看,可能与残留的β亚基以及产生的来源于α′、α亚基的酶解肽链有关。
与未经加热预处理的样品相比,70℃加热预处理后,随着胰蛋白酶酶解时间的延长,尽管电泳谱图中图1(a)和图1(b)相差较大,但对于抗原性的影响趋势及降低率相似。由图2(b)可知,样品经过80℃或90℃加热预处理后,再进行胰蛋白酶酶解,其抗原性降低程度显著增大(P<0.05),最高可达79.99%。推测可能是加热导致蛋白结构展开,暴露更多内部的酶催化位点,故酶解效果较好,同时导致部分暴露的抗原表位被破坏。

注:图(b)中1~5为70℃加热预处理后,分别酶解10、20、30、60、120 min;6~10为80℃加热预处理后,分别酶解10、20、30、60、120 min;11~15为90℃加热预处理后,分别酶解10、20、30、60、120 min。图中不同小写字母表示差异显著(P<0.05)。图2 不同酶解条件下制备的大豆7S蛋白胰蛋白酶酶解物的抗原性降低率
2.2 胃蛋白酶酶解大豆7S蛋白的相对分子质量分布及抗原性变化
2.2.1 胃蛋白酶酶解大豆7S蛋白的SDS-PAGE分析(见图3)
与胰蛋白酶的酶解位点不同,胃蛋白酶主要酶解由芳香族氨基酸及其他疏水性氨基酸形成的肽键。通过预实验,确定胃蛋白酶酶解大豆7S蛋白的酶解时间分别选取30、60 min和120 min进行考察。由图3(a)可知,未经加热预处理大豆7S蛋白经胃蛋白酶酶解30~120 min后,α′、α亚基略微被降解,而β亚基的灰度逐渐增加,且50~75 kDa之间也产生一条逐渐加深的新条带,同时大豆7S蛋白中含有的11S的A、B肽链优先被酶解,这与赵谋明[12]、刘晓毅[19]等的研究结果一致。由图3(b)可知,在70℃下加热10 min及20 min后再酶解,α′、α及β亚基均大幅度降低,且与胰蛋白酶酶解情况相同的是均产生25 kDa附近的新条带;同样,由图3(c)、(d)可知,在80、90℃下酶解60 min后,α′、α及β亚基基本消失,且均产生位置集中在20 kDa以下的小分子肽段。综上所述,经过加热预处理后,采用胃蛋白酶酶解,大豆7S蛋白的3种亚基在电泳谱图中的条带很快消失,同时在37 kDa以下出现大量不同相对分子质量的肽链,这些肽链主要为致敏条带α′、α及β亚基的酶解产物。
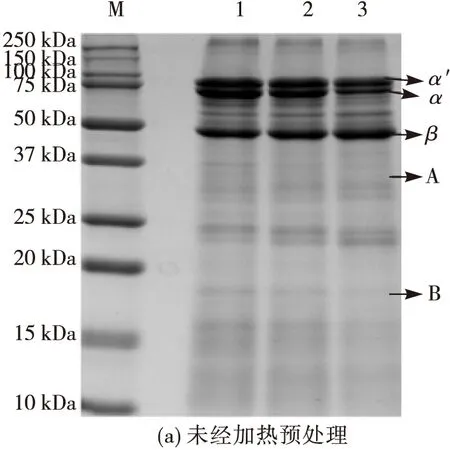
注:M为Marker;0为未经任何处理的大豆7S蛋白;图(a)的1~3为未经加热预处理的大豆7S蛋白分别酶解30、60、120 min;图(b)、(c)、(d)1~3为加热预处理10 min后再分别酶解30、60、120 min;1′~3′为加热预处理20 min后再分别酶解30、60、120 min。图3 不同酶解条件下制备的大豆7S蛋白胃蛋白酶酶解物的SDS-PAGE谱图
2.2.2 胃蛋白酶酶解大豆7S蛋白的抗原性变化(见图4)
由图4(a)可知,胃蛋白酶酶解物的抗原性降低率随着酶解时间的延长而增加,抗原性降低率为3.8%~4.5%。因为其主要致敏蛋白α′、α及β亚基降解程度不大,导致还存在大量的抗原表位。
由图4(b)可知,在相同酶解条件下,不同的加热预处理时间(10、20 min)对酶解物的抗原性的影响较小;同时,结合图3发现酶解物中肽链组成基本一致。在相同的加热预处理时间下,随着加热预处理温度升高,酶解物的抗原性降低率总体呈现先增大后降低的趋势。70℃加热预处理10 min后,随着酶解时间的延长,其抗原性降低率从10%逐渐增大到37%左右,结合相应电泳谱图,推测可能是α′、α及β亚基大幅度降解导致的。80℃加热预处理条件下, 抗原性降低率从20%显著增加到约50%(P< 0.05),此时α′、α亚基基本消失,导致内部部分抗原表位暴露,从而被破坏,进而抗原性大大降低。90℃加热预处理条件下,条带的变化情况与80℃类似,但是ELISA的结果显示,酶解30 min后抗原性降低率约为20%,而酶解120 min后抗原性降低率约为10%。推测这可能与产生的新肽段的聚集有关,即虽然线性表位被破坏,但却出现新的构象表位,从而导致抗原性增加。
综上,加热预处理可以促进蛋白酶对大豆7S蛋白的酶解,且更大程度地降低抗原性;经过80℃或90℃加热预处理后,再进行胰蛋白酶酶解,其抗原性降低程度明显增大,最高可达79.99%;加热预处理后再经胃蛋白酶酶解,其抗原性降低率最大可达50.4%。

注:图(b)中1~3为70℃加热预处理后,分别酶解30、60、120 min;4~6为80℃加热预处理后,分别酶解30、60、120 min;7~9 为90℃加热预处理后,分别酶解30、60、120 min。图中不同小写字母表示差异显著(P<0.05)。图4 不同酶解条件下制备的大豆7S蛋白胃蛋白酶酶解物的抗原性降低率
2.3 抗消化肽段的鉴定(见图5)

注:M为 Marker;1为大豆7S蛋白;2为80℃加热预处理10 min后,胰蛋白酶酶解10 min;3为80℃加热预处理10 min后,胃蛋白酶酶解10 min。图5 胰蛋白酶、胃蛋白酶的酶解物抗消化肽段的SDS-PAGE谱图
结合两种酶解方式的电泳结果以及抗原性来看,胰蛋白酶酶解物和胃蛋白酶酶解物仍具有一定的抗原性,虽然胰蛋白酶和胃蛋白酶的酶解位点不同,但是均在加热预处理再酶解后产生相同位置的新条带,推测可能是残留的抗消化肽段(20~25 kDa)引起的(图5中的I 、II)。为了确定这两种酶解条件下的新条带的相关信息,采用质谱鉴定抗消化肽段,结果见表2。
由表2可知,这两种酶解条件下的新条带均来源于β-伴大豆球蛋白的α亚基,发现虽然两种酶酶解位点不同,但产生的抗消化肽段来源相同,且α亚基是国际公认的致敏蛋白之一[20],这解释了为何酶解后还存在致敏性。大豆过敏属于IgE介导的Ⅰ型超敏反应[21],致敏原要保持完整的抗原决定簇才有致敏的可能性。

表2 抗消化肽段的质谱鉴定结果
3 结 论
本研究表明,加热和酶解联合处理能够显著增大β-伴大豆球蛋白的降解程度,β亚基消化程度得到极大提升,α亚基、α′亚基几乎完全被降解,在相同酶解时间下,胰蛋白酶的酶解速度快于胃蛋白酶。同时,加热和酶解联合处理能够有效地降低大豆7S蛋白的抗原性。单独加热处理,仅可使得蛋白结构松散,更多的酶解位点得到暴露,引起过敏反应的构象表位得到一定的破坏。而加热联合酶解处理能够大幅度降低β-伴大豆球蛋白的抗原性,蛋白展开的结构暴露的抗原表位更利于蛋白酶的破坏,其中胰蛋白酶的酶解效果优于胃蛋白酶,经80℃加热预处理10 min再经胰蛋白酶处理,大豆7S蛋白的抗原性降低了79.99%,而胃蛋白酶酶解条件下最多只降低了50.4%。另外,胰蛋白酶和胃蛋白酶经过加热预处理后再酶解,产生的相同相对分子质量位置的新条带,经蛋白鉴定后,均来自于β-伴大豆球蛋白的α亚基,为国际公认的致敏蛋白之一。此结果可为脱敏食品的研究提供一定的理论基础。

