重组人干扰素α-2b栓联合LEEP治疗宫颈癌前病变合并HPV感染的疗效观察
陈九蒲 谷保双
(南阳市第一人民医院产科,河南 南阳 473000)
宫颈重度上皮内瘤样病变(Cervical intraepithelial neoplasia,CIN)属于癌前病变,是宫颈癌过程的过渡期,具有可逆性[1]。宫颈癌前病变患者,一般症状表现不明显,仅有白带增多症状,或部分患者白带带血和性接触后阴道少量流血等,影响患者的正常性生活,对患者造成极大心理压力[2]。若不及时治疗,可能会发生癌变,感染人乳头状瘤病毒(Human papilloma virus,HPV)是造成此病的主要原因。而HPV的持续感染,是上皮内发生癌变的主要条件。因此,针对宫颈癌前病变合并HPV患者采取科学有效的治疗措施对改善预后意义重大[3]。高频电波刀的电圈切除术(Loop electrosurgical excisionprocedure,LEEP)因微创、操作简单等优势被临床广泛运用,其主要原理是通过电极尖端产生的高频电波作用于病灶,使病变组织细胞不可逆性坏死,同时能够防止出血,加速组织重建,能够在不伤害生育能力的情况下降低癌变风险[4]。基于此,本研究旨在探讨针对宫颈癌前病变合并HPV患者采取LEEP联合重组人干扰素α-2b栓进行治疗的效果,现报道如下。
1 资料与方法
1.1 一般资料
采用随机数表法将2016年6月至2019年5月我院收治的113例宫颈癌前病变合并HPV感染患者分为对照组(n=56)和观察组(n=57)。对照组患者年龄19~37岁,平均年龄26.16±6.75岁;病程1~3年,平均病程1.87±0.61年; CINⅠ级15例,Ⅱ级24例,Ⅲ级17例。观察组患者年龄20~37岁,平均年龄26.20±6.81岁;病程1~3年,平均病程1.90±0.67年;CINⅠ级14例,Ⅱ级25例,Ⅲ级18例。两组患者一般资料无统计学差异(P>0.05),具有可比性。
1.2 入选标准
1.2.1 纳入标准
①两组均符合《妇产科学》[5]中宫颈癌诊断标准;②近半年未参加其他研究试验者;③家属及本人自愿参与研究,并签署知情同意书。
1.2.2 排除标准
①对研究药物有过敏反应;②合并其他严重肿瘤;③妊娠或哺乳期。
1.3 方法
两组患者均在月经后2 d使用5%聚维酮碘溶液(杭州民生药业有限公司,国药准字H33021567)涂于患处,每日1到2次。并叮嘱患者月经彻底干净后5-7 d进行LEEP手术,术前禁止性生活。
1.3.1 LEEP治疗
对照组患者采用LEEP治疗,具体方法如下。
患者取膀胱截石位,充分暴露宫颈和外阴进行消毒,使用1%利多卡因(河北天成药业股份有限公司,国药准字H13022313)进行局部麻醉;使用阴道观察镜确定病变位置及范围,以高频电波刀(95 Corporate Drive Trumbull,CT 06611 USA,国械注进20153253511)切除病变及转化区域和下方宫颈组织,环形电极直径根据患者病变组织厚度及范围进行选择,切除病变范围应包含病变部位及转化区周围正常组织2~3 cm,锥切5~10 cm,电凝创面止血,并在术后使用抗生素,嘱患者外阴保持清洁,卧床休息,且2 w内禁止盆浴及性生活。
1.3.2 LEEP治疗联合重组人干扰素α-2b栓
观察组患者采用LEEP治疗后,使用重组人干扰素α-2b栓(长春生物制品研究所,国药准字S19991019)置于阴道后穹隆,每次1枚,隔日1次,睡前使用。
1.4 评价指标
1.4.1 疗效
痊愈:阴道内分泌物正常,且非典型增生症状消失;好转:阴道内分泌物有改善,且非典型增生症状下降为Ⅰ级,或以上指标均存在好转迹象;无效:阴道内分泌物无任何改善且加重;有效率=痊愈率+好转率。
1.4.2 HPV病毒载量
应用实时荧光定量PCR仪(杭州安杰思生物科技有限公司,国械注准20173400921)于患者治疗前、治疗结束后进行HPV病毒载量检测:检测范围5×108copies•ml-1,样本提取,于12000 r•min-1离心10 min,弃上清液,并将50 μ0提取液加入试管中,沸水煮10 min;将已配置好的反应管加入2 μ已上清液,离心5~10 s;随后将加样各反应管放入PCR仪器反应槽,根据其对应顺序设置标本、空白对照、阴性、定量标准品各梯度,扩增后使用电脑进行自动分析,计算出定量结果。
1.4.3 T淋巴细胞
应用流式细胞检测仪(圳迈瑞生物医疗电子股份有限公司,粤械注准20142220183)对患者治疗前、治疗30 d后T淋巴细胞CD3+、CD4+、CD8+水平进行检测,并计算CD4+/CD8+。
1.5 统计学方法
采用SPSS24.0软件进行数据处理,计量资料以均数±标准差(±SD)表示,采用t检验,计数资料以%表示,采用X2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 临床疗效
观察组疗效高于对照组(P<0.05),见表1。

表1 治疗总有效率(n(%))
2.2 HPV病毒载量
治疗前,两组患者HPV病毒载量差异无统计学意义(P>0.05);治疗后,两组均有下降,且观察组HPV病毒载量对照组低(P<0.05),见表2。
表2 治疗前、后两组HPV病毒载量(±SD,RLU/CO)
注:与治疗前相比,△P<0.05;与对照组相比,*P<0.05。
组别 对照组(n=56) 观察组(n=57)治疗前 3.07±0.24 3.08±0.23治疗后 2.21±0.15△ 1.07±0.11*△
2.3 对比分析两组T淋巴细胞水平
治疗前,两组T淋巴细胞各项指标水平差异无统计学意义(P>0.05);治疗后,两组指标水平均有改善,且观察组CD3+、CD4+、CD4+/CD8+各项指标水平高于对照组,CD8+水平低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 对比治疗前、后两组T淋巴细胞水平(±SD)
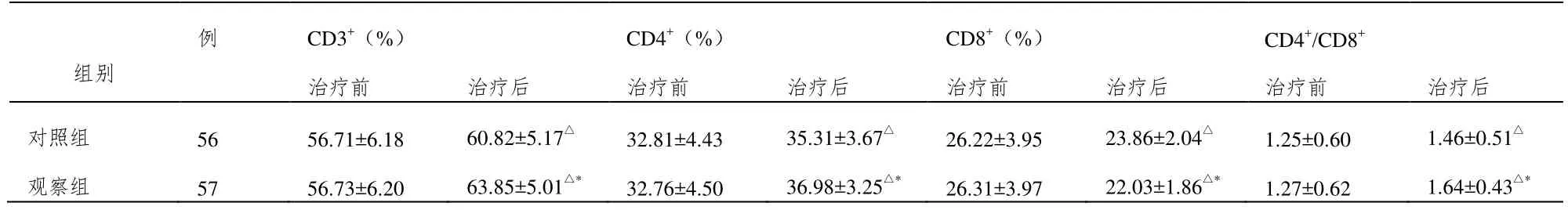
表3 对比治疗前、后两组T淋巴细胞水平(±SD)
注:与治疗前相比,△P<0.05;与对照组相比,*P<0.05。
例 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 56 56.71±6.18 60.82±5.17△ 32.81±4.43 35.31±3.67△ 26.22±3.95 23.86±2.04△ 1.25±0.60 1.46±0.51△组别观察组 57 56.73±6.20 63.85±5.01△* 32.76±4.50 36.98±3.25△* 26.31±3.97 22.03±1.86△* 1.27±0.62 1.64±0.43△*
3 讨论
宫颈癌前病变现学术称为宫颈上皮内瘤变是常见的妇科疾病之一,是指上皮内病变,若不及时给予有效治疗,极易引起癌变,甚至会发展为宫颈癌[6]。而宫颈癌属于妇科恶性肿瘤之一,预后差,对患者健康生命带来极大的威胁[7]。CIN病变分为三期,分别存在不同的病理特征:低级别上皮内病变CINⅠ期,表现为细胞浸宫颈上皮下三分之一处;高级别上皮内病变CINⅡ期表现为细胞浸宫颈上皮三分之二处;高级别上皮内病变CINⅢ期基本占整个宫颈上皮,如突破基底膜,便会发展为宫颈癌变[8]。HPV感染已被多次证明是CIN发展成宫颈癌的重要因素,而自身抵抗力降低后,极易发生病毒感染。因此,提高CIN合并HPV患者的自身免疫,及时消除HPV病毒,可以有效降低癌变风险,对改善预后有着重要的作用[9-10]。
LEEP是专门用来微创性诊断和治疗的专业技术,经电极尖端发出高频电波,接触患者身体后,由于组织本身阻抗,吸收此高频电波瞬间产生高热,目前已成为CIN的主要治疗方式。LEEP的优点在于很少发生传统电刀所造成的组织拉扯、炭化的现象,不仅对周围组织伤害小,且手术时间短,治疗中无疼痛,还能较好的防止出血或感染等并发症的发生[11]。在本次研究中,观察组患者治疗效果明显优于对照组,而HPV病毒载量较对照组低,且治疗后CD3+、CD4+、CD4+/CD8+各项指标水平高于对照组,CD8+水平低于对照组,均表明重组人干扰素α-2b栓联合LEEP治疗CIN合并HPV患者,治疗效果更显著,能够提升其自身机体免疫,减少HPV病毒载量。分析其原因在于,重组人干扰素α-2b栓能够将药物融化于病变位置,依靠其广谱抗病毒作用和对机体的免疫调节功能,抑制宫颈上皮病变细胞增殖,提高免疫细胞水平。与LEEP联合使用,效果更佳,通过自身免疫调节,抵抗病毒,阻断发展为宫颈癌的可能[12]。
综上所述,针对宫颈癌前变合并HPV病毒患者应用重组人干扰素α-2b栓联合LEEP治疗,治疗效果更显著,能够有效降低HPV病毒载量,提升自身免疫防护能力。

