双席夫碱铜配合物修饰玻碳电极用于碳酸饮料中苯甲酸的测定
梁楚欣,刘 峥∗,陈则胜,冯炜怡,李海莹,张淑芬,2
(1.桂林理工大学 化学与生物工程学院 电磁化学功能物质广西区重点实验室,桂林 541004;2.大连理工大学 精细化工重点实验室,大连 116024)
苯甲酸及其钠盐是一种常用的防腐剂,广泛用作食品、饮料、牙膏、漱口水、化妆品等的添加剂[1]。苯甲酸作为食品添加剂时,其添加量应在规定的范围内。美国食品和药物管理局规定食品中苯甲酸的添加量为0.05%~0.1%[2];国家标准GB 2760-2014对苯甲酸的使用量有更严格的规定,如胶基糖果、调味糖浆、复合调味料、碳酸饮料中的苯甲酸最大使用量分别为1.5,1.0,0.6,0.2 g·kg-1。然而,一些不法贸易商为了延长食品的保质期,在食品中违规添加了过量的苯甲酸,人在食用后,可能存在食物中毒等危害人身体健康的风险[3]。因此,建立一种简便、快捷和高灵敏的测定食品中苯甲酸含量的方法对相关执法部门监管食品中苯甲酸的添加量具有十分重要的意义。
目前,苯甲酸的测定方法主要有差示扫描量热法(DSC)[4]、胶束电动色谱法(MEKC)[5]、气相色谱法(GC)[6-7]、高效液相色谱法(HPLC)[8-9]等,但这些方法存在成本高、操作复杂和分析速率慢等缺点。薄层色谱法(TLC)[10]、紫外分光光度法[11]和荧光光谱法[12]也可用来测定苯甲酸的含量,具有操作简单、分析速率快和结果准确等特点,但其灵敏度还需要提高。电分析法具有成本低、灵敏度高、检测速度快等特点,已广泛用于食品分析领域,但开发一种成本更低廉、操作更方便、灵敏度更高、测定时间更短的测定食品中食品添加剂含量的方法,仍是科研工作者不断努力的方向。
双席夫碱结构灵活多变,能与过渡金属离子配位形成稳定的双席夫碱金属配合物,将其作为电子转移媒介物修饰到电极表面,可提高电极的选择性与灵敏度[13]。将双席夫碱金属配合物应用于分析化学领域,建立测定苯甲酸含量的方法,可拓宽双席夫碱及其金属配合物的应用领域范围。本工作采用溶液法制备了双席夫碱铜配合物(M),并采用电沉积法将其固定在玻碳电极(GCE)表面,形成了双席夫碱铜配合物修饰GCE(M/GCE),据此建立了M/GCE测定碳酸饮料中的苯甲酸含量的电化学方法,以期为食品中苯甲酸含量的测定提供技术参考。
1 试验部分
1.1 仪器与试剂
CHI 760E型电化学工作站;AL 204型电子分析天平;WS 701型红外快速干燥灯;BPZ-6000型真空干燥箱;DHG-9023A 型鼓风干燥箱;KQ-100DE型数控超声波清洗器;Perkin-Elmer 240Q 型元素分析仪;SU 5000 型场发射扫描电子显微镜(SEM);Shimadzu FTIR-8400 型红外光谱仪(FTIR);GCE(直径为2 mm),铂丝电极(直径为2 mm)。
KCl溶液:0.1 mol·L-1,称取KCl 固体1.862 5 g,用水溶解并定容至250.0 mL。
苯甲酸标准溶液:2.000 0 mmol·L-1,称取苯甲酸0.024 4 g,用0.1 mol·L-1KCl溶液溶解并定容至100.0 mL。
所用试剂均为分析纯;试验用水为蒸馏水。
1.2 仪器工作条件
三电极体系:以M/GCE 或GCE 为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极;电化学方法为循环伏安法(CV);扫描范围为-1.0~1.0 V,扫描速率为50 mV·s-1;以0.1 mol·L-1KCl溶液为支持电解质。
1.3 试验方法
1.3.1 M 的制备
邻羧基苯甲醛缩乙二胺席夫碱:根据文献[14],以邻羧酸苯甲醛和乙二胺为原料制备,得到白色粉末,熔点为131.0~134.0 ℃。
称取0.324 5 g(1 mmol)邻羧基苯甲醛缩乙二胺席夫碱和20 mL 甲醇于100 mL 的三口烧瓶中,于室温下磁力搅拌成白色浑浊溶液,然后向溶液中缓慢滴加含有0.199 5 g(1 mmol)一水合乙酸铜的甲醇溶液25 mL,溶液由浑浊状态逐渐变成蓝色澄清状态。在100 ℃下搅拌回流3 h后,停止搅拌,静置,冷却至室温,有蓝色片状晶体析出。用中速滤膜减压抽滤,并用甲醇洗去沉淀中的杂质,置于30 ℃真空干燥箱中干燥24 h,得到 M 的质量为0.201 9 g,产率为42.47%。
1.3.2 M/GCE的制备
在麂皮上依次用0.1μm 和0.03μm 的氧化铝粉末将GCE抛光20 min,打磨至镜面,然后在水中超声30 min,除去电极表面的杂质,用水冲洗后,置于50℃的烘箱中干燥5 min。将3 mmol M 在玛瑙研钵中碾碎,用400 mLN,N-二甲基甲酰胺(DMF)溶解,配制成0.007 5 mol·L-1M-DMF 溶液。将预处理好的GCE浸泡在M-DMF溶液中,采用三电极体系(参比电极为Ag/AgCl电极),以四丁基高氯酸铵(TBAP)为支持电解质,控制电位为-1.5~1.5 V,电沉积速率为50 mV·s-1,电沉积圈数为20,将M 通过CV 沉积到GCE 表面,得到M/GCE,用适量水冲去M/GCE 表面吸附的杂质,在红外快速干燥灯下干燥。
1.3.3 样品的分析方法
超声除去雪碧中CO2后,量取10.0 mL雪碧样品,用0.1 mol·L-1KCl溶液定容至100.0 mL,分取15.0 mL于25 mL烧杯中,按照仪器工作条件测定其中苯甲酸含量。
2 结果与讨论
2.1 M 的 表征
通过元素分析的结果可知,M 的分子式为C41H52Cu2N4O15,M 中碳、氮、氢元素的质量分数的实测值(理论值)为:C 50.73%(50.87%);N 5.64%(5.79%);H 5.51%(5.42%)。
采用KBr压片,对合成的M 进行了FT-IR 表征,见图1。
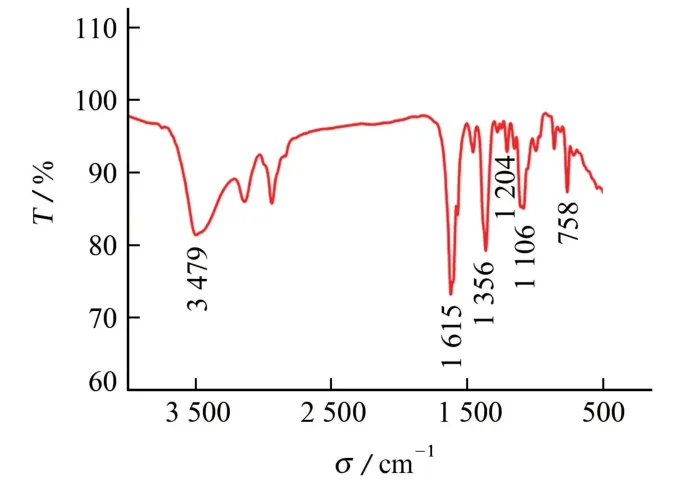
图1 M 的红外光谱图Fig.1 IR spectrum of M
由图1可知:在3 479 cm-1处出现了较宽的吸收峰,此峰的出现主要归因于配合物中含有配位水和结晶水中的O-H 伸缩振动;1 615 cm-1是NH 的弯曲振动吸收峰,表明N-H 中氮原子与金属铜离子发生了配位;1 204 cm-1是羧基C-O 的伸缩振动吸收峰;1 106 cm-1是伯烷基醚sp3杂化的C-O 键的伸缩振动吸收峰。
2.2 电沉积过程的电化学行为
M 在GCE上的电沉积过程的CV 曲线见图2。
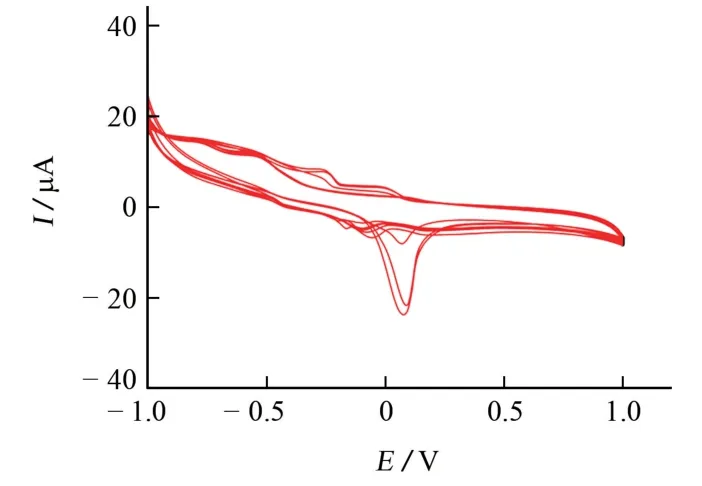
图2 M/GCE修饰电极的CV 曲线Fig.2 CV curves of M/GCE
由图2 可知:0.079 V 处出现了氧化峰,-0.014 V 处出现了还原峰,两峰电位差约0.059 V,可归属为Cu(Ⅱ)/Cu(Ⅰ)电对的电极反应[15],且该反应的可逆性较高[16]。随着扫描圈数的增大,氧化峰和还原峰越来越明显,推测可能是M 通过其中的芳香环与铜离子之间的d-π作用,已逐渐沉积到了GCE上。
2.3 M/GCE的表面形貌
为了考察M/GCE表面的修饰效果,采用SEM对GCE和M/GCE 的表面形貌进行了表征。在加速电压为5.0 k V,放大倍数为800倍时,GCE和M/GCE表面的SEM 形貌见图3。

图3 GCE和M/GCE表面的SEM 图Fig.3 SEM images of the surface of GCE and M/GCE
由图3可知:GCE显示为较为光滑的表面,M/GCE显示为凹凸不平的表面,说明GCE 表面已形成一层聚合膜[17]。
2.4 苯甲酸在电极上的电化学行为
以2.000 0 mmol·L-1苯甲酸标准溶液为待测对象,按照仪器工作条件考察了GCE和M/GCE对苯甲酸的电化学响应效果,结果见图4。

图4 GCE和M/GCE上苯甲酸的电化学行为Fig.4 Electrochemical behavior of benzoic acid on the GCE and M/GCE
由图4可知:当以GCE 为工作电极时,在CV曲线上几乎观察不到电化学响应信号;当以M/GCE作为工作电极时,在CV 曲线上观察到分别位于0.148,-0.007 V 处的氧化峰1 和氧化峰2,0.096,-0.359 V 处的还原峰1′和还原峰2′。氧化峰1和还原峰1′可能与Cu(Ⅱ)/Cu(Ⅰ)电对的电极反应有关,而氧化峰2和还原峰2′来源于苯甲酸的电极反应[18]:

以上结果表明:M/GCE 对苯甲酸的电化学响应和其表面修饰的M 有关。
2.5 扫描速率对M/GCE 上苯甲酸电化学行为的影响
试验考察了扫描速率为25~200 mV·s-1时对苯甲酸电化学行为的影响,结果见图5。
由图5可知:氧化峰2和还原峰2′电流随扫描速率的增加而增大,氧化峰2电流从18.6μA 增加至40.2 μA,还原峰2′电流从8.23 μA 增加至19.7μA。氧化峰2的电位略向正向移动,还原峰2′的电位略向负向移动,电极反应可逆性变差。
以扫描速率的平方根(ν1/2)为横坐标,相应的苯甲酸的氧化峰电流(Ipa2)和还原峰电流(Ipc2′)为纵坐标绘图,见图6。
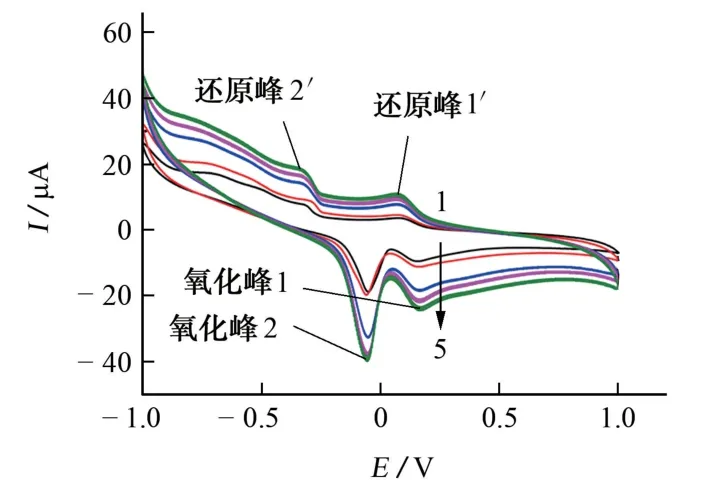
图5 扫描速率对苯甲酸电化学行为的影响Fig.5 Effect of scan rate on electrochemical behavior of benzoic acid
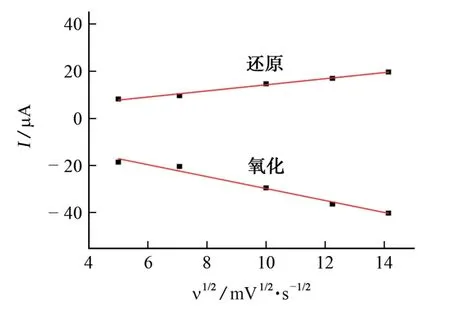
图6 氧化还原峰电流与扫描速率的平方根的关系图Fig.6 Relationship between redox peak current and square root of scan rate
由图6可以看出:Ipa2~ν1/2的线性方程为Ipa2=-2.535×ν1/2-4.446,相关系数为0.987 1;而Ipc2′~ν1/2的线性回归方程为Ipa2′=1.296×ν1/2+1.295,相关系数为0.992 3。以上结果表明,在25~200 mV·s-1内,苯甲酸在M/GCE 表面的反应受扩散控制[19]。
2.6 支持电解质对苯甲酸电化学行为的影响
试验考察了分别以H2SO4溶液(pH 2.0)、NaOH 溶液(pH 12.0)、KCl溶液、KBr溶液、磷酸盐缓冲溶液(pH 7.0)为支持电解质时对苯甲酸电化学行为的影响,结果见图7。
由图7可知:以KCl溶液为支持电解质时,有2对氧化还原峰出现,由上面分析可知,可归属于Cu(Ⅱ)/Cu(Ⅰ)和苯甲酸的可逆电极反应,电化学响应较好。以KBr 溶液为支持电解质时,只在-0.008,0.140 V 处出现了2个氧化峰,而没有对应还原峰,说明在KBr溶液中,M/GCE上发生的2个电极反应不可逆;以磷酸盐缓冲溶液为支持电解质时,在-0.346,-0.352 V 处出现了一对明显的氧化还原峰,可归属于苯甲酸的可逆电极反应,而在-0.011 V 处出现一个氧化峰,没有对应的还原峰,可归属于Cu(Ⅱ)/Cu(Ⅰ)的不可逆电极反应;以H2SO4溶液(pH 2.0)为支持电解质时,只在0.125 V 处出现一个氧化峰,可归属于Cu(Ⅱ)/Cu(Ⅰ)的不可逆电极反应;以NaOH 溶液(pH 12.0)为支持电解质,基本无电化学响应信号。因此,试验选择KCl溶液作为支持电解质来考察苯甲酸在修饰电极上的电化学行为。

图7 支持电解质对苯甲酸电化学行为的影响Fig.7 Effect of the support electrolyte on the electrochemical behavior of benzoic acid
2.7 标准曲线和检出限
按照仪器工作条件对0.001 0,0.010 0,0.100 0,0.250 0,0.500 0,1.000 0,2.000 0 mmol·L-1的 苯甲酸标准溶液系列进行测定,以苯甲酸浓度为横坐标,氧化峰2电流为纵坐标绘制标准曲线。结果表明:苯甲酸的浓度在0.001 0~2.000 0 mmol·L-1内,M/GCE 对苯甲酸的响应电流与苯甲酸浓度呈线性关系,线性回归方程为y=-0.032 2x-0.009 8,相关系数为0.995 7。
以3倍信噪比(S/N)计算检出限(3S/N),所得结果为0.27μmol·L-1。
2.8 M/GCE的稳定性和重现性
将M/GCE在4℃保存7 d,再按照仪器工作条件在支持电解质中进行扫描,其响应电流只比初始值下降了4.8%,表明制备的M/GCE具有良好的稳定性。
按照试验方法制备5个M/GCE 修饰电极,每个电极在2.000 0 mmol·L-1苯甲酸标准溶液中平行测定5次,计算氧化峰响应电流的相对标准偏差(RSD)为3.2%,说明M/GCE具有良好的重现性。
2.9 干扰试验
在苯甲酸标准溶液浓度为2.000 0 mmol·L-1时,试验考察了L-半胱氨酸、柠檬酸、柠檬酸钠、白砂糖等干扰物质对苯甲酸电化学行为的影响。结果发现:当存在15倍的L-半胱氨酸,50倍的柠檬酸、柠檬酸钠,100倍的白砂糖时,苯甲酸测定值的相对误差分别为4.6%,4.5%,3.3%,2.9%,说明以上几种干扰物质均不影响苯甲酸的测定。
2.10 精密度和回收试验
按试验方法对雪碧样品中苯甲酸的含量进行5次平行测定,并以其为基质进行了加标回收试验,计算回收率和测定值的RSD,结果见表1。

表1 精密度和回收试验结果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
本工作建立了一种用M/GCE测定碳酸饮料中苯甲酸含量的电化学方法,该方法具有灵敏度高、准确性好、稳定性高和重现性较好等优点,可用于碳酸饮料中苯甲酸含量的测定。

