水稻病程相关蛋白质OsPR1A 参与光响应信号
燕高伟, 刘玉晴, 张 彤, 王田幸子, 李莉云, 刘国振, 窦世娟
(河北农业大学 生命科学学院, 河北 保定 071001)
水稻(Oryza sativa L.)是全球最重要的经济作物和粮食作物之一,也是研究单子叶植物的模式生物。随着全球环境持续变暖,极端气候屡次出现,自然灾害频繁发生,给水稻带来很多不可预知的风险,冷、热、旱、淹、盐等环境条件是影响水稻产量的重要环境因素。而水稻白叶枯病、稻瘟病、纹枯病则是影响水稻产量的三大病害。为了克服这些非生物和生物胁迫,植物会通过一系列信号分子感知外界信息,引发体内抗性反应。
病程相关蛋白质(Pathogenesis-related proteins, PR)是防卫体系的重要组成部分,水稻中有900 多个PR 基因[1],在水稻的生长发育过程和抗性反应中发挥重要作用,受多种植物激素、病原菌和非生物胁迫诱导[2-3]。水稻PR1 家族属于类丝氨酸羧肽酶(Serine carboxypeptidase-like proteins, SCPLs), 水稻中包含99 个该家族成员。其中OsPR1A 是最早被鉴定和克隆出来的病程相关蛋白质之一,被广泛作为抗性反应的标志物。OsPR1A 的表达受多种生物胁迫的诱导,也对激素和其他刺激产生响应[2-4]。 在水稻与白叶枯病菌(Xanthomonas oryzae pv. oryzae, 简称Xoo)互作反应中,OsPR1A、OsPR1B 和OsPR10A 蛋白质在Xoo 侵染水稻叶片144 h 后大量表达[3]。 细胞质中与活性氧(Reactive oxygen species, ROS) 清除系统有关的一种non-RD 类受体激酶rrsRLK(Required for ROS-scavenging receptor-like kinase, LOC_Os01g02290),其缺失突变体(ΔrrsRLK)中过氧化物酶体的异常生物生成、过氧化氢(H2O2)的积累以及活性氧清除酶活性的降低,OsPR1a、OsPR1b、OsLOX 和茉莉酸(Jasmonic acid, JA)相关基因的表达显著升高,对许多Xoo 菌株具有较强的抗性[5]。水稻幼苗外施JA 等处理,OsPR1a 基因转录水平上调[2]。众所周知,JA 在抵抗病原菌的防卫反应中具有重要作用。而光照与JA 有着非常密切的关系,有研究表明,庇荫条件下导致拟南芥光敏色素B 部分失活,诱发磺基转移酶ST2a 上调表达,催化JA 的活性形式(JA-OH)硫化形成非活性JA(JA- HSO4),下调JA 相关的防御反应并促进生长相关的激素途径,使植物充分发挥庇荫反应,提高竞争力。这种光介导的生长/防御平衡变化对植物适应和作物产量有重要影响[6]。
处于植物防御反应信号下游的蛋白质OsPR1A在不同光照条件下的响应机制以及在协调生长/防御反应中的作用,尚未见报道。本试验旨在通过不同光照处理,研究OsPR1A 的表达情况,为进一步研究光照-激素-生长/防御关系奠定良好的基础。
1 材料与方法
1.1 水稻的种植
将水稻4021 种子在27 ℃下放入水中浸种2 d,装入2/3 体积的自然土,然后再上方装入1/3 过筛的自然土,将花盆放入水槽中过夜以浸湿土壤,再将浸泡的种子用镊子种于土中,27 ℃,12 h 光照/12 h 黑暗培养至少3 周,期间注意及时补充水槽内的水确保水位高于最高的花盆孔。
1.2 水稻全蛋白质的提取
叶片或根部材料保持冷冻状态,钢珠震荡研磨成粉末,按1∶10 质量体积比加入提取缓冲液,低温涡旋30 s,之后低温静置2 min,4 ℃,12 000 r/min 离心20 min,取上清,按照上清液: 上样缓冲液 buffer 为1∶4 的比例混匀。沸水浴15 min,-4 ℃冻存。
1.3 蛋白质样品的WB 检测
配制Tricine 凝胶,用架子夹好后放入电泳槽内,在架子中央倒满电泳液并在电泳槽内倒入电泳液没过底部导线,分别在胶孔中按照一定顺序点蛋白质样品(10 μL);SDS-PAGE 胶电泳条件160 V, 70 min,无需冰上电泳;Tricine 胶电泳条件80 V,20 min,然后增至160 V,1 h 20 min,需要冰上电泳。期间用无SDS 转移液浸泡海绵垫片及滤纸,处理PVDF 膜(PVDF 膜剪成5.5 cm×8.5 cm,在其中一面左上角做好标记,20 mL 甲醇在摇床上摇动浸泡5 min,加入60 mL 水摇动浸泡2 min,无SDS 转移液浸泡15 min,电泳结束后在胶的左上角做好标记,浸泡于无SDS 转移液中,10 min)。垫片-3 层滤纸-胶-膜-3 层滤纸-垫片的顺序压好并放入转膜槽,膜对着正极,胶对着负极;加入SDS 转移液和冰盒,放于冰中;70 min,90 V。之后将PVDF 膜放入30 mL 10%脱脂牛奶中,1.5 h;20 mL10%脱脂牛奶中加入5 mL 一抗(一抗为Anti-OsPR1A,Anti-OsHSP),慢摇5 min,放入PVDF 膜,常温慢摇3 h 或4 ℃ 过夜。TTBS 冲洗5 min,重复3 次。20 mL 10%脱脂牛奶中根据一抗加入2 mL 兔二抗或1 mL 鼠二抗(二抗与5%牛奶比例为1∶10 000),放入PVDF 膜,慢摇1.5 h。TTBS 冲洗5 min,重复3 次。1 mL 显色液充分滴淋于PVDF 膜上,曝光显影。通过Lane 1D 采集信号。
1.4 水稻非生物胁迫的处理
水稻非生物胁迫(冷、热、旱、淹、盐、光照)等处理材料和方法参考文献[7],其建立了水稻幼苗胁迫处理的蛋白质样品资源库。将4021 水稻浸种2 d 后种于盆中,保持泥土湿润,27 ℃,12 h 光照/12 h 黑暗培养3 周后,按照4 ℃、44 ℃、48 ℃,旱、淹、盐,全黑暗和全光照对水稻幼苗进行处理,按照不同时间点对地上部分进行取材,电泳,然后WB 检测。
1.5 水稻活体的光照处理
将4021 水稻种子浸种发芽后,以土培培养方式培育水稻幼苗,待处理的水稻幼苗分别置于全黑暗、全光照、12 h 光照/12 h 黑暗的光照环境中,3 组温度均控制在27 ℃,以0、1、2、3、4、5、6、7、和8 d 时间点分别对3 种不同光照条件下的水稻取材并拍照。
1.6 水稻叶片的遮光处理
将土培30 d 的活体叶片用锡纸包住5 cm,27 ℃ 条件下24 h 光照培养5 d,将锡纸取下拍照后,分别取叶片被遮光部分和未遮光部分,提取总蛋白,进行WB 分析。
1.7 水稻离体叶片的遮光处理
将4021 水稻种子浸种发芽,以土培培养方式培育水稻幼苗,将水稻叶片剪约2 ~3 cm 长,培养皿内倒入无菌水,每个培养皿内放水稻叶片数片,将培养皿分为3 组,分别置于全黑暗、全光照、12 h 光照/12 h 黑暗的光照环境中,3 组温度均控制在 27 ℃,以0、1、2、3、4、5、6 和7 d 时间点分别对 3 种不同光照条件下的水稻离体叶片取材并拍照。
2 结果与分析
2.1 OsPR1A 蛋白质对非生物胁迫的响应
病程相关蛋白质各家族成员,在植物抗性反应中的分工各有不同,OsPR1A 在受病原菌诱导和激素调节等方面发挥重要作用,而对非生物胁迫响应情况尚不明确。非生物胁迫处理结果如图1 所示,在冷和48 ℃热处理条件下,OsPR1A 表达整体上比对照有所上调,但随时间变化规律并不明显;PEG6000 模拟干旱、淹和盐处理条件下,OsPR1A蛋白质表达不明显;而对于光照的响应最为强烈,全黑暗条件下OsPR1A 表达量基本呈现逐渐下降趋势,全光照下OsPR1A 表达量逐渐升高。因此,OsPR1A 在活体水稻幼苗中的表达是受光的诱导。
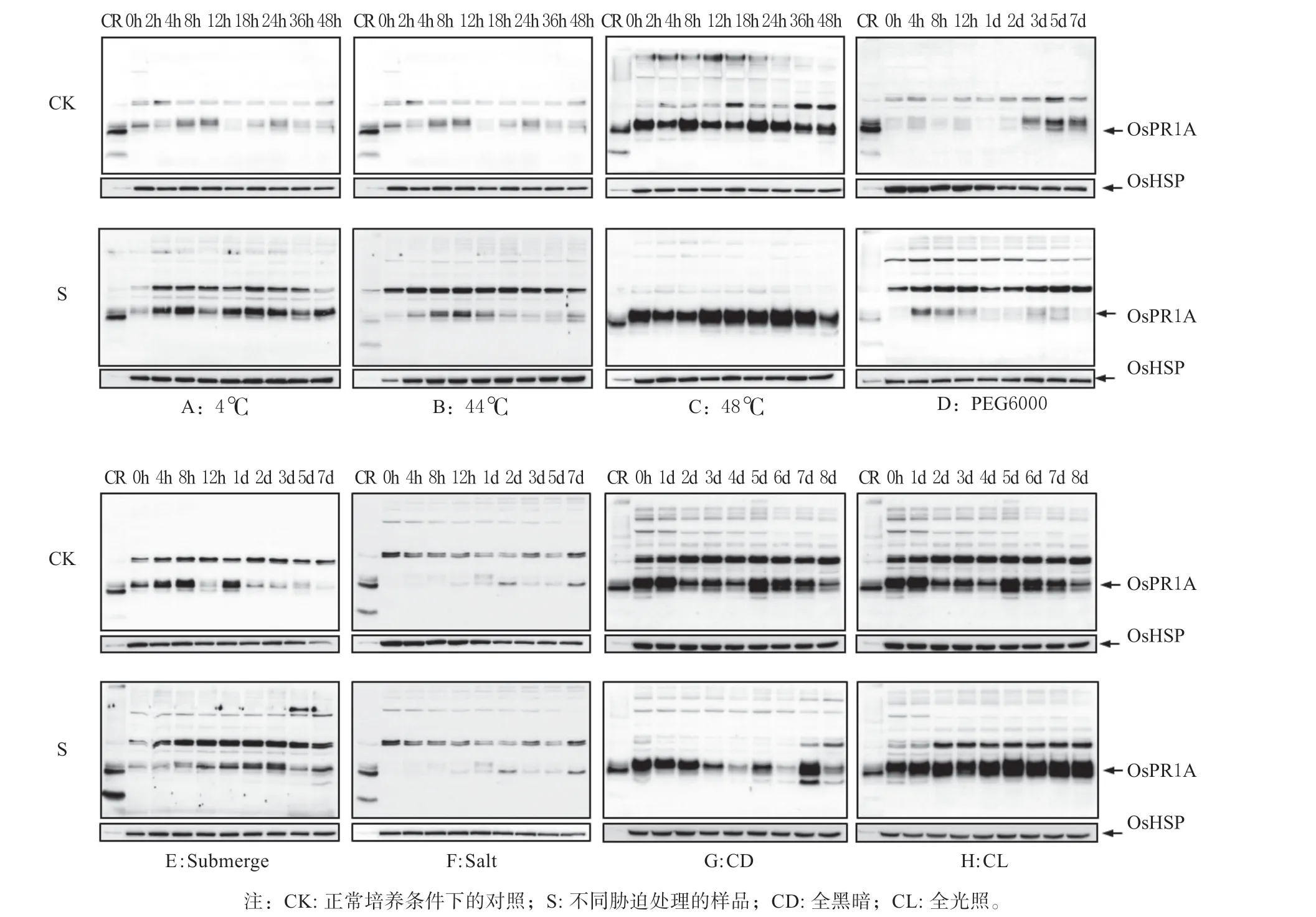
图1 水稻OsPR1A 在非生物胁迫下的表达Fig. 1 Expression of rice OsPR1A protein during abiotic stress treatments
2.2 OsPR1A 蛋白质在不同光照条件下的表达情况
2.2.1 活体水稻幼苗OsPR1A 蛋白质在不同光照条件下的表达情况 为了进一步说明OsPR1A 蛋白质对光的响应,单独对水稻进行光照处理和水稻叶片取材。全黑暗条件下,叶片随着时间的延长逐渐下垂,而全光照条件下,水稻幼苗叶片生长情况良好。取叶片进行WB 检测OsPR1A 蛋白质的表达情况。结果表明,全黑暗下OsPR1A 表达量总体呈下调趋势,而全光照下OsPR1A 表达量逐渐上调(图2),与图1 的水稻地上部取材结果一致。为了进一步验证该试验结果的可靠性和稳定性,以及保证光照不因为取材时间而被打破,接着进行了活体叶片遮光处理。

图2 水稻幼苗OsPR1A 蛋白质在不同光照条件下的表达Fig. 2 Expression of OsPR1A protein in rice seedlings under different light conditions
2.2.2 活体水稻幼苗OsPR1A 蛋白质在遮光条件下的表达情况 为了使光照条件更加具有连续性和一致性,用锡箔纸包裹进行遮光处理(图3A),光照培养5 d 后,将锡箔纸取下,被遮光部分出现叶片变黄的现象(图3B)。经WB 检测发现,锡箔纸全黑暗处理部分OsPR1A 表达量下降,温室培养的未遮光部分的叶片中OsPR1A 表达量高(图3C)。由此证实,遮光处理可以抑制OsPR1A 的表达。

图3 遮光处理对水稻幼苗OsPR1A 蛋白质表达的影响Fig. 3 Effects on the expression of OsPR1A protein in rice seedlings with shading treatment
2.2.3 水稻离体叶片中OsPR1A 在不同光照环境下的表达情况 对离体叶片进行光照处理,比活体材料易于操作、受光均匀且数据稳定。由结果可见,随着时间的延长,3 组叶片都出现了变黄的现象,且变黄程度为:全黑暗>12 h 光照/12 h 黑暗>全光照(图4A)。进行WB 检测后发现,全黑暗环境下OsPR1A 表达量很低,12 h 光照/12 h 黑暗下OsPR1A 表达量有所提升,全光照下OsPR1A 表达量最高(图4B),进一步证实光照可诱导OsPR1A的表达。


图4 水稻离体叶片中OsPR1A 蛋白质在不同光照条件下的表达Fig. 4 Expression of OsPR1A protein in rice leaves in vitro under different light conditions
3 讨论与结论
病程相关基因根据其序列的相似性、编码的蛋白质活性和结构等分为17 个家族。PR1 基因经常被作为抗病反应的标记基因[8],PR1 家族具有类丝氨酸羧肽酶活性。PR2 具有β-1,3 葡聚糖酶活性,PR3、PR4、PR8 和PR11 具有几丁质酶活性,这些家族成员可能通过破坏病菌细胞壁,对植物起到保护作用[1,9]。PR6 是蛋白酶抑制剂类,可以有效抑制昆虫进食或病菌蛋白酶的活性[10]。PR9 具有过氧化物酶活性,通过调节酶的活性来平衡正常生长发育中过氧化氢的积累和抗性反应中过氧化氢对病菌的抑制作用[11]。PR12 是植物防御素类,形成一套天然的防御系统以对抗病原菌的侵染[12]。
水稻中共有900 多个PR 基因,种类繁多,功能多样,即使同一家族成员有相互协作又各自分工。PR 基因除了在抵抗各种生物胁迫,如水稻白叶枯病菌、稻瘟病菌和纹枯病菌等外[13],在非生物胁迫中也发挥着重要作用。植物对非生物胁迫的生理生化反应具有组织器官特异性,冷主要发生在叶片 中[14],盐发生在根[15]和叶鞘基部[16],旱发生在叶 片[17]和叶鞘[18],但不同器官的应激反应也是共同的,只是存在时间进程上和灵敏度上的差异。水稻幼苗受冷胁迫时,与糖代谢、脂代谢等能量相关蛋白质被激活,应激相关蛋白质迅速上调,而防御相关蛋白质在长期低温胁迫下消失[19]。在水分充足的水稻根系中,热激蛋白完全缺失,而干旱胁迫下,病程相关蛋白普遍上调,包括6 个几丁质酶、PR10 家族Bet v I 和RSOsPR10 以及PR5 的类甜蛋白质家族成员等[20]。本试验研究表明,在冷和48 ℃热处理条件下,OsPR1A 表达随处理时间进程比对照有所上调,而干旱、淹和盐处理条件下,OsPR1A 蛋白质表达不明显。
光照是影响植物生长发育的最重要的环境因子之一,适宜的光照也是植物建立一套完整的防御反应的必要条件。不合理的光照,如黑暗或庇荫也属于非生物胁迫范畴,密植条件下植物优先选择避荫 而不是防御[6]。JA 和H2O2能诱导OsPR1a 和 OsPR1b 的表达,而黑暗处理即大大降低其表达[2]。 水稻光敏色素三突变体中(phyAphyBphyC),OsPR1a 和OsPR1b 的转录水平显著低于野生型,新叶和老叶都对稻瘟病菌敏感,表明水稻对稻瘟病菌的抗性可能是通过调节JA 或水杨酸(Salicylic acid, SA)依赖的防御途径而实现的[21]。促分裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)系统由MAPKKK-MAPKK-MAPK 组成,在水稻中约有75 种MAPKKK[22]、9 种MAPKK[23]和17 种MAPK[24]。敲低OsMPK6 可以提高水稻对白叶枯病菌的抗性,同时伴随着SA 的积累和OsPR1a 转录水平的增高,说明OsMPK6 参与了SA 的防御信号转导途径[25]。茉莉酸甲酯(Methyl jasmonate, MeJA)处理水稻离体叶片后OsMPK17 蛋白质表达丰度下降,而超表达OsMPK17 却增强了水稻的耐旱性[26],暗示OsMPK17 可能负调控JA 介导的抗性反应,而正调控脱落酸(Abscisic acid, ABA)介导的抗旱等非生物胁迫反应。WRKY 家族是最大的转录因子家族之一,参与水稻的激素信号转导、生物和非生物胁迫、发育和代谢过程等,粳稻品种日本晴中鉴定到89 个WRKY 成员[27]。采用微量热泳动技术,发现WRKY42 与病程相关基因OsPR1a和OsPR1b 启动子区顺式元件W-box 的互作[28]。
本试验结果表明,OsPR1A 无论是在活体中还是在离体中都受光的诱导,光可通过光敏色素将信号传递给激素,进一步调节植物防卫反应。本课题组通过WB 分析,初步研究证实JA 处理也可使OsPR1A 蛋白质表达量升高。由此可见,OsPR1A可能是多条信号途径的共同元件,来最终平衡生长发育和抗性反应的关系,以利于植物适应各种环境变化。本研究旨在建立OsPR1A 蛋白质的光照/ JA/ Xoo 的诱导表达平台,并“基于抗体的水稻蛋白质组学”策略,利用实验室前期积累的和文献查阅的大量MAPK、WRKY 和PR 等的抗体,通过WB、转基因和突变体等技术,找出不同信号通路的关键元件及处于中心枢纽的公共元件,深入研究光照及其它胁迫-激素-生长/ 防御的信号转导通路,并为水稻抗病分子育种奠定坚实的基础。

