贝莱斯芽孢杆菌(Bacillus velezensis)CF57 中 烟嘧磺隆降解酶的分离与鉴定
张晨芳,司贺龙,陈 来,梁小菊,张金林
(1.河北农业大学 植物保护学院,河北 保定 071001;2. 河北省唐山市丰南区丰南镇农业技术推广站, 河北 唐山 063300)
烟嘧磺隆作为我国玉米田除草剂的主导品种,随着其多年来大量使用和不规范滥用,对环境生态及农业经济的发展造成了巨大影响[1-5]。目前人们对烟嘧磺隆污染的关注度很高,解决环境中烟嘧磺隆的残留问题愈发迫切。因此,采用高效合理的方法将其对环境所产生的负面影响降到最低,已成为目前亟待解决的问题。相关研究表明,微生物修复因其安全、高效、成本低、对环境友好等特点,已成为目前解决磺酰脲类除草剂在环境中残留的重要手段之一[6-13],而微生物对农药的降解作用主要是由其分泌的降解酶来完成的[14,15]。但是,目前对于降解酶方面的研究则屈指可数[14,16-18]。
降解酶作为一种具有生物活性的物质,本身具有催化剂的性质。直接采用酶来降解农药比降解菌本身更具有优势,主要表现为降解酶在环境适应性和相容性、对底物浓度耐受性及降解率等方面均优于降解菌。因此,酶的分离纯化是酶学研究过程中的重要组成部分,也是对酶进行深入研究的必备条件。已知绝大多数的酶属于蛋白质,因此酶的分离纯化也经常按照蛋白的分离纯化方法进行[19]。蛋白质分离纯化的方法主要是根据蛋白质之间的的特性差异进行的,主要包括溶解度、分子量的大小、所带电荷、酸碱度、吸附性质及对配体的生物学亲和力。分离纯化所用到的方法主要有离子交换层析、亲和色谱、毛细管电泳、SDS-PAGE、PAGE 电泳、疏水层析、超滤、盐析、凝胶过滤层析、等电点沉淀、有机溶剂沉淀等。
本试验以贝莱斯芽孢杆菌(Bacillus velezensis)CF57 作为研究对象,通过降解酶定域试验及分离纯化,从而获取对烟嘧磺隆具有良好降解活性的降解酶。本研究对于丰富烟嘧磺隆降解酶资源及后续深入研究降解酶的分子生物学、酶学特性、生物信息学、降解机理等具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 贝莱斯芽孢杆菌(Bacillus vele- zensis)CF57(保存于河北农业大学植物保护学院农药学实验室)。
1.1.2 主要供试试剂和仪器 烟嘧磺隆原药(纯度:97.5%,保存于河北农业大学植物保护学院);丙酮(分析纯,天津市大茂化学试剂厂);DEAE-FF 阴离子交换柱(5 mL 预装柱,北京博尔西生物科技有限公司);蛋白纯化仪(AKTA,GE);高效液相色谱仪(Agilent 1200,美国安捷伦公司);超声波细胞破碎仪(Scientiz-IID,宁波新芝生物科技有限公司)。
1.1.3 供试培养基 参照Lu[13]具体培养基配方。
1.2 试验方法
1.2.1 烟嘧磺隆降解酶的定域试验 挑取贝莱斯芽孢杆菌(Bacillus velezensis)CF57 单菌落接种于LB液体培养基中,于30 ℃、150 r/min 条件下振荡培养96 h。取出培养好的菌液于6 000 r/min 离心10 min 后,分别收集上清和沉淀。按照丙酮沉淀法[13]将上清液用于提取胞外酶;沉淀重悬于K2HPO4-KH2PO4缓冲液(pH=8.0)中,根据渗透休克法提取周质酶[20];剩余沉淀重悬于50 mmol/L Tris-Cl 缓冲液(pH=8.0)中,短暂超声破碎后,离心收集上清液即为胞内酶。
1.2.2 蛋白质含量测定 按照Bradford 法[21]测定各蛋白组分的含量。
1.2.3 酶活力测定 ①水解圈法。在含有2 000 mg/L 烟嘧磺隆的水琼脂平板上打孔,取20 μL 降解酶液滴加至孔洞中,并设溶解该降解酶的等量缓冲液作为空白对照。于35 ℃反应30 min 后,通过比较不同酶液“透明圈”直径,直观反应各酶液对烟嘧磺隆的降解活性。
②酶液反应体系法。将降解酶添加至烟嘧磺隆终浓度为10 mg/L 的Tris-Cl 缓冲液(pH=7.0)中,于35 ℃反应30 min。每个处理3 个重复,并以失活酶作为空白对照。利用HPLC 检测[22]各处理组中烟嘧磺隆残留量,每个处理重复3 次。1 个酶的活力单位(U)被定义为每min 催化1 μmoL 烟嘧磺隆所需要的酶量[16]。
1.2.4 胞外酶分离纯化 ①胞外酶提取方法优化。将培养96 h 的贝莱斯芽孢杆菌(B. velezensis)CF57发酵液于6 000 r/min 离心10 min,取上清液过0.22 µm滤膜。在冰浴中,按照菌液∶丙酮=1∶1、1∶2、1∶3、1∶4和1∶5(v∶v)的比例缓慢加入预冷丙酮,充分混匀后,4 ℃静置过夜。于9 000 r/min 离心30 min,收集沉淀,并用Tris-Cl 缓冲液(pH=8.0)清洗3 遍后重悬。按照1.2.3 计算不同比例丙酮提取的胞外酶酶活力,并利用SDS-PAGE 检测不同比例丙酮所提取胞外酶中的蛋白种类。
②DEAE-FF 阴离子交换层析柱法。 利用K2HPO4-KH2PO4缓冲液(pH=7.5)(Buffer A)充分 平衡阴离子交换层析柱(1 cm×5 cm)后,将胞外粗酶液加载到层析柱中。以1.5 mL/min 流速,利用 Buffer A 洗脱基线至平衡后,用含有0 ~1 mol/L NaCl 的K2HPO4-KH2PO4缓冲液(pH=7.5)(Buffer B)对结合物进行梯度洗脱。收集各峰在280 nm 波长下光密度值高的部分,利用水解圈法初步判定各峰所收集蛋白组分是否具有烟嘧磺隆降解活性。
③Native-PAGE 法。利用Native-PAGE 法对具有降解活性的蛋白组分进一步分离。具体电泳条件为:10%分离胶,5%浓缩胶,上样量为20 μL。电泳结束后,切胶回收各分离条带,并采用水解圈法和酶液反应体系法对各分离组分的降解活性进行测定。
1.2.5 纯化酶的质谱鉴定 选取活性较高的3 个蛋白,送北京华大蛋白质研发中心有限公司进行质谱鉴定。将氨基酸序列上传至NCBI 数据库中进行序列比对,以确定所分离蛋白种类。
2 结果与分析
2.1 烟嘧磺隆降解酶定域试验
由图1 可知,胞外酶对烟嘧磺隆的降解活性最高,为0.005 9 μmoL/(min·mg),其次为周质酶,胞内酶对烟嘧磺隆的催化降解作用最小。由此可知,贝莱斯芽孢杆菌(Bacillus velezensis)CF57 对烟嘧磺隆具有降解作用的降解酶主要来源于胞外酶。
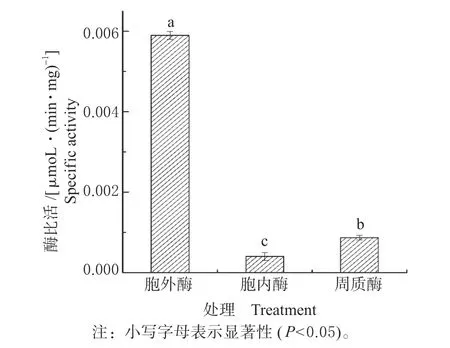
图1 烟嘧磺隆降解酶定域试验Fig.1 Localization of degradation enzyme in nicosulfuron
2.2 胞外酶提取
由表1 可知,以V菌液∶V丙酮=1∶1 比例提取的胞外酶与V菌液∶V丙酮=1∶2 ~1∶5 比例提取的胞外酶之间的酶比活存在显著性差异,而V菌液∶V丙酮=1∶2 ~1∶5 提取的胞外酶之间无显著性差异。
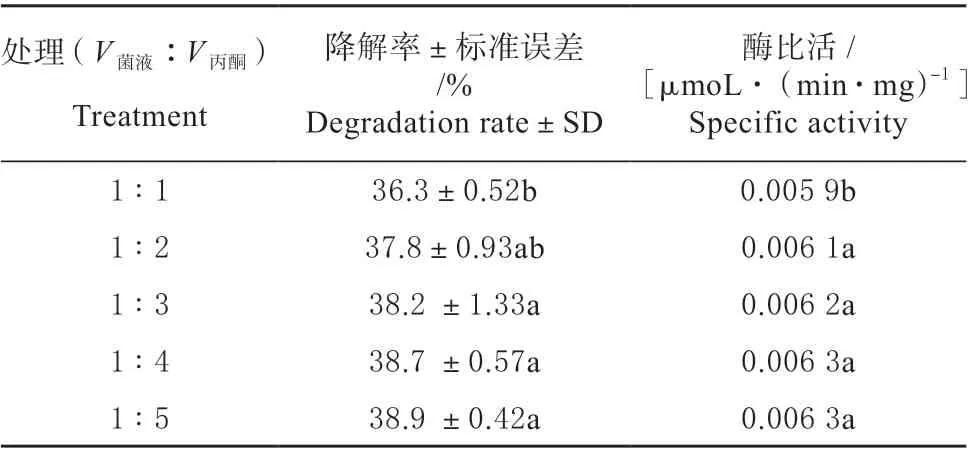
表1 不同比例丙酮提取的胞外酶活性测定Table 1 Determination of extracellular enzyme activity in different proportions of acetone extraction
进一步对不同比例丙酮提取的胞外酶进行SDSPAGE 检测发现(如图2 所示),不同比例提取的胞外粗酶中蛋白种类不存在明显差异。
综上,鉴于不同比例丙酮提取的胞外酶活力及所含蛋白种类,最终选择V菌液∶V丙酮=1∶2 作为提取胞外酶的最适比例。

图2 SDS-PAGE 检测不同丙酮比例提取的胞外酶Fig.2 SDS-PAGE detection of extracellular enzymes extracted with different acetone ratios
2.3 胞外酶的分离
2.3.1 DEAE-FF 琼脂糖阴离子交换层析柱分离 胞外酶经DEAE-FF 阴离子交换层析柱分离后,共得到5 个峰,分别命名为P1、P2、P3、P4 和P5(如图3 所示)。采用水解圈法对收集到的各峰进行定性活性检测。由图4 可知,从P2、P3 和P4 3 个峰收集到的蛋白质对烟嘧磺隆具有降解作用,而P1 和P5 收集到的蛋白质则无明显水解作用。因此,选择P2、P3 和P4 分离组分继续进行分离纯化。

图3 DEAE-FF 胞外酶分离色谱图Fig.3 DEAE-FF extracellular enzyme separation chromatogram

图4 DEAE-FF 分离组分活性验证Fig.4 Activity verification of separated components
2.3.2 Native-PAGE 分离 根据2.3.1 所得结果,采用Native-PAGE 对P2、P3 和P4 继续进行分离纯化。由图5 可知,P2 混合样品中共分离得到2 个蛋白组分,分别命名为P2-1 和P2-2;P3 混合样品中共分离得到4 个蛋白组分,分别命名为P3-1、P3-2、P3-3 和P3-4;P4 混合样品中共分离得到4 个蛋白组分,分别命名为P4-1、P4-2、P4-3 和P4-4。

图5 Native-PAGE 法分离蛋白Fig.5 Protein isolation by Native PAGE
2.3.3 分离组分的活性检测 首先采用水解圈法对分离得到的10 个蛋白组分进行定性活性验证。由图6 可知,所得10 个分离组分在相同点样量的情况下均对烟嘧磺隆具有降解作用。

图6 水解圈法定性检测分离组分活性Fig.6 Activity detection of isolated components by hydrolysis circle method
结合水解圈法活性检测结果,进一步利用酶液反应体系法对分离组分进行定量活性检测。由图7 可知,P3-4、P4-2 和P4-4 3 种酶对烟嘧磺隆的降解活性最高,分别为0.041 8、0.036 8 和0.038 2 μmoL/(min·mg)。因此,选择这3 个降解酶进一步进行质谱鉴定。
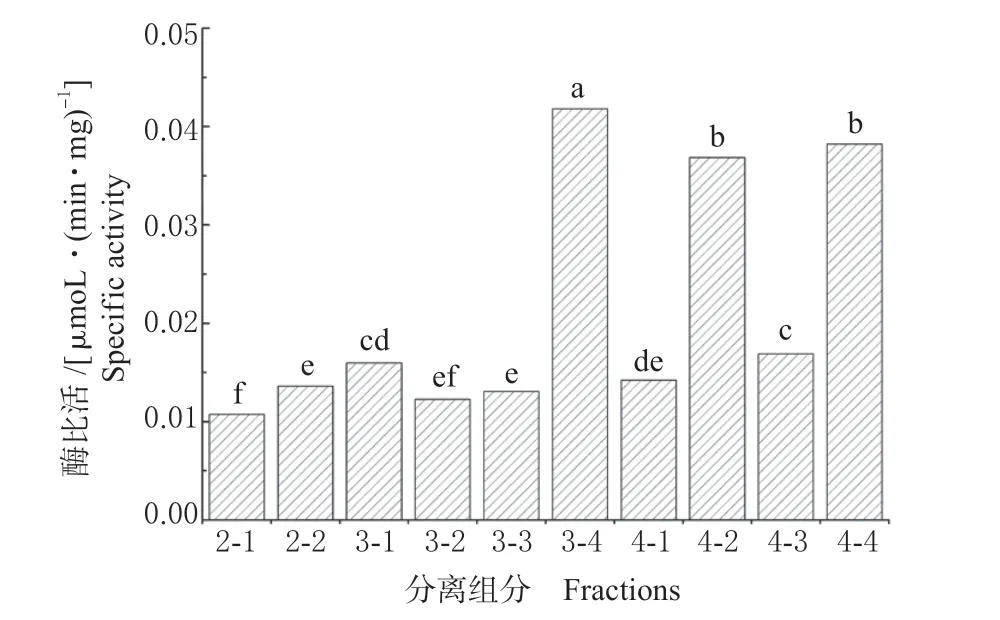
图7 酶液反应体系法检测各分离组分活性Fig.7 Activity detection of isolated components by enzyme reaction system
2.4 降解酶质谱鉴定
P3-4、P4-2 和P4-4 经质谱鉴定后,将所得氨基酸序列上传至NCBI 数据库。通过BLAST 在线序列比对得知,这3 种降解酶分别为糖磷酸异构酶(P3-4)、亮氨酸氨基肽酶(P4-2)和精氨酸酶(P4-4)。
3 结论与讨论
本研究以贝莱斯芽孢杆菌(B. velezensis)CF57作为研究对象,经降解酶定域试验明确菌株CF57对烟嘧磺隆其降解作用的主要部位为胞外,属于胞外酶。该项结果与赵卫松[23]、康占海[14]等所得的菌株ZWS11 和YB1 对烟嘧磺隆具有降解作用的酶主要为胞外酶的结论相一致。在胞外酶粗分离过程中,采用了丙酮沉淀法。已有研究表明,相比较于硫酸铵沉淀法,采用丙酮沉淀法提取得到的胞外酶不仅蛋白浓度高,而且对烟嘧磺隆的降解活性也相对较高[23]。通过进一步对丙酮沉淀法进行优化,得到发酵液与丙酮最适体积比为1∶2。
在此基础上,利用DEAE-FF 阴离子交换层析和PAGE 法进一步对胞外酶进行分离纯化,共得到10种蛋白质组分。经活性检测发现,所得10 种蛋白质组分均对烟嘧磺隆具有降解活性。选择其中活性较高的3 种降解酶进行质谱测定,得到这3 种降解酶分别为糖磷酸异构酶、亮氨酸氨基肽酶和精氨酸酶。该研究是这3 种酶在除草剂修复方面的首次报道,不仅丰富了烟嘧磺隆降解酶资源,而且证明了这3种酶均具有催化混乱性[24]。
由于自然菌株存在产酶量少、不稳定、不易存储等缺陷[25],因此在后续工作中,将进一步借助基因工程及酶工程实现酶的异源表达,提高酶的表达量并拓宽其作用底物。酶的分离纯化是后续深入研究酶的各种性质的分子基础,为进一步深入探究酶结构与功能、降解机理及活性优化等奠定了理论基础。

