术中输液加温对开腹胃肠道手术患者组织氧合灌注和苏醒期的影响
杨雪莹,张雪荣,徐永腾
腹部开腹手术操作复杂、耗时长、输液输血量多,较腹腔镜术式更易导致患者低体温[1]。围手术期体温过低的发生率在50%~70%之间[2]。一项纳入1105例患者的回顾性研究中统计,接受剖腹手术的患者低体温发生率为18.7%[3]。体温的最大变化发生在全麻诱导后的60 min 内,因此,当手术时间超过30 min 时,应监测患者的体温[4]。由于麻醉会破坏体温调节和生理机制,当患者接受全身麻醉或大范围区域麻醉(例如硬膜外麻醉)超过60 min时,患者的核心温度通常会下降0.5℃~1.5℃[5]。围手术期低体温对患者危害大,可导致患者麻醉苏醒延迟、术后寒颤、术后伤口感染、心血管并发症、凝血功能异常和住院时间延长等并发症[6]。也有研究发现低体温与患者急性呼吸窘迫综合征发生相关[7]。目前围术期常用保温方式包括调节室温、采用电热毯、身体覆盖、冲洗液加温以及静脉输液加温等[8]。研究证实在腰麻下行剖宫产术中应用输液加温可预防产妇体温过低,减少产妇寒颤,提高产妇热舒适性[9]。一项对休克病人控制性降温的研究中发现,目标体温33℃组患者血清乳酸水平明显高于目标体温36℃组患者[10]。本研究拟观察术中输液加温对开腹胃肠道手术患者组织灌注和苏醒期的影响,为临床提供参考。
1 资料与方法
1.1 一般资料
选择我院开腹胃肠道肿瘤手术患者60 例,年龄18~65 岁,体质量指数BMI<30 kg/m2,ASA Ⅰ~Ⅱ级。排除术前心肺肝肾功能异常,合并心脑血管疾病、贫血,体温异常,麻醉药物过敏史的患者。采用随机数字表法其分为对照组、输液加温组(加温组),每组各30 例。本研究经医院伦理委员会批准,研究内容已告知患者知情同意。
1.2 麻醉方法
患者入室后开放外周静脉通道,局麻下行外周动脉穿刺置管术,成功后连接FloTrac/Vigileo 监护仪及ABP 传感器,持续监测MBP、HR、SpO2、CO、CI、SVV、SVI 和及BIS。麻醉诱导:依次静脉注射咪达唑仑0.05 mg/kg、舒芬太尼0.4 μg/kg、顺式阿曲库铵0.2 mg/kg、丙泊酚2~2.5 mg/kg,待肌松完全后行气管插管术,机械通气,吸入50%氧浓度空气。麻醉后监测鼻咽温并行右侧颈内静脉穿刺置管,深度(cm)=身高(cm)×0.06+4[11],监测中心静脉压(CVP)以及采集静脉血。术中以每搏量变异度SVV<13 为目标行目标导向输液方案(滴注复方氯化钠注射液与6%羟乙基淀粉注射液)。对照组患者采用常规保温措施(室温22℃以上、身体覆盖、预热腹腔冲洗液、术后采用暖风机复温);加温组患者在常规保温措施的基础上术中使用输液加温仪(3M Ranger, 245,美国)持续输液加温,温度设置为41℃。以七氟醚+丙泊酚+瑞芬太尼维持术中麻醉,维持BIS 40~60,术毕前30 min 停止追加顺式阿曲库铵,术毕送麻醉恢复室复苏,予暖风机复温。两组患者术后镇痛方案一致。
1.3 观察指标
记录两组患者麻醉诱导前10 min(T0)、手术开始时(T1)、手术开始1 h(T2)、手术开始2 h(T3)、术毕(T4)时的鼻咽温、中心静脉血氧饱和度(ScvO2)和动脉血乳酸(ABL);比较两组患者麻醉苏醒期自主呼吸恢复时间、拔管时间、PACU 停留时间,寒颤、躁动发生率,躁动评分(RS)、Ramsay 镇静评分(RSS)及患者麻醉满意度。
1.4 评分标准
参考文献[12]中量表对寒颤进行分级:其中0级:无颤抖;1 级:毛勃起或外周血管收缩,但无明显颤抖;2 级:仅一个肌肉组的肌肉活动;3 级:多个肌肉组的肌肉活动,但不是全身性的;4 级:全身颤抖。RS评分:0分,安静且合作;1分,刺激时有肢体活动,用语言安慰可改善;2 分,无刺激时有挣扎,但无需按压;3 分,挣扎剧烈,需多人按压。RSS 评分:1 分,不安静,烦躁;2 分,安静、合作;3 分,嗜睡,能听从指令;4 分,睡眠状态,可唤醒;5 分,呼唤反应迟钝;6 分,深睡状态,呼唤不醒。
1.5 统计分析
采用SPSS 20.0 统计软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检
验;无序计数资料采用χ2检验,有序计数资料采用秩和检验;设定P<0.05 为差异有统计学意义。
2 结 果
2.1 两组患者一般情况的比较
两组患者年龄、性别构成、体质量指数(BMI)、ASA 分级、手术室温度、手术时间、输液量、出血量差异无统计学意义(P>0.05,见表1)。
2.2 两组患者鼻咽温、ScvO2、ABL 比较
两组基础值T0时(ScvO2指标基础值为T1时)的鼻咽温、ScvO2、ABL 差异无统计学意义(P>0.05);对照组内,与基础值T0时相比,T2、T3、T4时的鼻咽温、ScvO2(与T1时比较)逐渐下降,差异有统计学意义(P<0.05),乳酸逐渐升高,但差异无统计学意义。加温组内,各时间点间鼻咽温、ScvO2、ABL差异均无统计学意义。T2、T3、T4时,加温组鼻咽温及ScvO2均较对照组高,差异均有统计学意义(P<0.05),ABL 较对照组低,但差异无统计学意义。见表2。
表1 两组患者一般情况比较( ± s)
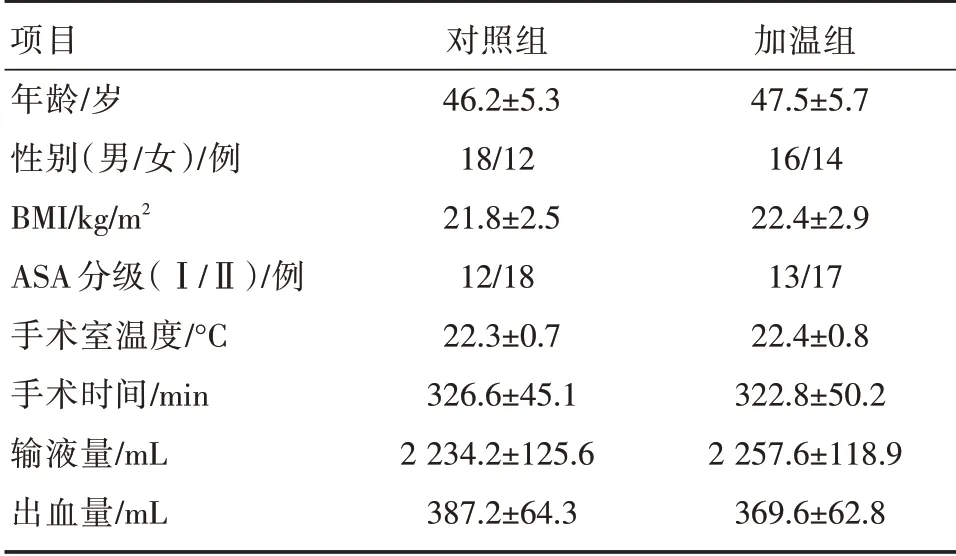
表1 两组患者一般情况比较( ± s)
项目年龄/岁性别(男/女)/例BMI/kg/m2 ASA 分级(Ⅰ/Ⅱ)/例手术室温度/°C手术时间/min输液量/mL出血量/mL对照组46.2±5.3 18/12 21.8±2.5 12/18 22.3±0.7 326.6±45.1 2 234.2±125.6 387.2±64.3加温组47.5±5.7 16/14 22.4±2.9 13/17 22.4±0.8 322.8±50.2 2 257.6±118.9 369.6±62.8
表2 两组患者鼻咽温、ScvO2、ABL 变化比较( ± s)

表2 两组患者鼻咽温、ScvO2、ABL 变化比较( ± s)
注:与同组基础值T0 时比较(ScvO2指标基础值为T1 时),aP<0.05;与同一时刻对照组比较,bP<0.05
指标鼻咽温/°C ScvO2/%ABL/mmol·L-1组别对照组加温组对照组加温组对照组加温组T0 36.2±0.3 36.3±0.4 0.7±0.2 0.8±0.2 T1 36.0±0.4 36.2±0.4 75.9±4.4 75.5±4.2 0.7±0.2 0.8±0.2 T2 35.3±0.4a 36.1±0.3b 71.1±4.8a 74.7±4.5b 0.8±0.3 0.7±0.3 T3 35.0±0.3a 36.1±0.4b 70.8±4.3a 74.4±4.6b 0.9±0.3 0.8±0.3 T4 34.8±0.4a 36.0±0.5b 69.5±3.7a 73.9±4.4b 0.9±0.4 0.8±0.3
2.3 两组苏醒时间及PACU 停留时间比较
与对照组相比,加温组自主呼吸恢复平均缩短12.4 min,拔管时间缩短15.3 min,PACU停留时间缩短18.2 min,差异均有统计学意义(P<0.05)。见表3。
表3 两组患者苏醒时间及PACU 停留时间比较( ± s)
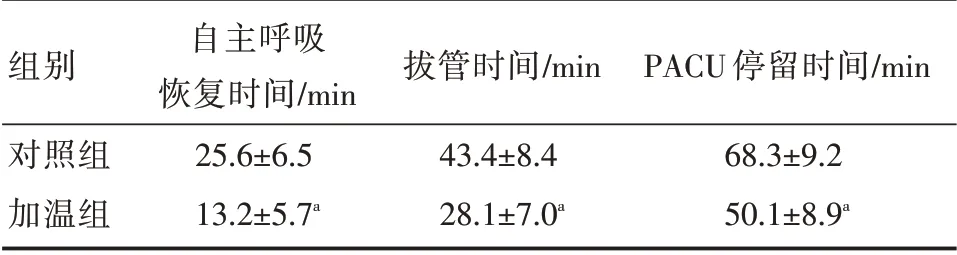
表3 两组患者苏醒时间及PACU 停留时间比较( ± s)
注:与对照组比较,aP<0.05
组别对照组加温组自主呼吸恢复时间/min 25.6±6.5 13.2±5.7a拔管时间/min 43.4±8.4 28.1±7.0a PACU 停留时间/min 68.3±9.2 50.1±8.9a
2.4 两组麻醉苏醒期寒颤、躁动发生率比较
从表4可见,与对照组相比,加温组苏醒期寒颤及躁动发生率更低,差异均有统计学意义(P<0.05)。对照组患者中寒颤1 级1 例、2 级2 例、3 级4例、4级3例,加温组患者中寒颤1级2例、2级2例。
2.5 两组苏醒期RS、RSS 评分及患者麻醉满意度比较
从表5 可见,在麻醉苏醒期,与对照组相比,加温组患者RS 评分明显降低,RSS 评分及患者麻醉满意度显著升高,差异均有统计学意义(P<0.05)。

表4 两组患者苏醒期寒颤、躁动发生率比较
表5 两组苏醒期RS、RSS 评分及患者麻醉满意度比较( ± s)
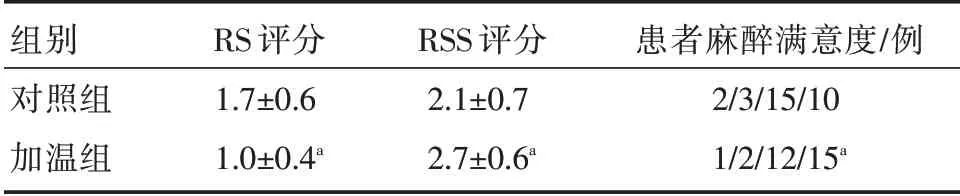
表5 两组苏醒期RS、RSS 评分及患者麻醉满意度比较( ± s)
注:患者麻醉满意度为(极不满意/基本满意/较满意/十分满意);与对照组比较,aP<0.05
组别对照组加温组RS 评分1.7±0.6 1.0±0.4a RSS 评分2.1±0.7 2.7±0.6a患者麻醉满意度/例2/3/15/10 1/2/12/15a
3 讨 论
围手术期皮肤接触、静脉输液、体腔冲洗液、麻醉、以及低室温是导致患者体温降低的主要原因。全麻抑制了正常的寒冷反应,通过肌肉松弛减少产热、扩张周围血管增加了热量的流失。在麻醉的早期阶段,是由于热量从中央到周围区域的重新分布而引起的核心温度的迅速下降,之后是逐渐下降,形成持续的热量损失。研究发现[13],在手术开始30 min、60 min、90 min 和120 min,以及手术结束时,输液加温可以使患者核心温度比室温静脉输液的患者高出0.41°C~0.74°C,也进一步降低了寒颤的风险(37% vs. 14.4%)。一项meta分析[14]显示,平均来说,核心体温低于正常值超过1.5°C 会导致副作用叠加效应,每名手术患者的住院费用增加2500 美元到7000 美元。本研究中麻醉后患者体温均有所下降,手术开始前平均下降约0.2°C;在采用常规保温措施的基础上加用术中持续输液加温的加温组患者可维持术中各点平均体温不低于36°C,而对照组患者随着手术时间延长体温逐渐下降,至手术结束平均体温最低至34.8°C,趋势与文献一致,但由于本研究中平均手术时间长达5 小时,且开腹体腔暴露面积大,体温下降幅度更明显。低体温延缓麻醉药物代谢,易致苏醒延迟[6]。本研究中加温组较对照组自主呼吸恢复时间、拔管时间、PACU 停留时间均更短,总体时间平均缩短18.2 min。
术后寒颤是一种令人不快且频繁的并发症,寒颤可能是体温过低或肌肉亢进伴阵挛或强直的一种热调节反应[15]。随着苏醒期麻醉药物代谢,患者肌力恢复,中枢体温调节阈值下调,低体温下机体出现肌肉活动(寒颤)以增加产热,但同时增加氧耗,释放大量儿茶酚胺类激素,导致患者应激,血乳酸升高,苏醒期寒颤的病人耗氧量可能会增加200%~500%,还会增加心脏负荷[16]。本研究中输液加温可使患者寒颤发生率明显降低(33.3% vs. 13.3%),提高了患者舒适感及麻醉满意度,其中对照组7 例患者主诉无法控制的寒颤,15 例患者主诉寒冷,16 例患者因寒颤或寒冷表示为麻醉满意度降低。术后躁动主要发生在苏醒期,机制可能是术后全麻药残余,作用于中枢系统,产生中枢局灶过敏化[17],疼痛刺激、尿管不适等均可诱发。本文结果显示输液加温组苏醒期躁动发生率也较对照组明显降低(26.7% vs. 6.7%),躁动评分(RS)明显降低、镇静评分(RSS)明显增高。
混合静脉氧饱和度SvO2代表全身氧供和氧耗平衡在组织水平的结果[18],但其操作复杂,多在危重病人使用。中心静脉氧饱和度ScvO2是通过中心静脉血血气分析测得,反映身体上半部分器官和脑的氧合状态,参考值68%~77%,因操作简便,与SvO2有良好的相关性(相关系数为0.86~0.97),在临床上常作为代替SvO2间接反映全身氧合状态的指标[19]。血乳酸ABL 是组织缺氧无氧酵解的特异性产物,正常人的动脉ABL<1.5 mmoL/L。ScvO2及ABL 均为临床反映机体组织氧合灌注的主要指标。本研究中发现术中输液加温可降低血乳酸升高幅度,维持血乳酸相对平稳,但与对照组相比差异无统计学意义,与文献[20,21]结果一致。本文结果显示,两组患者术中ScvO2均在正常范围内,但输液加温组手术开始1 h 至术毕的ScvO2明显高于室温组。ScvO2值主要受心排量、血容量、血红蛋白、低温、氧分压、氧耗因素影响[22],故在本研究中使用持续心排量监测及间断血气分析,吸入50%氧浓度空气,维持CO、SVV、血红蛋白在目标范围,尽量排除干扰因素。结果反映输液加温可维持良好组织氧合灌注,机制可能为长时间低体温下周围血管收缩,静脉血淤滞,减少组织血流量,心脏代偿做功氧耗增加,氧供减少。控制性低体温是临床上用于体外循环、脑功能保护、降低全身代谢的治疗方法之一,但长时间低体温及严重低体温仍会导致组织氧合障碍,血乳酸升高[23,24]。
综上所述,术中输液加温可保证开腹胃肠道手术患者术中良好组织氧合灌注,有利于快速麻醉复苏,明显减少患者麻醉苏醒期寒颤及躁动发生,提高患者麻醉满意度。本研究中样本量小,存在局限性,且对于患者远期预后的影响仍待进一步研究。

