磁共振扩散加权成像定量参数在新生儿低血糖脑损伤中的应用
谢 辉,兰为顺,杨文忠,余旭东,袁先宏,刘 萍
(湖北省妇幼保健院医学影像科,湖北 武汉 430070)
新生儿低血糖症脑损伤是新生儿时期由严重低血糖导致的中枢神经系统损伤性病变,是新生儿较为常见的代谢疾病之一[1-2]。长时间反复的低血糖可以造成不可逆的脑损伤,存活者常遗留有不同程度的智能低下,脑瘫痪等后遗症,给患者家庭和社会造成沉重的负担[3-4]。影像学早期的精准诊断可为临床提供重要信息,指导进行及时的干预。目前精确的低血糖定义、临床干预范围值及低血糖脑损伤临界值等方面尚存在争议[5-6]。磁共振成像是排查诊断新生儿低血糖脑损伤最常用、最敏感的手段,特别是功能序列扩散加权成像(DWI)技术的应用,其能准确地反映病变部位、范围及严重程度,可为新生儿低血糖脑损伤的早期精准诊断提供可靠的影像学依据[7-8]。文献中关于表观扩散系数(ADC)在新生儿低血糖症脑损伤诊断中的应用研究较少,本文旨在探究MRI常规序列及DWI 在新生儿低血糖脑损伤早期定量诊断中的价值。
1 资料和方法
1.1 一般资料
选取我院新生儿科2016 年6 月—2019 年1 月临床出院诊断为低血糖脑损伤的患儿,收集其临床、影像及检验结果等方面的完整资料。其纳入标准包括:①临床出院确诊为低血糖脑损伤;②有完整临床信息、MRI 资料(包括DWI 图像)及同期的扫描前低血糖值。排除标准: ①临床诊断不确切或其他诊断(缺血缺氧性脑病、颅内感染、败血症、遗传代谢病);②临床或影像资料不完整,或图像质量不佳致无法分析。最终有48 例患儿纳入研究分析,其中女15 例(占31.3%),男33 例(占68.7%),年龄3~16 d,平均8 d。早产儿8 例(占16.7%),平均35W+2;足月儿40例(占83.3%),平均38W+3。出生体质量平均3.4 kg。临床大多表现为吃奶差、拒奶、精神反应差、抽搐、惊厥等。根据新生儿的不同低血糖程度将病例分为3个亚组(血糖:a 组≤1.0 mmol/L,b 组>1.0~1.7 mmol/L,c 组>1.7~2.2 mmol/L),所有病例血糖值采用动态监测法得,并选取离MRI 扫描前最近时间的血糖值进行统计分析。
1.2 磁共振扫描方法
MRI 采用Siemens Espree 1.5T 机器,扫描序列包括T1WI(轴位、矢状位)、T2WI 序列、T2-FLAIR 序列和弥散加权成像序列(DWI:b 值0,1 000 s/mm2)。详细参数见表1。
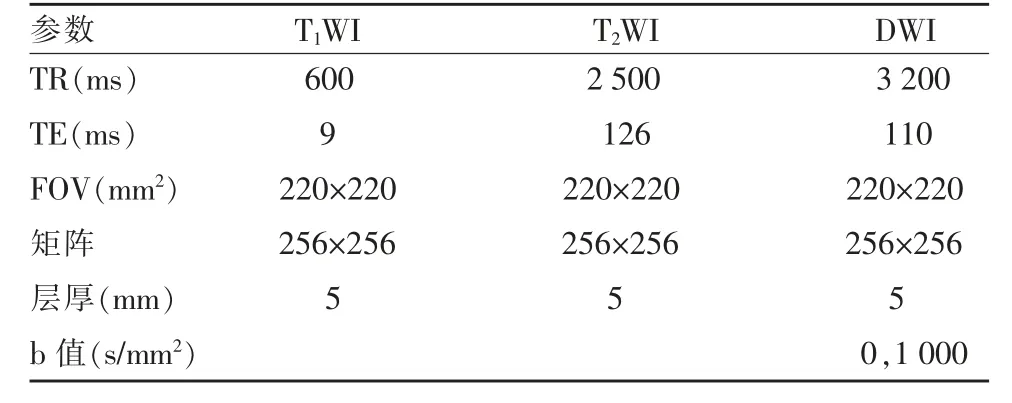
表1 磁共振扫描序列参数表
1.3 图像处理
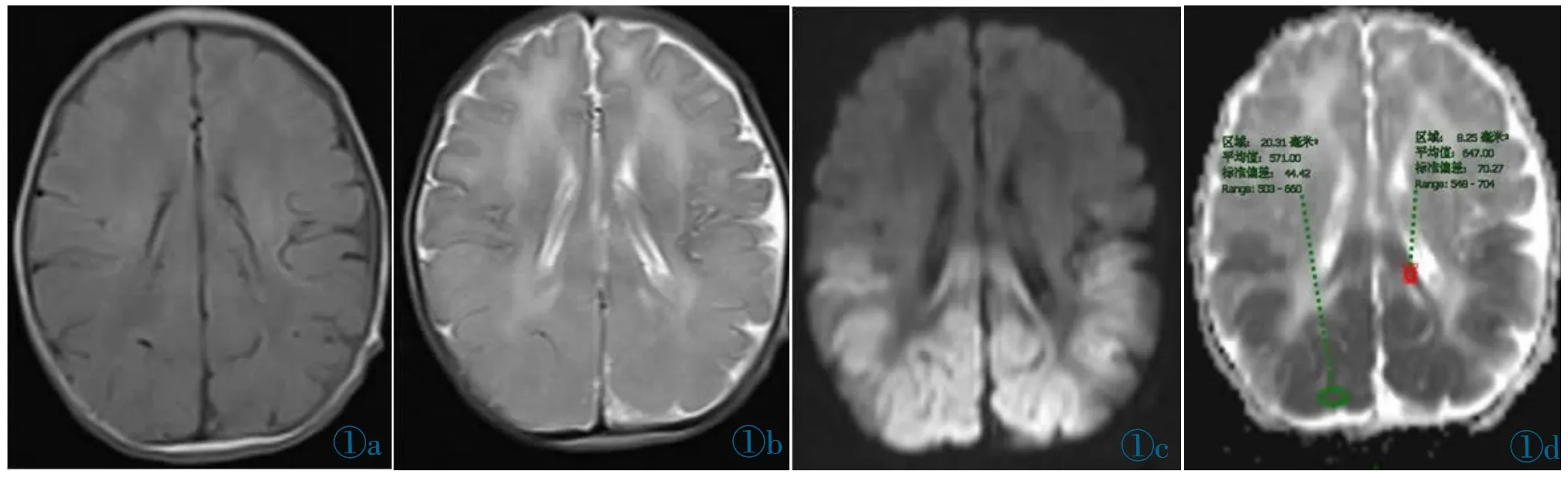
图1 男,5 天,血糖值0.8 mmol/L。图1a~1d 分别为T1WI、T2WI、DWI 及ADC 图。图1a,1b 显示双侧顶枕叶脑回肿胀,皮髓质分布不清,呈稍长T1 稍长T2 信号;图1c 显示双侧顶枕叶及胼胝体压部呈明显扩散受限高信号;图1d 示双侧顶枕叶及胼胝体压部ADC 值减低,大小约0.62×10-3 mm2/s。Figure 1.A 5-day-old boy has a blood glucose level of 0.8 mmol/L.Figure 1a~1d are T1WI,T2WI,DWI and ADC images respectively.Bilateral parieto-occipital gyrus is swollen,the cortex and medulla boundaries are unclear,showing slightly longer T1 and slightly longer T2 signals (Figure 1a,1b).The bilateral parieto-occipital lobe and the corpus callosum have a high diffusion-restricted signal (Figure 1c).ADC values of the bilateral parieto-occipital lobe and the corpus callosum are reduced,about 0.62×10-3 mm2/s(Figure 1d).
MRI 常规序列由两位影像科医师 (1 位初级职称、1 位高级职称)分别对图像进行判读诊断,最终根据两位医师的判读结果,取得一致后进行统计学分析。DWI 序列ADC 值用西门子后处理工作站由前述两位医师在隐藏病例临床信息后独立测得,并取两者测值的平均值进行统计学分析。感兴趣区(ROI) 由两位医师参考DWI 图及常规序列图在ADC 图上皮质区和白质区病灶最明显的区域分别画取(若白质区无病灶,则ROI 均选在皮质区),每个病例取皮质区和白质区所测ADC 值的平均值进行分析。ROI 面积平均值为11.2 mm2。
1.4 统计分析
统计软件为SPSS 23.0(SPSS,Chicago,Ⅲ),以P<0.05 为差异有统计学意义。所有参数首先行正态性检验(Kolmogorov-Smirnov test)和方差齐性检验(Levene’s test);单因素方差分析(One-Way ANOVA)用于比较不同血糖值分组间ADC 值的差异。使用Pearson 相关分析探究ADC 值与血糖值的相关性。结果均以P<0.05 为差异有统计学意义。
2 结果
2.1 病灶分布
在所有48 例患者中均发现扩散受限的异常高信号病变。44 例(91.7%)异常改变脑区累及双侧枕顶叶皮质及皮质下白质(图1),双侧顶枕叶31 例(64.6%),双侧枕叶4 例 (8.3%),单侧枕叶3 例(6.3%)。其中7 例仅累及双侧枕叶皮层,并有3 例呈偏侧分布(左侧枕叶)。有35 例(72.9%)胼胝体受累(图2),其中胼胝体压部全部受累,7 例(14.6%)累及膝部和体部。累及其他脑叶(额叶、颞叶)的共有9 例(18.8%)。内囊后肢受累的有5 例(10.4%)、视辐射受累7 例(14.6%);8 例有深部白质异常,其中基底节区3 例(6.3%),侧脑室旁白质5 例(10.4%);大范围受累(包括额顶颞枕叶或深部白质区)11 例。
2.2 MRI 表现
在脑实质受累部位,常规MRI 序列显示脑回肿胀,脑沟变浅,皮质和髓质分界不清,呈稍低T1稍高T2信号改变,DWI 信号增高,ADC 值减低(图1)。少数可见沿顶枕叶皮层分布的短T1信号,可能为皮层出血。大部分病例,在传统T1WI 和T2WI 上,内囊后肢、视辐射、胼胝体及深部白质区信号改变不显著;而在DWI 上则非常明显,主要是DWI 高信号 (图2)。本组48 例(100%)新生儿脑损伤都表现为DWI高信号,ADC 值减低。在28 例(58%)患者中,DWI显示病灶明显优于传统序列(T1WI、T2WI)。
2.3 不同低血糖程度分组间ADC 值的差异
ADC 值在不同低血糖严重程度分组(a,b,c)间有差异,a 组ADC 值 (0.62±0.17)×10-3mm2/s,b 组ADC 值(0.73±0.16)×10-3mm2/s,c 组ADC 值(1.03±0.10)×10-3mm2/s。随着低血糖严重程度增加,ADC值呈明显下降趋势,并有统计学差异(P<0.01)。ADC值与低血糖严重程度呈中等强度相关,相关系数r为0.761(图3)。

图2 男,5 天,血糖值1.5 mmol/L。图2a~2d 分别为T1WI、T2WI、DWI 及ADC 图。图2a,2b 显示双侧枕叶异常信号不明显;图2c 显示双侧枕叶及胼胝体压部呈明显扩散受限高信号;图2d 示双侧枕叶及胼胝体压部ADC 值减低,大小约0.83×10-3 mm2/s。Figure 2.A 5-day-old boy has a blood glucose of 1.5 mmol/L.Figure 2a~2d are T1WI,T2WI,DWI and ADC images respectively.Bilateral occipital abnormalities signal is not obvious(Figure 2a,2b).The bilateral occipital lobe and the corpus callosum have a high diffusionrestricted signal(Figure 2c).ADC values of the bilateral occipital lobe and the corpus callosum are reduced,about 0.83×10-3 mm2/s(Figure 2d).
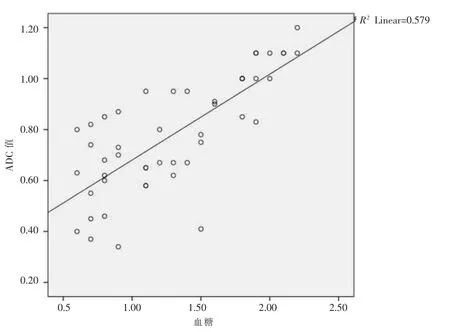
图3 ADC 值与血糖相关分析图,相关系数r 为0.761,呈中等程度相关关系。Figure 3.The ADC value and blood glucose correlation analysis chart,the correlation coefficient r is 0.761,showing a moderate correlation.
3 讨论
3.1 新生儿低血糖常见损伤部位及机制
文献报道显示,低血糖脑损伤的阈值尚不明确,其引起的脑损伤机制亦未得到充分认识[9-10]。葡萄糖的减少可以导致对脑的能量供应不足,脑细胞的代谢率降低,水分子进入细胞内的运动和细胞外水的容积显著减少。由于缺乏ATP 和磷酸肌酸引起细胞毒性水肿,最终导致神经细胞的变性、坏死[11-12]。当有症状的低血糖持续时间较长或反复发作时,脑细胞则发生充血、散在出血点、细胞水肿和点状坏死等病理改变,引起脑损伤[12]。以往的临床研究显示,双侧枕顶叶为最常受损的区域,低血糖可引起大脑多个部位的神经元及胶质细胞急性变性坏死,双侧枕叶受损最严重,颞叶最轻[13-14]。本文研究结果显示,双侧顶枕叶损伤的有44 例,占所有病例91.7%,与以往的研究[15]结果相符。新生儿低血糖脑损伤中双侧顶枕叶易受影响的机制尚不明确。相关的假说主要有以下几种:在新生儿期,枕部神经元结构形成导致该部位对葡萄糖的需求增加,因此对葡萄糖的缺失敏感并易导致损伤;原始视觉皮质较大,其内神经元及突触的生成较其他区域的皮质更多,因而对层状坏死也更为敏感[16-17]。本研究少部分病例的临床随访均表现为双侧枕顶叶萎缩及软化灶形成,也进一步证实了低血糖脑损伤中双侧顶枕叶易受累的特征。
3.2 低血糖脑损伤胼胝体受累机制
DWI 可敏感显示胼胝体的损伤,近年来随着DWI 在低血糖脑损伤中的应用,所报道的病例除存在顶枕叶的损伤之外,还常常伴有胼胝体压部异常[18]。本研究中,35 例胼胝体压部受损,约占72.9%。类似于其他研究报道的病变部位,表明胼胝体压部也是新生儿低血糖脑损伤易感区域。引起胼胝体压部损伤的机制尚未明确,影像表现提示细胞毒性水肿这一可能机制,但胼胝体属于深部白质,代谢率比较低,因此单纯细胞代谢能量减少不太可能引起相应的损害。另一种猜想机制是,胼胝体损伤继发于近端皮质神经元损伤,导致兴奋毒性氨基酸沿白质通路传播,从而导致远端深部白质变性和继发受损[16]。胼胝体压部的损伤在新生儿低血糖脑损伤中比较常见,应引起临床关注,密切观察和随访。
3.3 DWI 在低血糖脑损伤诊断中的价值
DWI 是一种无创显示组织结构中水分子微观运动的磁共振功能成像技术,能够敏感地发现血管外细胞外间隙和细胞内水分子弥散的异常。细胞毒性水肿的早期检测可以在一定程度上直观地反映新生儿脑损伤的部位和程度[19]。DWI 显示异常高信号,在正常T1WI 及T2WI 上不明显。本组48 例(100%)新生儿脑损伤显示DWI 高信号,ADC 图信号下降,仅20 例(41.7%)常规MRI 序列显示明显的信号异常,特点是T1WI 信号略低,T2WI 上的信号略高。DWI 显示病灶范围较常规MRI 大,特别是病灶累及内囊后肢、视辐射等深部白质区域时,常规序列通常难以发现。病灶在常规MRI 序列上信号轻度改变时,需靠影像医师仔细观察分析,其判断较为主观。以往研究结果[20-21]也证实DWI 在新生儿低血糖脑损伤的诊断中能更早发现病灶,拥有更高的诊断效能。DWI 评价扩散程度的参数称为表观扩散系数(ADC),它可以直接反映水分子在组织中的扩散速率,间接反映出组织在微观水平上的生理和病理变化。本组病例研究结果显示随着低血糖严重程度的增加,ADC 值呈明显减低趋势,且ADC 值与低血糖严重程度呈中等相关,说明ADC 值可以作为定量评估低血糖脑损伤严重程度的指标。马海锋等[21]的结果显示,低血糖脑损伤组患儿病变的ADC 值较低血糖无脑损伤组患儿相应部分的ADC 值明显减低。可以看出,DWI 不仅可以比常规MRI 更早地发现低血糖引起脑损伤的精确位置,还可以对其进行定量评估。
本组低血糖脑损伤患儿多数病变部位为双侧枕顶叶及胼胝体压部,有9 例表现为弥漫性脑损伤,涉及多个脑叶皮层及皮质下白质,这种类型的损伤在临床实践中较为少见,并且损伤机制仍不清楚。但本文研究结果为进一步研究积累了一定的基础。在这项研究中,只有少数儿童接受了影像学及临床随访,显示双侧顶枕叶皮层和皮质下白质萎缩囊变。另外,本研究也存在不足之处: 首先是本文属于回顾性分析,存在一定的选择偏倚,且样本量偏小,需要更多大样本多中心的研究来证实;其次是由于病灶不规则,ROI 画取时可能存在一定的误差,影响结果准确性;最后本组研究病例未能在治疗后行MRI 检查进行疗效评估,有待下一步深入研究。

