托瑞米芬逆转肺癌耐药细胞株A549/cDDP耐药性的应用
顾晶晶 张敬毅 孙平 田桂珍
(1淄博市第四人民医院药剂科,山东 淄博 255067;2淄博市第一医院药学部)
肺癌是临床上比较常见的恶性肿瘤之一,目前临床对其治疗主要手段之一为化疗,但对于化疗周期较长的患者来讲,可能出现癌细胞对治疗药物产生一定的抗药性,直接影响化疗效果〔1~4〕。因此临床对于能否应用药物来改善癌细胞对治疗药物的敏感性,并逆转耐药性是临床比较关注的问题。相关研究指出,通过托瑞米芬(TOR)的应用,可增加多种肺癌耐药细胞株的敏感度,并对其产生逆转作用〔5~7〕,本文拟分析TOR对耐顺铂(CDDP)细胞株A549的逆转作用。
1 资料与方法
1.1实验材料 肺癌耐药细胞株A549/cDDP:使用大剂量的cDDP连续冲击12次以上后获得,冲击后经四甲基偶氮唑蓝(MTT)法检测后显示其耐药指数为4.2。枸橼酸TOR:生产厂家为福安药业集团宁波天衡制药有限公司,国药准字H20020047。CDDP:生产厂家为齐鲁制药有限公司。Annexin V/PI 双染色细胞凋亡检测试剂盒、IMDM 培养基、二甲基亚砜及MTT均购于上海钰博生物科技有限公司。
1.2TOR母液的配置方法 称取枸橼酸TOR 2.99 g,将其与5 ml二甲基亚砜进行充分溶解,并加入无血清IMDM 5 ml,混合均匀后即得到500 μmol /L的TOR母液。对其进行除菌、分装后在常温下保存,并避免阳光照射。
1.3MTT检测 应用MTT法检测TOR联合cDDP及单纯应用cDDP对肺癌耐药细胞株A549/cDDP药物敏感性的影响。首先将选定的A549/cDDP菌株进行复苏处理并培养,当其达到指数生长期后,对其使用胰蛋白酶(0.25%)进行消化处理,然后使用生理盐水进行洗涤,洗涤后计数。取胎牛血清IMDM 培养液(体积分数为10%)配置成单个细胞悬液(5×104ml),将其接种于96孔培养板中, 100 μl/孔,将其放置在浓度为5%的CO2培养箱中,温度保持在37℃,在此种环境下放置一夜,保持其生长,当细胞壁贴壁时即代表生长较好。将其分为单独cDDP组、5 μmol/L TOR联合cDDP组及10 μmol/L TOR联合cDDP组,其中单独cDDP组浓度分别为200、100、50、20、10、5 μmol/L。以上各种药物浓度均设置4个复孔,并设置阴性对照组、阳性对照组、5 μmol/L TOR对照组及10 μmol/L TOR对照组,其中阳性对照组中含有1%的二甲基亚砜,阴性对照组为等体积的无血清二甲基亚砜。然后加入受试药物cDDP,最后的浓度为200 μmol/L、100 μmol/L、50 μmol/L、20 μmol/L、10 μmol/L及5 μmol/L;将浓度为5 μmol/L和10 μmol/L的 TOR放置在饱和湿度,温度为37℃及5% CO2的环境下进行静止培养,培养时间为68 h,然后加入浓度为5 mg/ml的MTT 20 μl/孔,继续培养4 h,培养满72 h后去除上清液,同时加入二甲基亚砜15 μl/孔,充分震荡10 min后,观察结晶全部溶解后使用全自动酶标仪检测各孔吸光度值(A),波长为492 nm。
1.4计算公式 药物对细胞抑制率=阳性对照孔A-加药孔A/阳性对照孔A×100%。半数抑制浓度(IC50) 根据曲线方程求得。逆转倍数=cDDP IC50/(cDDP+TOR)IC50。
1.5使用流式细胞仪检测cDDP及cDDP+TOR联合用药诱导肺癌耐药细胞株A549/cDDP 采用Annexin V/PI 双染色法检测细胞凋亡和药物浓度,所有操作严格按照试剂盒说明展开,采用Coulter XL-MCL 流式细胞仪收集细胞,每个样本均收集10 000个细胞。
1.6统计学分析 采用SPSS17.0统计学软件进行t和χ2检验。
2 结 果
2.1MTT 比色试验结果 当单独TOR浓度为5 μmol/L和10 μmol/L时,其对于A549/cDDP细胞的增殖未造成明显影响(P>0.05);当TOR和cDDP共同应用时, 5 μmol/L和10 μmol/L浓度均能提高cDDP对于A549/cDDP细胞的敏感性,差异有统计学意义(P<0.05)。见表1。
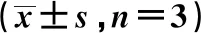
表1 TOR联合cDDP及单独应用cDDP对肺癌耐药细胞株A549/cDDP药物敏感性的影响
2.2cDDP+TOR 联合用药逆转肺癌耐药细胞株A549/cDDP对cDDP的耐药性 cDDP浓度为200、100、50、20、10、5 μmol/L时均可抑制A549/cDDP 细胞,且随着浓度的上升,其抑制程度也会增加。当cDDP 与TOR 联合应用时,cDDP浓度为10 μmol/L或者5 μmol/L,均可提升cDDP对于A549/cDDP 细胞的敏感性,差异有统计学意义(t=8.879,P=0.002),IC50 值为39.04 μmol/L时,其逆转倍数为2.04 倍,IC50 值为30.61 μmol/L时,其逆转倍数为2.61倍当cDDP 浓度为200 μmol/L时,cDDP+TOR终浓度5 μmol和cDDP+TOR终浓度10 μmol/L之间存在统计学意义(t=8.657,P=0.000),其他浓度时无统计学意义(P>0.005)。cDDP+TOR 终浓度5 μmol/L与cDDP+TOR 终浓度10 μmol/L之间仅在cDDP浓度为200 μmol/L时两者差异有统计学意义(t=2.965,P=0.006)。见图1。
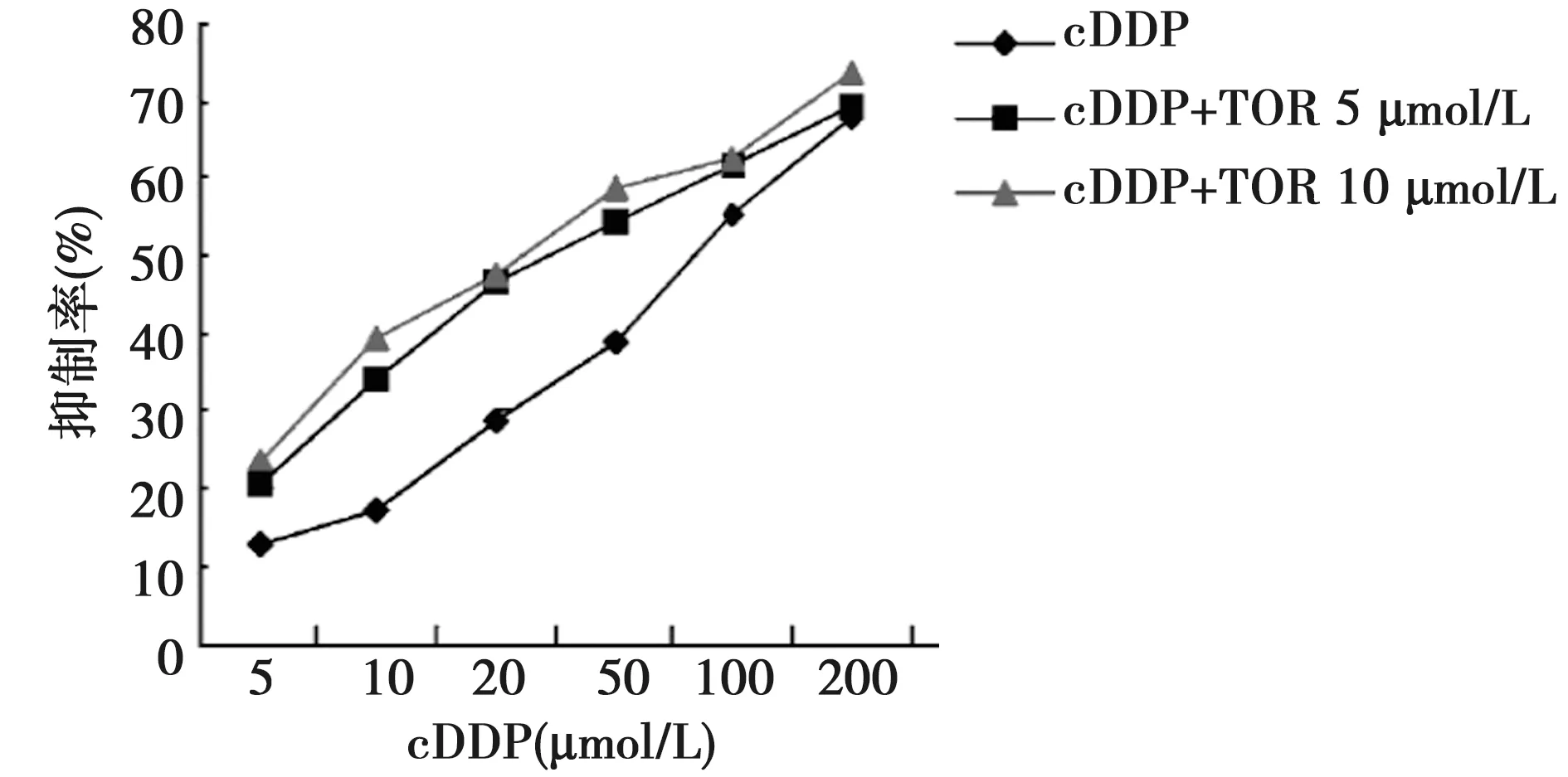
图1 为TOR逆转cDDP对A549/cDDP抑制曲线
3 讨 论
随着人们生活习惯及生活环境的改变,罹患肺癌的人群越来越多,非小细胞肺癌(NSCLC)作为最为常见的肺癌类型具有较高的死亡率。在既往研究中指出,NSCLC具有天然的耐药性,且耐药群体比较广,在化疗过程中经常会出现癌细胞对化疗药物耐药的情况出现,这直接导致化疗效果下降,影响治疗效果〔5,7〕。针对此问题临床很多学者均进行了研究,且指出NSCLC患者的癌细胞组织中雌激素受体(ER) 水平相对较高,且ER水平的高低及其阳性表达率与肺癌的分化程度有一定关系,同时与组织学类型也有着密切的关系〔8~11〕。
TOR是ER的拮抗剂,其在1979年研制出的一种抗肿瘤药物。其与传统的拮抗剂相比,在治疗肿瘤方面具有毒性小,副作用少的作用,同时还具有不致癌、不致畸的特点,当其与化疗药物联合应用时,其可以逆转药物耐药作用,增加抗肿瘤药物的敏感性〔8~10〕。
相关研究指出,TOR的逆转药物耐药作用及增加抗肿瘤药物的敏感性〔11~13〕,其主要机制如下:(1)TOR在机体的代谢中发挥了很大作用,作用之一即抑制蛋白激酶C 的活性,同时还会降低P 糖蛋白的活性及降低磷酸化水平,在此种作用下使其逆转肺癌的多种药物耐药。(2)肺癌组织具有一定的特点,临床显示此类患者的ER均呈高表达状态, TOR和ER结合对于已经产生激素依赖的肺癌组织产生了明显的抑制作用〔14,15〕。ER是一种Ca2+,同时也是磷脂依赖性蛋白激酶,其直接参与了癌细胞的分化、增殖过程,并起到了重要作用,同时也会对P-gp和MDR1 基因造成一定的影响。TOR作为ER抑制剂其较高的化学活性降低了P-gp 磷酸化水平,达到逆转耐药的作用。同时,PKC 也可促使Topo和LRP的磷酸化,当PKC活性增加后介导了多药耐药,此种途径也是TOR发挥逆转耐药作用的渠道之一。(3)TOR 对Ca2+具有双向调节的作用,对于高浓度的TOR 可以诱导肿瘤细胞凋亡。在细胞信号传递过程中,Ca2+发挥了重要作用,其涉及细胞内广泛的生物学效应。当Ca2+水平上升时,可激活系列Caspase 胞质内蛋白酶和核酸内切酶门降解DNA,促使细胞凋亡。相关研究指出,耐药细胞系A549/cDDP细胞内的Ca2+浓度与敏感细胞系A549相比相对较低,TOR对于Ca2+具有双向调节的作用,高浓度的TOR可以促进Ca2+浓度的上升,促使细胞出现死亡。本研究说明,治疗时使用5 μmol/L剂量可以达到化疗增敏和逆转作用,降低大计量应用导致的毒副作用,对于临床用药有一定的指导意义。
综上,TOR联合cDDP应用时,可以有效提升A549/cDDP的转录和治疗效果,避免了大剂量使用可能带来的毒副作用。

