氨基酸聚合物用于提高冻干过程中蛋白稳定性的研究
李 冰, 丛自豪, 肖希勉, 武月铭, 刘润辉
(华东理工大学生物反应器工程国家重点实验室,超细材料制备与应用教育部重点实验室,教育部医用生物材料工程研究中心,材料科学与工程学院,上海 200237)
β-半乳糖苷酶(β-Gal)是糖苷水解酶(GH-A)超家族的成员,可以水解半乳糖苷内的糖苷键以释放半乳糖[1]。β-Gal 活性降低或缺失会导致消化乳糖能力下降。研究表明全球约有65%的人遭受乳糖不耐症的困扰[2],因此,β-Gal 在乳制品行业中被广泛用于制造低乳糖和无乳糖的乳制品[3]。此外,β-Gal 作为荧光探针的酶标,用于观察卵巢癌的转移,在遗传学治疗领域具有非常重要的意义[4]。蛋白质在水溶液中会受到含水制剂的活性分子对其化学以及物理稳定性的影响,所以需要将其通过冷冻干燥制成冻干粉,以便长期储存和使用。然而,在温度极低、浓度变化、低压操作、pH 改变和干燥失水等条件下会导致蛋白失活和二级结构改变,因此在冷冻、干燥和再水化过程中维持β-Gal 的结构、构象稳定性和活性仍然受到挑战,β-Gal 在冻干前需加入蛋白质稳定剂以维持其在冷冻干燥过程中的活性。
蛋白质稳定剂有氨基酸[5-7]、糖[8-10]、蛋白[11]、盐[12-13]、聚合物[14-21]等,氨基酸能够在冷冻状态下增加水的表面张力[7],蔗糖[22-23]、海藻糖[18,24]等糖类可以保留蛋白质附近的水分子,其与蛋白质形成的氢键可以在冷冻干燥过程中稳定蛋白质。此外,聚合物如聚(乙二醇)[25]、聚(乙烯亚胺)[16]、羟丙基-β-环糊精[14]可用作添加剂以防止蛋白质的聚集和变性。
本文选择两种单一手性L-氨基酸进行合成,并将其共混聚合物作为蛋白稳定剂。这是因为L-氨基酸不仅比外消旋氨基酸便宜而且容易降解成人体必需氨基酸;此外,根据水的替代机理,聚L-谷氨酸(PLG)能够与蛋白质形成氢键并在冻干过程中取代水分子以防止蛋白聚集[5,7,26];玻璃化转变机理也表明聚L-赖氨酸(PLL)的非晶结构可以降低蛋白玻璃化转变温度[27-28]。通过双(三甲基硅基)氨基锂(LiHMDS)引发的快速氨基酸环内酸酐(NCA)聚合,制备了PLG、PLL氨基酸聚合物,该聚合物具有对水分不敏感、反应速率快的特性,可用于快速筛选合适的蛋白保护剂[29-30]。
1 实验部分
1.1 实验试剂
L-谷氨酸-5-叔丁酯:纯度98%,阿拉丁试剂(上海)有限公司;Nε-(叔丁氧基羰基)-L-赖氨酸:纯度98%,上海迈瑞尔化学技术有限公司;三光气:纯度99%,北京伊诺凯科技有限公司;α-蒎烯:纯度99%,北京伊诺凯科技有限公司;β-半乳糖苷酶:5 000 U,阿拉丁试剂(上海)有限公司;2-硝基苯基-β-D-吡喃半乳糖苷(ONPG):纯度99%,阿拉丁试剂(上海)有限公司;LiHMDS:纯度99%,西格玛-奥德里奇(上海)贸易有限公司;DMEM 培养液,GE 医疗生命科学部;3-(4,5-二 甲 基 噻 唑-2)-2,5-二 苯 基 四 氮 唑 溴 盐(MTT):纯度98%,上海麦克林生化科技有限公司;其他化学试剂均购于上海泰坦科技股份有限公司,使用前无进一步处理。
1.2 测试与表征仪器
核磁共振波谱仪(德国Bruker 公司,AVANCEⅢ 400 MHz 型):重水(D2O)为溶剂;凝胶渗透色谱:Waters 1515 等强度HPLC 泵;Waters 2414 示差折光检测器(RI);东曹TSKgel Alpha-3000 柱(粒径为7 μm);东曹TSKgel Alpha-2500 柱(粒径为7 μm),柱温箱温度为50 °C,检测器温度为35 °C;流动相为含10 mmol/L 溴化锂的二甲基甲酰胺(DMF),流速1 mL/min,标准样为聚甲基丙烯酸甲酯;酶标仪为Molecular Devices SpectraMax M2。
1.3 NCA 单体的合成
1.3.1Nε-(叔丁氧基羰基)-L-赖氨酸-N-羧酸-环内酸酐(Boc-L-Lys NCA)的合成 Boc-L-Lys NCA 合成路线如图1 所示[31]。在高纯氮气保护下,将Nε-(叔丁氧基羰基)-L-赖氨酸(10.00 g,40.60 mmol)和α-蒎烯(16.98 mL,107.18 mmol)分别加入250 mL 圆底烧瓶中。再加入干燥的四氢呋喃(THF)溶剂使单体悬浮。将三光气(5.30 g,17.86 mmol)提前溶解在干燥THF 中,冰浴及氮气保护下将其注入上述圆底烧瓶中,使单体浓度为0.3 mol/L。将反应瓶转移至50 °C油浴锅里反应并保持2 h,点板监控反应结束后撤掉油浴,使用低温冷凝旋蒸除去多余THF 并立即加入100 mL 乙酸乙酯(EA),转移至500 mL 的分液漏斗中,加入100 mL 冰水萃取1 次,收集有机相并用100 mL冷的饱和食盐水洗涤1 次,无水硫酸镁干燥后过滤,使用干燥的EA 和石油醚(PE)混合溶剂重结晶3 次(EA 与PE 体积比为4∶5),在充满氮气的手套箱中过滤得到白色粉末状晶体5.30 g,产率为48%。1.3.2L-谷氨酸-5-叔丁基-N-羧酸-环内酸酐(tBu-LGlu NCA)的合成tBu-L-Glu NCA 合成路线如图2所示[32]。在高纯氮气保护下,将L-谷氨酸-5-叔丁酯(5.00 g,24.60 mmol)和α-蒎烯(9.35 mL,59.04 mmol)分别加入250 mL 圆底烧瓶中。再加入干燥的THF 溶剂使单体悬浮。将三光气(2.92 g,9.84 mmol)提前溶解在干燥的THF 中,冰浴及氮气保护下将其注入上述圆底烧瓶中,使单体浓度为0.3 mol/L。将反应瓶转移至50 °C 油浴锅里反应并保持2 h,点板监控反应结束后撤掉油浴,使用低温冷凝旋蒸除去多余THF 并立即加入100 mL EA,转移至500 mL 的分液漏斗中,加入100 mL 冰水萃取1 次,收集有机相并用100 mL 冷的饱和食盐水洗涤1 次,无水硫酸镁干燥后过滤,使用干燥的EA 和PE 混合溶剂重结晶3 次(EA 与PE 体积比为1∶2),在充满氮气的手套箱中过滤得到白色粉末状晶体3.10 g,产率为55%。

图1 Boc-L-Lys NCA 合成路线Fig.1 Synthetic route of Boc-L-Lys NCA

图2 tBu-L-Glu NCA 合成路线Fig.2 Synthetic route of tBu-L-Glu NCA
1.4 氨基酸聚合物的合成
1.4.1 聚L-赖氨酸的合成 以Boc-L-Lys NCA 为单体,LiHMDS 为引发剂,在手套箱里进行快速聚L-赖氨酸(PLL)的聚合反应,步骤如图3 所示。称量Boc-L-Lys NCA(40.8 mg,0.15 mmol)放入干燥的10 mL反应瓶中,向瓶中加入0.1 mol/L LiHMDS 的THF 溶液(0.3 mL,0.03 mmol),调节单体浓度为0.1 mol/L,薄层层析(TLC)板监测反应结束后,滴加甲酸淬灭反应。用THF-石油醚沉淀体系,重复溶解-沉淀-离心过程3 次,抽真空干燥后得到了一系列侧链带Boc 保护的PLL 均聚物。Boc 保护基团用三氟乙酸(CF3COOH)脱除,再采用甲醇-无水乙醚沉淀体系,通过重复溶解-沉淀-离心过程3 次得到用于提高蛋白稳定性的脱保护的PLL 均聚物。

图4 聚L-谷氨酸的合成路线Fig.4 Synthetic route of PLG
1.4.2 聚L-谷氨酸的合成 以tBu-L-Glu NCA 为单体,LiHMDS 为引发剂,在手套箱里进行快速聚L-谷氨酸(PLG)的聚合反应,步骤如图4 所示。称量tBu-L-Glu NCA (103.15 mg,0.45 mmol)放入干燥的10 mL反应瓶中,向瓶中加入0.1 mol/L LiHMDS 的THF 溶液(0.45 mL,0.045 mmol),调节单体浓度为0.1 mol/L,TLC 板监测反应结束后,滴加甲酸淬灭反应。采用THF-石油醚沉淀体系,重复溶解-沉淀-离心过程3 次,抽真空干燥后得到了一系列侧链带tBu 保护的PLG 均聚物。tBu 保护基团用CF3COOH 脱除,再采用甲醇-无水乙醚沉淀体系,通过重复溶解-沉淀-离心过程3 次得到用于提高蛋白稳定性的脱保护的PLG 均聚物。
1.5 氨基酸聚合物共混后在冻干条件下保护蛋白效果测试

1.6 细胞毒性测试
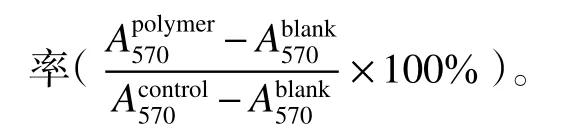
1.7 溶血测试

2 结果与讨论
2.1 聚合物的表征
聚合物的GPC 表征结果如表1 所示。通过GPC 表征的数均分子量(Mn)可以计算聚合度(DP)。由表1 可知PLL 的分散性指数(Đ)为1.18,分子量分布较为均一,聚合度为19;PLG 的分散性指数为1.23,聚合度为22。聚合反应结束后,取少量反应液在反应瓶中并加入对叔丁基苄胺继续反应12 h 进行封端,用于核磁表征,结果如图5 所示。通过苯上的氢确定均聚物的聚合度,PLL 和PLG 经对叔丁基苄胺封端后,由NMR 表征的聚合度分别为18 和23(表1),与GPC 表征的结果相差不大,符合阴离子活性聚合的基本特征,且所得聚合物结构参数与单体投料比一致。

表1 PLL 和PLG 在侧链被保护状态下的1H-NMR 和GPC 表征结果Table 1 1H-NMR and GPC characterization results of PLL and PLG at the sidechain protected stage
2.2 氨基酸聚合物在冻干条件下保护蛋白效果分析
以保存在4°C 未被冻干破坏的新鲜的蛋白活性作为初始活性(100%),分别测试了PLL 与PLG(质量浓度均为1.33 mg/mL)以不同质量分数共混后的共混物(以x%PLL+y%PLG 表示,x%,y%分别表示PLL 和PLG 的质量分数)在冻干条件下对蛋白的保护效果,结果如图6 所示。不同质量分数的PLL 与PLG 共混对蛋白的保护效果不同,随着PLG 质量分数的增加,保护效果逐渐增强。未被保护的β-Gal 蛋白在经历冷冻循环后活性只剩下38%,20% PLL 与80% PLG 共混后,蛋白活性明显提升至77%,活性提高了39%,保护效果非常明显。有文献报道[5,27-28],蛋白的冻干包括冷冻和干燥两个过程,在冷冻过程中,蛋白的pH 会发生改变,此时氨基酸类聚合物可以与蛋白周围的水结合,来维持蛋白的三维构象。当蛋白被干燥时,氨基酸聚合物可以替代水分子,与蛋白表面的残基相互作用,进而维持其结构。蛋白表面有很多带电荷的残基,选用带正电荷的PLL 与带负电荷的PLG 以不同质量比进行共混,也可以平衡蛋白表面的电荷。
2.3 氨基酸聚合物对显色剂的影响
采用酶标仪对蛋白与显色剂结合后的显色产物进行β-Gal 的活性检测。为了排除氨基酸聚合物与显色剂反应对结果可能造成的干扰,将聚合物与显色剂混合,在暗处孵育后,在相应的波长处测试吸光度值,根据1.5 节公式计算出相应的显色剂活性,结果如图7 所示,结果表明PLL 与PLG 的共混液不与显色剂ONPG 反应,可以确定显色剂仅仅显示蛋白的活性。
2.4 氨基酸聚合物的细胞毒性
PLL 与PLG 共混液对成纤维细胞NIH 3T3 和人脐静脉内皮细胞(HUVEC)的细胞毒性如图8 所示。由图可知,当PLL 的质量分数不高于50%时,共混液中NIH 3T3 和HUVEC 的细胞存活率都维持在80%以上,随着PLL 质量分数的增加,毒性总体上有所升高,细胞存活率有所下降,说明在PLL 的质量分数不高于50%时,PLL 与PLG 共混液作为一种蛋白保护剂可应用于对体内蛋白的保护。

图5 对叔丁基苄胺封端的PLL(a)和PLG(b)在脱保护状态下的核磁共振氢谱图Fig.5 1H-NMR spectra of PLL (a) and PLG (b) on 4-tert-butylbenzylamine terminal functionalization at the deprotected stage
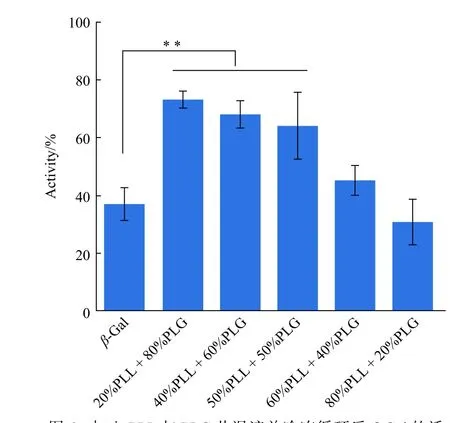
图6 加入PLL 与PLG 共混液并冷冻循环后β-Gal 的活性(每个样品重复3 次,**: p < 0.01)Fig.6 Activity of β-Gal added PLL and PLG blending following lyophilization (n=3 for all samples, **: p< 0.01)
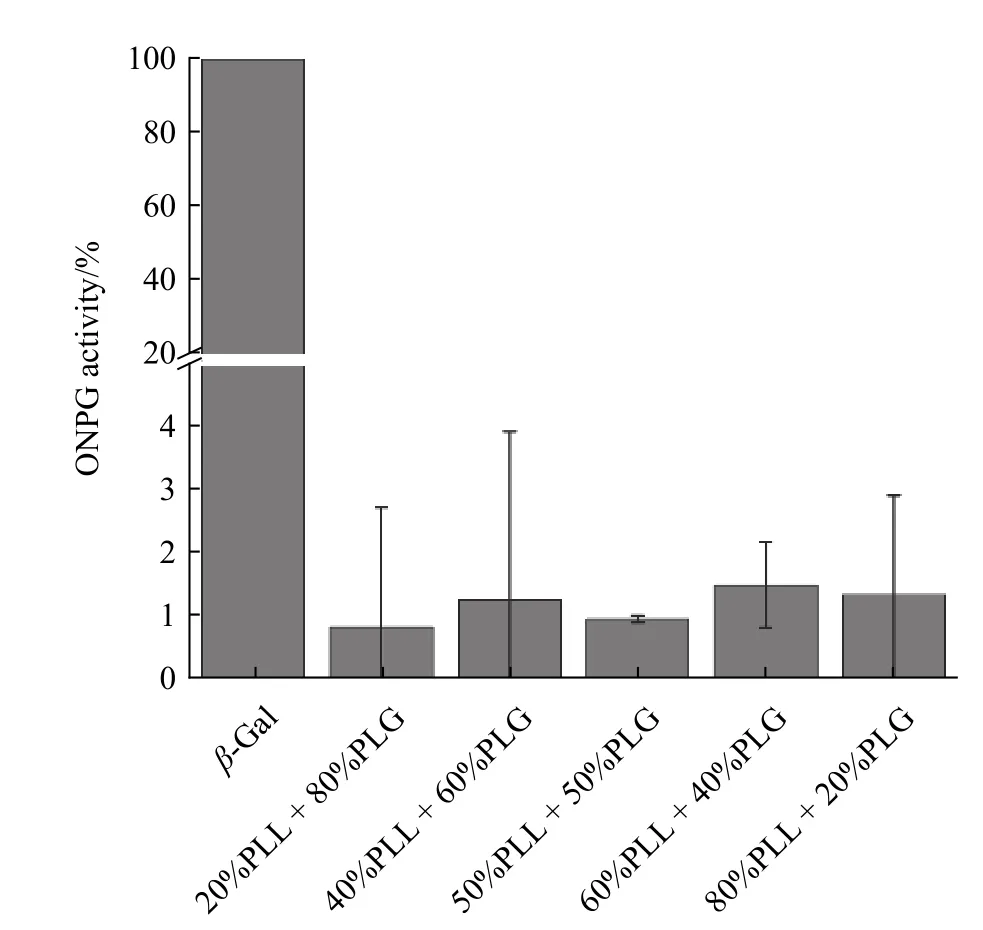
图7 PLL 与PLG 共混液对ONPG 的反应活性Fig.7 Reaction activity of PLL and PLG blending for ONPG
2.5 氨基酸聚合物的溶血活性
溶血活性是检测蛋白保护剂生物相容性的指标,溶血活性值过高将被限制用于体内。PLL 与PLG 共混液对人血红细胞的溶血活性如图9 所示。当PLL 的质量分数小于50%时,共混液对人血红细胞没有明显的溶血活性,当PLL 的质量分数大于50%时,有部分人血红细胞被破坏。这个结果也与细胞毒性的测试结果相符。说明当PLL质量分数小于50%时,PLL 与PLG 共混液适合作为蛋白的保护剂。

图8 PLL 与PLG 共混液对NIH 3T3 成纤维细胞(a)和对HUVEC(b)细胞毒性的影响Fig.8 Influence of PLL and PLG blending on NIH 3T3 fibroblast cells cytotoxicity (a) and HUVEC cytotoxicity (b)

图9 PLL 与PLG 共混液对人血红细胞的溶血活性Fig.9 Hemolysis activity of PLL and PLG blending for human red blood cell
3 结 论
(1)以LiHMDS 为引发剂,将Boc-L-LysNCA和tBu-L-Glu NCA 两种单体进行开环聚合,聚合反应可在10 min 之内完成。
(2)PLL 与PLG 的共混液对冻干过程中的β-Gal有很好的保护效果,20%PLL-80% PLG 共混液保护下冻干后的蛋白活性(77%)与未加保护剂时的蛋白活性(38%)相比提高约1 倍。
(3)PLL 与PLG 的共混液对NIH 3T3 成纤维细胞和HUVEC 细胞具有低毒性,对人血红细胞具有低溶血活性,表明其可用作体内的蛋白保护剂。

