培元抗癌汤对人乳腺癌MDA-MB-231细胞裸鼠移植瘤生长及细胞凋亡的影响▲
千维娜 李 治 李仁廷 赵艳莉 王院春 任 革 曹 茜
(1 陕西中医药大学附属医院肿瘤科,咸阳市 712000,电子邮箱:huangdd454aa@163.com;2 陕西中医药大学药学院,咸阳市 712000)
在我国,每10万人即有4.3名乳腺癌患者,全世界每年大约有50万人死于乳腺癌,同时其发病率渐趋升高,且发病年龄渐趋低龄化[1]。放疗是乳腺癌的治疗方法之一,但其疗效受很多因素制约,如对放射线的抵抗、放疗后复发以及对正常细胞组织的毒副反应等[2]。培元抗癌汤具有活血化瘀的功效,以及抑制肿瘤增长及转移、防止复发的作用[3]。研究表明,培元抗癌汤能通过调节淋巴B细胞,B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)等凋亡相关蛋白的表达,诱导肿瘤细胞凋亡,从而抑制肿瘤的生长;其还能通过调控Bcl-2和Bax的表达来抑制人乳腺癌细胞MCF-7和MDA-MB-468的增殖[4]。目前,培元抗癌汤体内抗乳腺癌的分子机制尚未完全清楚。为此,本研究建立MDA-MB-231人乳腺癌细胞裸鼠移植瘤模型,探讨培元抗癌汤的体内抗癌活性,为相关药物研发提供药理学依据,也为临床治疗该病提供探索策略。
1 材料与方法
1.1 细胞与动物 人乳腺癌细胞MDA-MB-231购自复旦大学上海细胞库。无特定病原体级BALB/c-nu雌性裸鼠30只,5~6周龄,体质量17~20 g,购自上海杰斯捷实验动物有限公司[许可证号:SCXK(沪)2013-0006]。按照无特定病原体级饲养条件,将所有小鼠在实验前适应性饲养1周,正常进食、饮水。
1.2 药品 培元抗癌汤由西洋参、白花蛇舌草、炒白术、黄芪、土茯苓、仙鹤草、炙甘草等组成。生药均购自陕西中医药大学附属医院中药房,于冷水中浸泡2 h后加热煮沸2 h,滤液,再加入冷水加热煮沸1.5 h,滤液,将两次滤液混合,混合后的滤液放置水浴锅中制备煎剂(生药含量为3.0 g/mL),高温消毒后于4℃冰箱保存备用。注射用的乌司他丁(广东天普生化医药股份有限公司,批号:H19990134)。
1.3 主要试剂与仪器 胎牛血清(Lonsera公司,批号:NU12982);伊戈尔最低必需培养基(Eagle′s minimum essential medium,EMEM)(艾美捷科技有限公司,批号:MEL06);辣根过氧化物酶标记的二抗(北京中杉金桥生物技术有限公司,批号:20150516);十二烷基硫酸钠(sodium dodecyl sulfate,SDS)裂解液(碧云天生物技术公司,批号:P0013G);二喹啉甲酸蛋白试剂盒(碧云天公司,批号:P0011);β肌动蛋白(β-actin)、Bax、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-9抗体(Affinity公司,批号: AF7028、AF0150、AF6388);Bcl-2、Caspase-7抗体(Abcam公司,批号:ab42128、ab72529)。HERAcell VIOS 160i型CO2恒温培养箱(美国Thermo公司);Universal Hood Ⅱ型凝胶成像分析系统(美国伯乐公司)。
1.4 细胞培养 用含10%胎牛血清的EMEM培养基,于室温、无菌并含有5%CO2的培养箱中培养MDA-MB-231细胞,细胞贴壁生长到融合度近80%后,更换培养基进行传代培养[5]。
1.5 动物实验
1.5.1 模型建立:取对数生长期的MDA-MB-231细胞,用生理盐水制成细胞悬液,并将其浓度调整到2.5×107个/mL。在裸鼠右侧腋窝处皮下注射200 μL细胞悬液,建立人乳腺癌裸鼠移植瘤模型。测量肿瘤的长径(a)和纵径(b),计算肿瘤体积(V)[6],V=πab2/6。每隔2 d记录裸鼠的体重及肿瘤的体积,直到裸鼠的肿瘤体积达到100 mm3。
1.5.2 分组及给药:将达到建模标准的30只载瘤鼠,按随机数字表分为对照组、低剂量组(200 mg/kg)、中剂量组(300 mg/kg)和高剂量组(400 mg/kg)和阳性对照组(3 mg/kg),每组6只。各剂量组载瘤鼠给予相应剂量的培元抗癌汤灌胃,阳性对照组经载瘤鼠的腋窝皮下注射乌司他丁3 mg/kg,均1次/d,连续给药21 d。对照组不做任何干预治疗。给药剂量的折算参照《药理实验方法学》[7]。记录实验中各组载瘤鼠死亡情况。
1.5.3 载瘤鼠乳腺癌抑制率的计算:连续给药21 d后,处死各组载瘤鼠,取出乳腺肿瘤,剥离肿瘤外膜及附着的结缔组织,用生理盐水充分清洗掉表面的血细胞,若存在较明显的坏死灶,需剪开肿瘤,清洗干净肿瘤内部的坏死灶,用吸水纸吸干肿瘤表面水分,称量肿瘤重量。肿瘤抑制率 =(对照组肿瘤均重-实验组肿瘤均量)/对照组肿瘤均重。
1.5.4 观察肿瘤组织的病理学改变:将部分肿瘤组织置于4%多聚甲醛溶液中固定1 d,经苏木精-伊红(hematoxylin-eosin,HE)染色后制成切片[8],显微镜下观察肿瘤组织的细胞形态变化。
1.5.5 免疫印迹试验检测肿瘤组织Bax、Bcl-2、Caspase-9和Caspase-7蛋白相对表达水平:取5 g肿瘤组织置入研磨器中,加入SDS组织裂解液,迅速在冰上研磨、匀浆,在4℃下以12 000 r/min离心10 min,提取组织总蛋白。二喹啉甲酸法测定蛋白质的浓度。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后转膜(350 mA,120 min),添加5%脱脂奶粉封闭处理1.5 h后,加入一抗β-actin(1 ∶1 000)、Bax(1 ∶500)、Bcl-2(1 ∶1 000)、Caspase-9(1 ∶500)和Caspase-7(1 ∶1 000)抗体4℃孵育过夜,加入二抗(1 ∶500)室温孵育2 h,通过凝胶成像分析系统显影。以β-actin作为内参蛋白,根据灰度比值计算相关目的蛋白相对表达量。
1.6 细胞实验
1.6.1 分组与给药:取对数生长期的人乳腺癌细胞MDA-MB-231接种于6孔板中,接种密度为1×105个/孔并分为细胞空白组、200 μmol/L培元抗癌汤组、300 μmol/L培元抗癌汤组、400 μmol/L培元抗癌汤组和3 μmol/L乌司他丁组;各给药物组加入5 mL相应浓度的药物后,将6孔板放入37℃、含有5% CO2的无菌培养箱中培养,48 h后收集各孔细胞用于后续实验,细胞空白组不做任何干预。
1.6.2 流式细胞术检测细胞凋亡率:收集细胞,用磷酸缓冲盐溶液洗涤3次,接种于96孔板中孵育过夜,重悬细胞并调整细胞浓度为1×106个/mL,置于37℃、5% CO2培养箱中培养1 d,使用胰酶消化细胞后加入100 μL 二甲基亚砜和20 μL 碘化丙啶,37℃避光反应20 min,采用流式细胞仪检测细胞的凋亡情况。
1.7 统计学分析 采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以(x±s)表示,多组均数比较采用单因素方差分析,两两比较使用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 动物的一般情况 对照组载瘤鼠出现体重明显减轻、活动减少、反应迟钝等情况,3只载瘤鼠死亡;培元抗癌汤各剂量组的载瘤鼠用药后饮食良好,体重较用药前增加,未出现腹泻等情况,无死亡;阳性对照组载瘤鼠用药后体重也较用药前增加,但对外界刺激反应欠灵敏,1只载瘤鼠死亡。
2.2 5组载瘤鼠肿瘤抑制率比较 低剂量组、高剂量组、阳性对照组、中剂量组的肿瘤抑制率依次升高(均P<0.05),见表1。
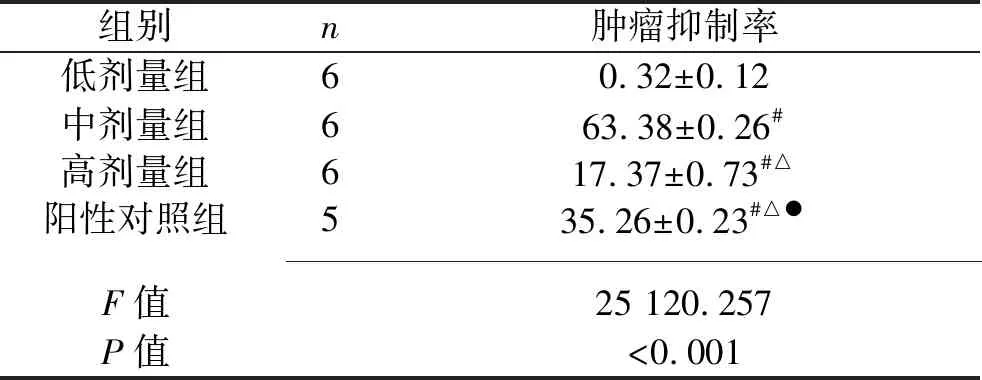
表1 5组载瘤鼠肿瘤抑制率比较(x±s,%)
2.3 5组载瘤鼠乳腺肿瘤组织病理形态 对照组中,肿瘤组织细胞的形态各异,呈现不规则的团块状和条状,肿瘤细胞异形明显,细胞核增大,核异性明显。低剂量组和对照组差别不大;中、高剂量组肿瘤组织出现了不同程度的肿瘤细胞退变,并可见细胞核碎片,凋亡细胞增多,其中中剂量组肿瘤细胞退变变化最显著;阳性对照组也出现一定程度的肿瘤细胞退变,凋亡细胞数增多,密度变小。见图1。
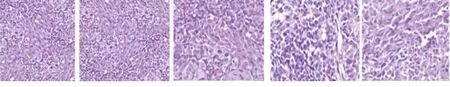
对照组 低剂量组 中剂量组 高剂量组 阳性对照组
2.4 5组载瘤鼠乳腺肿瘤组织凋亡相关蛋白的表达水平比较 与对照组和低剂量组比较,中、高剂量组和阳性对照组的促凋亡蛋白Bax、Caspase-9、Caspase-7相对表达量均升高(均P<0.05),而抗凋亡蛋白Bcl-2相对表达量均降低(均P<0.05),但对照组与低剂量组的凋亡相关蛋白表达水平差异均无统计学意义(均P>0.05)。与高剂量组和阳性对照组比较,中剂量组的促凋亡蛋白Bax、Caspase-9、Caspase-7相对表达量均升高(均P<0.05),抗凋亡蛋白Bcl-2相对表达量降低(均P<0.05),但高剂量组与阳性对照组的凋亡相关蛋白表达水平差异均无统计学意义(均P>0.05)。 结果见表2及图2。

图2 5组凋亡相关蛋白表达情况

表2 5组乳腺肿瘤组织凋亡相关蛋白的相对表达量比较(x±s)
2.5 5组细胞凋亡率比较 与细胞空白组和200 μmol/L培元抗癌汤组比较,300 μmol/L、400 μmol/L培元抗癌汤组和3 μmol/L乌司他丁组细胞凋亡率均升高(均P<0.05);与400 μmol/L培元抗癌汤组和3 μmol/L乌司他丁组比较,300 μmol/L培元抗癌汤组细胞凋亡率均升高(均P<0.05);细胞空白组和200 μmol/L培元抗癌汤组之间,以及400 μmol/L培元抗癌汤组和3 μmol/L乌司他丁组之间,细胞凋亡率比较差异无统计学意义(均P<0.05)。见表3及图3。

图3 流式细胞术检测细胞凋亡结果
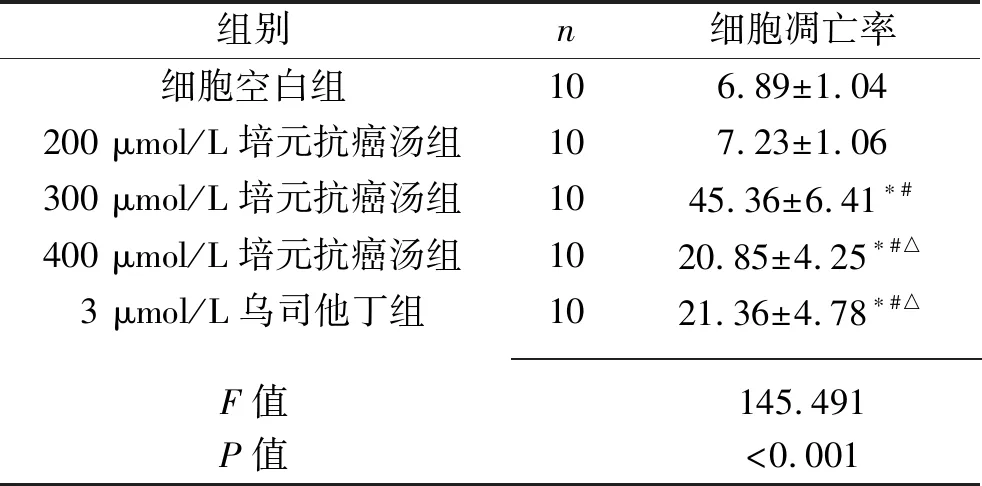
表3 5组细胞凋亡率比较(x±s,%)
3 讨 论
中草药是天然的产物,具有抑制肿瘤的作用,而且中草药的毒副作用比较小[9]。中医认为,正气存内、邪不可干,邪之所奏,其气必虚,病变的产生和发展是由于正邪相争、正气不足、正不胜邪所导致,肿瘤的发生、发展和病灶的转移其机理也如此[10]。因此,如《难经》中提及的“补不足,损有余”,肿瘤的治疗方法就是“扶正驱邪”[11]。
肿瘤的产生和发展都是因为正气不足,随着疾病的继续发展,致使正气更虚,因此扶正固本在治疗肿瘤的过程没有意义。“痛有定处,不发生转移”是肿瘤的主要特征,从其形态看,存在着“瘀血内阻”的现象[12]。“气为血之帅,血为气之母”,气可以点化和吸收血的精华,血是气的载体,也能够变成气[13]。如果气比较虚弱,就会没有力道,导致淤血,血如果内阻,就会阻止气的循环,长此以往,就会形成恶性循环。所以肿瘤的早期是以淤血为主,中期是淤血和气的循环受限为主,晚期则气血两虚,比较严重。因此,肿瘤的基本机理就是气血两虚,虚实相生,治疗应益气活血化瘀。李仁廷教授依据中医理论基础,结合丰富的临床经验及现代药理学知识研制出培元抗癌汤,其为具有抑制恶性肿瘤产生、发展、复发和转移作用的中药制剂。培元抗癌汤主要是由西洋参、炒白术、白花蛇舌草、黄芪、仙鹤草、土茯苓、后朴、炙甘草等组成。本方中,西洋参味甘、微苦,性子良、能够清火生津、益气养阴;西洋参和白花蛇舌草同用可以解毒、抗癌。在本实验中,对照组载瘤鼠体重减轻、活动减少、反应迟钝;与对照组比较,培元抗癌汤各剂量组和阳性对照组载瘤鼠体重增加、反应较为灵敏,且肿瘤抑制率均升高。这表明培元抗癌汤与乌司他丁均有抑制乳腺癌组织生长的作用,对治疗乳腺癌细胞移植瘤小鼠均有积极的作用。此外,低剂量组、高剂量组、阳性对照组、中剂量组的肿瘤抑制率依次升高(均P<0.05),提示中剂量的培元抗癌汤肿瘤抑制效果最为明显。而HE染色结果也证实了这一结果,光镜下观察各组肿瘤组织发现,对照组和低剂量肿瘤细胞异形明显,细胞核增大,核异性明显,高中剂量组和阳性对照组肿瘤细胞出现了不同程度退变,可见细胞核碎片和凋亡细胞,中剂量组肿瘤细胞退变更明显。总之,适量的培元抗癌汤对人乳腺癌细胞引起的小鼠肿瘤具有很好的抑制效果。
癌症的发生和发展不仅与肿瘤的恶性增殖有关,还与癌细胞所处的微环境有关。癌细胞凋亡被抑制对恶性肿瘤的产生和发展起到非常重要的作用。Bcl家族的蛋白在凋亡信号转录过程中发挥着重要的作用,是影响细胞凋亡的关键性因素之一[14],其通过抑制细胞凋亡和死亡导致细胞数量增多从而促进肿瘤的生长。其中,Bcl-2是Bcl家族中重要的抑制凋亡的蛋白。Caspase家族的所有蛋白均与细胞凋亡相关,是引导肿瘤生长周期的重要因子,其中Caspase-3是凋亡起始因子,Caspase-9是凋亡执行因子。Caspase家族相关蛋白含量增高可促使癌细胞凋亡[15]。 本研究结果显示,与对照组比较,中、高剂量组和阳性对照组的促凋亡蛋白Bax、Caspase-9、Caspase-7相对表达量均升高(均P<0.05),而抗凋亡蛋白Bcl-2相对表达量均降低(均P<0.05),其中中剂量组的促凋亡蛋白水平最高而抗凋亡蛋白水平最低,这表明培元抗癌汤与乌司他丁均能影响凋亡相关蛋白表达,从而促进肿瘤细胞凋亡、抑制肿瘤生长,而中剂量的培元抗癌汤效果最佳。此外,本研究按照肿瘤模型用药剂量的比例,应用不同浓度培元抗癌汤干预人乳腺癌细胞,结果显示,300 μmol/L、400 μmol/L培元抗癌汤组和3 μmol/L乌司他丁组细胞凋亡率高于细胞空白组和200 μmol/L培元抗癌汤组,其中300 μmol/L培元抗癌汤组细胞凋亡率最高,提示适宜剂量的培元抗癌汤可以促进肿瘤细胞凋亡。
综上所述,适宜剂量的培元抗癌汤能有效抑制人乳腺癌MDA-MB-231细胞裸鼠移植瘤生长,同时可调控凋亡相关蛋白的表达和促进细胞凋亡。但培元抗癌汤中治疗乳腺癌的有效成分,以及具体的分子机制和信号通路相关的作用靶点,有待进一步深入探讨和研究。

