胃癌患者术后疲劳情况及其影响因素分析▲
包 磊 宗旭芳 李晓波
(1 江苏大学附属医院手术室,镇江市 212001,电子邮箱:arisibl@163.com;2 江苏大学心理中心,镇江市 212013)
术后疲劳不同于笼统的疲乏、慢性疲劳综合征或癌性疲乏,它是一组由手术创伤或应激引起的疲乏,发生于术后恢复期(主要是术后1周至1个月)或更长时间内的乏力、失眠、注意力不集中、抑郁、紧张、焦虑等一系列症候群[1]。胃癌是一种常见的消化系统恶性肿瘤,手术切除是其主要的根治手段。据全球肿瘤流行病统计数据显示,2018年我国胃癌新发病例占全球的42.6%[2]。因此,了解胃癌患者术后恢复期的疲劳发生率、变化趋势及其影响因素对预防术后疲劳有重要意义。本研究分析了接受胃癌根治术患者术后30 d的疲劳变化趋势,并分析患者术后30 d疲劳程度的影响因素,现报告如下。
1 资料与方法
1.1 研究对象 选择2017年3~8月在江苏某三甲医院普外科行择期胃癌根治术的患者作为研究对象。依照多因素分析样本量粗略计算公式,受调查的样本含量可以扩大为变量数目的5~10倍[3],本研究计划对24个变量进行分析,样本量最少约为24的5倍,即120例;为了减少误差带来的偏倚,再将其扩大10%,即至少纳入132例。纳入标准:(1)年龄≥18岁;(2)美国麻醉医师学会(American Society of Anesthesiologists,ASA)分级为Ⅰ级或Ⅱ级;(3)有明确手术指征且无禁忌证的择期胃癌根治术患者;(4)同意参加本研究。排除标准:(1)合并严重心、肺、肾等功能障碍;(2)伴有严重视听障碍或精神障碍;(3)非计划性再次手术的患者;(4)多器官联合手术和肿瘤广泛转移未能行根治性切除的患者;(5)中途退出本研究者。最终纳入159例患者,均为已婚。本研究经江苏大学附属医院医学伦理委员会审核批准,所有患者术前均签署知情同意书。
1.2 研究工具
1.2.1 临床病例报告表:自制一份临床病例报告表,收集患者的社会人口学和疾病相关资料,包括性别、年龄、付费方式、疾病认知、文化程度、职业特征、不良嗜好(吸烟、嗜酒)、术前指标(包括体质指数、禁食时间、血浆白蛋白、血红蛋白、K+水平、白细胞、心肺功能、术前基础疾病)、手术时间、手术类型、术后住院时间等。
1.2.2 住院患者焦虑抑郁量表(Hospital Anxiety and Depression Scale,HAD):于术前1 d采用HAD量表进行评估。该表可分为焦虑和抑郁两个因子,主要应用于筛查综合医院住院患者的焦虑和抑郁情绪,并以8分作为焦虑或抑郁的临界值[4],即评分>8分则认为存在焦虑或抑郁症状。
1.2.3 营养风险筛查量表2002(Nutrition Risk Screening 2002,NRS2002)评分:于术前1 d采用NRS2002进行评估。NRS2002评分以3分为界,≥3分表示存在营养不良并且需要营养干预[5]。
1.2.4 疲劳视觉模拟量表(Visual Analogue Scale,VAS)[6]:可以评估患者主观上的疲劳感觉,该量表为一条标有数字0到10的刻度尺,患者依据自己的主观感受,在尺上刻画出自己目前疲劳程度所处的位置;其中0表示没有疲劳,10表示无法坚持的疲劳[6]。
1.3 研究方法 收集患者人口学、疾病学、心理学等相关资料,并在术前1 d与术后3 d、7 d、14 d、30 d分别对患者的疲劳程度进行评估。其中心理学和术后疲劳的评估均由本研究的研究者完成;已出院的患者采用电话随访完成疲劳程度评估,避免诱导式询问;由课题组成员查阅病历收集其余资料。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,重复测量资料采用重复测量方法分析;计数资料以例数(百分比)表示,组间比较采用χ2检验;相关性分析采用Pearson相关检验;患者术后30 d疲劳的影响因素采用多元线性回归模型(逐步回归法)分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者术后30 d内疲劳的变化趋势 术前1 d与术后3 d、7 d、14 d、30 d的疲劳发生率分别为66.0%、100%、100%、97.5%和87.4%;VAS评分有随时间变化的趋势,其中术后3 d疲劳得分最高。见表1。
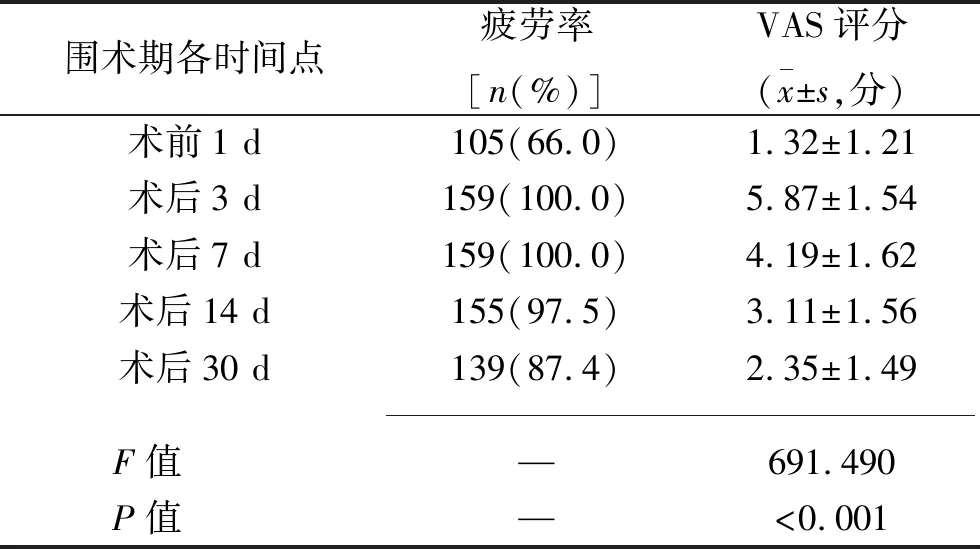
表1 159例患者围术期各时间点疲劳水平
2.2 患者术后30 d疲劳状况的单因素分析 接受开放式手术、心肺功能不正常的患者疲劳得分分别高于接受腔镜手术、心肺功能正常的患者(P<0.05);其他人口学特征的患者疲劳得分差异无统计学意义(P>0.05)。见表2。

表2 不同人口学特征患者术后30 d的疲劳得分比较(x±s,分)
2.3 胃癌患者术后30 d疲劳状况与手术时间等指标的相关性分析 术后住院时间、术前禁食时间、NRS2002评分、术前焦虑及抑郁评分、术前1 d VAS评分与术后30 d疲劳得分呈正相关,术前白蛋白、血红蛋白、体质指数与术后30 d疲劳得分呈负相关(均P<0.05)。见表3。
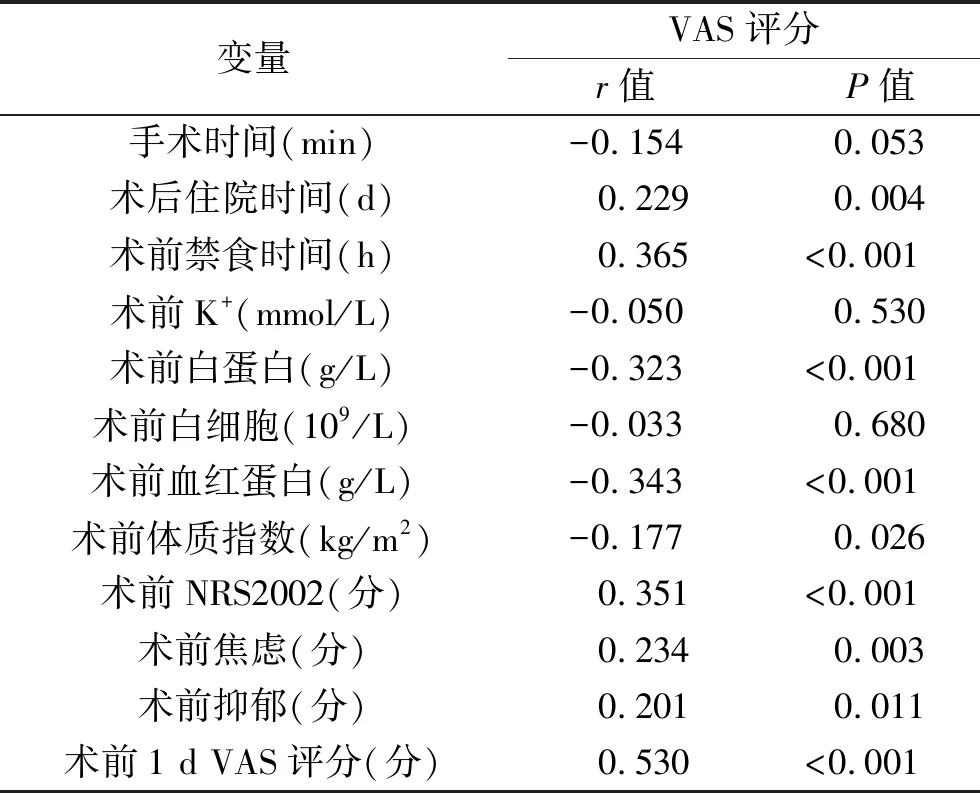
表3 手术时间等指标与术后30 d疲劳的相关性分析
2.4 影响术后30 d疲劳的多因素分析 以单因素分析有统计学差异的指标作为自变量,以疲劳得分为因变量,进行多元线性回归,连续变量资料采用实际值,其他自变量赋值见表4。结果显示,术前1 d VAS评分、手术方式、术前禁食时间、术后住院时间、术前心肺功能及术前焦虑、术前白蛋白水平是术后30 d患者疲劳的影响因素(均P<0.05)。见表5。

表4 自变量赋值
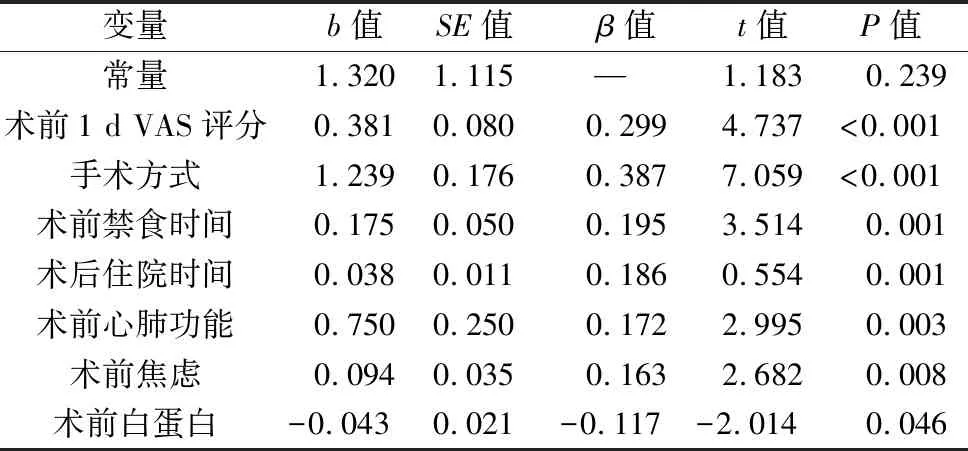
表5 术后30 d疲劳的多元线性回归
3 讨 论
疲劳是一种不适的主观感受,北美护理诊断协会将疲劳定义为由个体自身感知的一种强烈而持久的倦怠感,以及从事脑力和体力工作时的无力感,这种感觉不因休息而缓解[7]。随着对疲劳研究的深入,其各个分支领域的研究也逐渐受到重视,例如慢性疲劳综合征、癌性疲劳、术后疲劳等。与前两者不同的是,术后疲劳主要是由手术以及手术相关治疗引起,并且不会随着手术创伤的愈合而完全消失,它往往会持续一段时间。有文献报告,术后疲劳最容易出现在腹部大手术中[8],这可能是因为腹部手术不仅创伤大,而且术后常出现严重的胃肠道症状。一项针对加速康复项目的远期随访研究显示,接受腹腔镜腹部手术的患者有1/3在出院后2周仍存在严重的胃肠道症状[9],这些症状可能引起或进一步加重术后的营养不良,进而导致疲劳发生。
研究显示,术后疲劳的发病情况与手术方式有关[10]。本研究中,胃癌患者术后3 d、7 d的疲劳发生率高达100%,术后30 d仍高达87.4%,这与相关文献[11]报告结果相似。本研究发现,术后3 d的疲劳得分最高;随着康复的进程,疲劳程度逐渐下降,但术后30 d的疲劳得分仍高于术前1 d,这提示胃癌根治手术引起的疲劳在术后还持续存在。研究发现,术后疲劳的病因主要有手术创伤、内分泌代谢紊乱、营养不良、心肺功能下降、骨骼肌萎缩、炎症因子和神经递质的释放以及心理社会因素[12-13]。胃癌根治术的创伤大、麻醉复杂,术后切口疼痛、营养不良给患者及其家庭带来困扰,切口的疼痛和营养不良还可以进一步导致患者早期活动意愿和活动耐力下降,进而使心肺功能无法恢复到术前水平,同时炎症反应和分解代谢的加剧使得骨骼肌发生萎缩,导致患者出现久久不能褪去的无力感。
相关研究结果显示,术前疲劳、手术类型、禁食时间、术后住院天数、心肺功能等是患者术后早期疲劳发生的因素[10,14]。本研究多元线性回归分析结果显示,术前1 d VAS评分、手术方式、术前禁食时间、术后住院时间、术前心肺功能及术前焦虑、术前白蛋白水平是术后30 d患者疲劳的影响因素(均P<0.05)。目前对术后疲劳的干预措施主要有全程营养支持、生长激素治疗、心理护理和中医中药疗法,但胃癌病因复杂,上述措施相对单一、效果有限。根据“治未病”的思想,结合本研究的结果,针对胃癌术后疲劳的特点,笔者建议在临床中可通过缩短禁食禁饮时间、条件允许者进行腹腔镜微创手术、术前给予充分营养支持,来达到早期康复、缩短术后住院时间的目的。同时本研究还发现,术前焦虑也是影响患者术后疲劳的因素,因此,医护人员可采取个性化的心理干预措施,从认知、情绪、讲解疾病及手术知识等方面着手,缓解患者的焦虑情绪,从而达到消除术后疲劳的效果[15]。同时,还可以建立有效的延续性干预策略。目前,“互联网+”的医院-社区一体化管理模式在慢性病和老年人的健康照顾中取得了良好的效果[16],对胃癌术后疲劳的远期干预可以借鉴。此外,术前心肺功能也是术后30 d疲劳发生的影响因素,这提示术前心肺功能差的患者术后恢复速度相对较慢。有研究显示,术前心肺功能差的患者,术后住院时间更长,其原因是患者恢复到术前心肺功能需要更长的时间,因此导致疲劳不能恢复[17]。
综上所述,胃癌患者术后疲劳的发生率高,术前1 d VAS评分、手术方式、术前禁食时间、术后住院时间、术前心肺功能及术前焦虑、术前白蛋白水平是术后30 d患者疲劳的影响因素。

