梅迪-维斯纳病毒gag蛋白的原核表达及其交叉反应原性
古努尔·吐尔逊, 王登峰, 杨学云, 魏玉荣, 李建军, 孟肖潇, 洪都孜·波拉提, 吴建勇
(新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830013)
梅迪-维斯纳病毒(Maedi-Visna virus,MVV)感染也称为梅迪-维斯纳病或绵羊进行性肺炎(Ovine progressive pneumonia,OPP),是绵羊的一种以进行性消瘦和呼吸困难为临床特征的慢性传染病[1]。该病毒由Sigurdsson等[2]在1960年首次分离,是世界上首个得到临床分离的慢病毒属成员,与山羊关节炎-脑炎病毒(Caprine arthritis encephalitis virus,CAEV)一起统称为小反刍动物慢病毒(Small ruminants lentivirus viruses,SRLVs)[3]。MVV主要通过母羊-羔羊垂直传播和接触性传播2种途径感染绵羊,多数感染羊表现出终身带毒,但无明显临床症状,导致生产者和兽医极易忽视或误诊梅迪-维斯纳病,使其发生流行[4-5]。
目前,MVV呈世界性分布,亚洲、欧洲、非洲和美洲大陆均被报道存在该病,但不同国家的检出率有所不同[2]。西班牙调查结果显示,绵羊个体阳性率高达24.8%~52.8%[6-7];土耳其绵羊MVV抗体检出率为15.3%~23.5%不等[8-10]。中国在20世纪80年代首次分离到该病毒,并发现该病毒在新疆纯种边区莱斯特羊中的检出率高达44%[11-12];最近中国采用进口竞争酶联免疫吸附测定(ELISA)试剂盒开展了11个省份MVV血清学调查,结果显示4个省份检出MVV抗体阳性羊,检出率为0.81%~1.65%[13],这说明部分地区仍然存在MVV感染和流行。因此,有必要制备诊断抗原,建立相关的检测技术方法,为该病的防控提供技术支撑。
从基因组结构分析可知,MVV基因组RNA全长为9~10 kb,由长末端重复序列(LTR)、结构蛋白编码基因(pol、gag和env)和调控基因(tat、rev和vif)等组成[14],抗原基因主要分布于gag和env基因。其中,gag基因为基因型特异性抗原基因,基于该基因多态性,可以将SRLVs分为A、B、C、D和E等5个基因型,不同基因型毒株gag蛋白氨基酸序列存在较高的相似性,有望成为检测或诊断的候选抗原[15-16]。然而,中国目前已公开的MVV相关基因序列信息极少,在分析不同基因型毒株gag蛋白氨基酸序列和抗原特征等方面存在不足。因此,需要从野毒株中扩增gag基因以了解中国MVV毒株gag基因和蛋白质氨基酸序列的分子特征。
当前,中国虽然有SRLVs检疫技术规范,但无国产商品化检测试剂盒的生产和供应。过去常采用的琼脂糖扩散试验主要通过病毒的连续批量培养、浓缩后制备成诊断抗原[17],因抗原制备过程较为复杂、生产成本较高等原因,限制了抗原的批量生产与应用。为此,本研究从实验室保存的MVV野毒株中克隆gag基因,在生物信息学分析MVV与CAEV gag蛋白氨基酸序列和抗原表位相似性的基础上,通过gag蛋白原核表达和Western blotting验证分析其反应原性,以期为研制MVV和CAEV通用检测技术奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌(毒)株与载体 梅迪-维斯纳病毒四川株、pET-22b质粒由本实验室保存,DH5α、BL21(DE3)购自天根生化科技(北京)有限公司。
1.1.2 主要试剂 D15000 DNA marker、DNA纯化回收试剂盒、质粒快速提取试剂盒等购自天根生化科技(北京)有限公司,羧苄青霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、DNA Marker、LB培养基购自生工生物工程(上海)股份有限公司,蛋白质Marker、XhoⅠ、NcoⅠ购自Thermo Scientific公司,辣根过氧化物酶(HRP)标记的兔抗绵羊IgG购自Earthox公司,兔抗山羊IgG抗体购自Sigma公司,DNA连接酶、GoTaqGreen mastermix购自Promega公司,QIAamp DNA mini Kit购自QIAGEN公司。绵羊抗MVV血清为绵羊自然感染MVV后的阳性血清,山羊抗CAEV血清为山羊感染CAEV gs-35V株(基因组序列GenBank登录号为KT749881)后的阳性血清,均为本实验室保存。
1.1.3 引物设计与合成 以GenBank上登录的MVV基因组gag基因序列(登录号:NC001452.1)为参考序列,利用Oligo 7.0软件设计上游引物gag-F:5′-CATGCCATGGCGAAGCAAGGCTCAAAGGAGA-3′(斜体为NcoⅠ酶切位点)、下游引物gag-R:5′-AAACTCGAGCAACATAGGGGGCGCGGACGGCA-3′(斜体为XhoⅠ酶切位点),并由生工生物工程(上海)股份有限公司合成。
1.2 试验方法
1.2.1 病毒基因组DNA的提取 采用QIAamp DNA mini Kit提取MVV前病毒基因组DNA,按照试剂盒说明书进行操作。
1.2.2 MVVgag基因的PCR扩增 采用50 μl反应体系:GoTaqGreen mastermix 25 μl,上、下游引物(20 mmol/L)各1 μl,基因组DNA 2 μl,水21 μl。反应程序:94 ℃预变性5 min;94 ℃变性1 min,59.5 ℃退火1 min,72 ℃延伸85 s,共30个循环;最后72 ℃延伸7 min。反应结束后,取5 μl PCR反应产物进行1.0%琼脂糖凝胶电泳,确定其大小后进行胶回收。
1.2.3 重组表达载体的构建 将含pET-22b质粒的菌种接种于LB培养基,37 ℃振荡培养16 h,采用质粒快速提取试剂盒提取质粒。用NcoⅠ和XhoⅠ分别双酶切gag、pET-22b并回收目的片段,将gag连接至pET-22载体,转化DH5α感受态细胞,提取重组质粒,采用双酶切方法鉴定重组质粒,阳性质粒pET-22b-gag交由生工生物工程(上海)股份有限公司进行测序,验证其阅读框是否正确。
1.2.4 MVV和CAEV gag蛋白的生物信息学分析 采用Lasergene分析中国MVV和CAEV gag蛋白氨基酸序列相似性,采用Predicted Antigenic Peptides[18]等在线工具分别预测gag蛋白抗原决定簇。
1.2.5 重组gag蛋白的诱导表达及Western blotting分析 挑选阳性pET-22b-gag质粒,转化BL21(DE3)感受态细胞,接种到含羧苄青霉素的LB液体培养基中,在37 ℃恒温振荡培养箱中培养至OD600为0.6~0.8,加入IPTG至终浓度为1 mmol/L,37 ℃诱导表达4 h,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析表达产物。同时,将诱导表达温度降至28 ℃过夜(16~18 h)诱导表达,分别收集诱导表达培养基上清液、菌体超声波裂解物离心上清液和沉淀物,检测目的蛋白的表达形式(可溶表达或不可溶表达)。将表达产物转移至硝酸纤维膜上进行Western blotting检测,一抗、二抗选择如下:(1)以绵羊抗MVV血清为一抗,HRP标记的兔抗绵羊IgG抗体为二抗;(2)以山羊抗CAEV血清为一抗,HRP标记的兔抗山羊IgG抗体为二抗;均用TMB进行显色。
2 结果与分析
2.1 MVV gag基因重组质粒的构建
以梅迪-维斯纳病毒前病毒基因组DNA为模板,PCR扩增后得到的目的片段大小约1.4 kb(图1A)。将扩增的gag基因片段插入pET-22b质粒载体中,经过双酶切鉴定后可见1.4 kb和6.0 kb左右2个条带(图1B)。经序列测定后确定插入片段大小为1 338 bp,与美国MVV 83/84株序列(登录号:AY101611.1)的相似性为94.92%。目前,该序列已提交至GenBank(登录号:KR011757.1)。

A:MVV gag基因PCR扩增结果,其中M:DNA Marker G,1~2:gag基因,3:空白对照;B:pET-22b-gag重组质粒双酶切鉴定结果,其中N:D15000 DNA marker,1~9:pET-22b-gag阳性重组质粒双酶切鉴定结果;10:pET-22b双酶切鉴定结果。图1 MVV gag基因PCR扩增与重组质粒pET-22b-gag酶切鉴定结果Fig.1 The results of maedi-visna virus(MVV) gag gene amplified by PCR and recombinant plasmid pET-22b-gag by enzymatic digestion
2.2 gag蛋白氨基酸序列与抗原表位分析
将测序获得的gag基因序列翻译成gag蛋白氨基酸序列,与SRLVs A型(GenBank登录号为AY101611)、B型(GenBank登录号为M33677)、C型(GenBank登录号为AF322109)、E型(GenBank登录号为EU293537)gag蛋白氨基酸序列的相似性为67.7%~96.6%;与国内CAEV gs-35V株(GenBank登录号为KT749881)、CAEV山东株(GenBank登录号为KT749878)、CAEV四川株(GenBank登录号为KT214469)、CAEV贵州株(GenBank登录号为KT749880)和CAEV陕西株(GenBank登录号为KT749879)gag蛋白氨基酸序列的相似性为74.7%~74.9%(表1)。
进一步通过抗原表位预测,可以发现MVV四川株和CAEV gs-35V株的gag蛋白均存在17个抗原表位,其中MVV四川株gag蛋白的11个抗原表位与CAEV gs-35V株gag蛋白的12个抗原表位存在较高的序列相似性(图2),表明本研究中的MVV gag蛋白可能具备与抗CAEV血清交叉反应的能力。
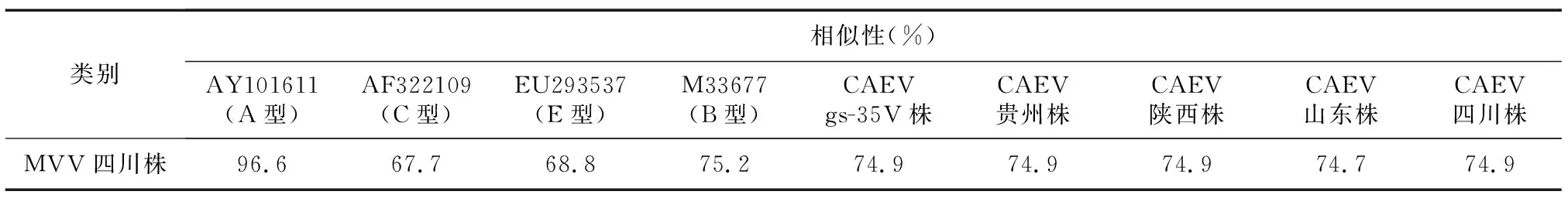
表1 MVV四川株与SRLVs gag蛋白氨基酸序列相似性分析结果
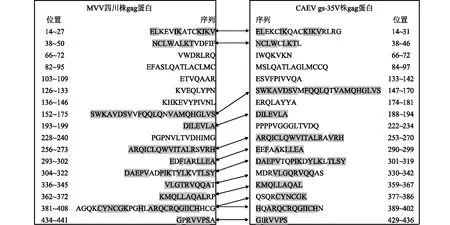
阴影部分表示氨基酸相似性位点。图2 MVV与CAEV gag抗原表位的预测与分析Fig.2 Prediction and analysis of gag epitopes between MVV and Caprine arthritis encephalitis virus(CAEV)
2.3 MVV gag重组质粒的诱导表达与反应原性分析
根据以上分析结果,将重组表达载体pET-22b-gag转入BL21(DE3),经IPTG诱导表达,可见约55 000的目的蛋白条带(图3A)。经BandScan 5.0软件分析,目的蛋白质量占总蛋白质量的23.6%。低温过夜诱导表达后,菌体超声波裂解离心上清液和沉淀物中均出现了目的条带(图3B),说明重组gag蛋白同时存在可溶性及不可溶性(包涵体)2种表达形式,但以包涵体表达形式为主。
分别采用绵羊抗MVV血清和山羊抗CAEV血清作为一抗检测重组gag蛋白的反应原性,结果表明,重组gag蛋白与绵羊抗MVV血清(图4A)和山羊抗CAEV血清(图4B)均出现血清学反应,说明重组gag蛋白具有与天然MVV和CAEV gag蛋白相似的反应原性,证实了生物信息学分析的相关结果。

A:重组gag蛋白诱导表达结果;B:重组gag蛋白表达形式的检测结果。M:蛋白Marker;1:BL21(DE3)空载对照诱导表达结果;2:pET-22b-gag/BL21(DE3)诱导表达结果;3:空白对照;4:pET-22b-gag/BL21(DE3)诱导表达培养基上清液;5:pET-22b-gag/BL21(DE3)诱导表达菌体超声裂解上清液;6:pET-22b-gag/BL21(DE3)诱导表达菌体超声裂解沉淀物。图3 重组gag蛋白在E. coli BL21(DE3)中的诱导表达与分布Fig.3 Induced expression and distribution of recombinant gag protein in Escherichia coli BL21(DE3)

A:以绵羊抗MVV血清为一抗的Western blotting分析;B:以山羊抗CAEV血清为一抗的Western blotting分析;M:蛋白Marker;1:pET-22b/BL21(DE3)空载对照诱导表达结果;2:pET-22b-gag/BL21(DE3)诱导表达阳性对照。图4 重组gag蛋白交叉反应原性分析Fig.4 Cross reactogenicity analysis of recombinant gag protein
3 讨 论
梅迪-维斯纳病被中国农业农村部列为二类动物疫病,也被中国质量监督检验检疫总局列为出入境贸易需要检疫的动物疫病。它的慢性和隐性感染不仅增加了发现该病的难度,还对中国绵羊养殖业的可持续发展构成了一定的威胁[19]。国际上一般将MVV与CAEV合称为SRLVs,其中,CAEV为中国科研人员于20世纪80年代从进口萨能奶山羊中检出并分离的病毒[20-21],被视为外来输入性传染病原。本实验室保存有中国分离的多数毒株,对这些毒株[CAEV gs-35V株(GenBank登录号为KT749881)、CAEV山东株(GenBank登录号为KT749878)、CAEV四川株(GenBank登录号为KT214469)、CAEV贵州株(GenBank登录号为KT749880)和CAEV陕西株(GenBank登录号为KT749879)]进行gag基因相似性分析,gag基因高度相似(>99%),说明中国CAEV病原较为单一。而中国MVV分离株较少,其病原分子生物学特征数据也鲜有报道。本研究尝试以中国MVV分离株为模板扩增获得gag基因序列,生物信息学分析结果表明,MVV gag蛋白氨基酸序列与中国CAEV分离株的相似性为74.7%~74.9%,且其11个抗原表位与CAEV gag蛋白的12个抗原表位具有较高的序列相似性,说明MVV gag蛋白具备与抗CAEV血清产生免疫交叉反应的结构基础。
在各种表达系统中,大肠杆菌BL21(DE3)为宿主菌的原核表达系统是最为成熟的表达系统之一[22]。它通过将目的基因片段插入原核表达载体,经过诱导表达与纯化获得所需的重组蛋白。该方法能够在较短时间内获得目的基因表达产物,成本较为低廉,是目前主要选择的原核表达系统。本研究通过将重组pET-22b-gag质粒转化BL21(DE3)菌株,成功实现了gag蛋白的原核表达,经Western blotting证实重组gag蛋白具备天然MVV和CAEV gag蛋白相似的反应原性,该研究结果可为进一步研制SRLVs通用血清学检测方法提供技术支撑。
综上所述,本研究通过分析中国MVV分离株gag蛋白氨基酸序列与中国CAEV分离株gag蛋白氨基酸序列的相似性和两者抗原表位的相似性,推测其可作为中国SRLVs的通用血清学诊断标记蛋白;以MVV的gag基因为模板构建了gag基因重组表达载体并诱导表达,成功实现了重组蛋白的表达,并经Western blotting证实了上述推测,研究结果为研制适合中国的SRLVs通用血清学检测技术方法奠定了基础。

