盐碱胁迫下京尼平苷对玉米种子萌发及根系AsA-GSH循环的影响
刘赵月, 李蕊彤, 李 晶, 顾万荣, 左师宇, 任晓松, 左月桃, 魏 湜
(东北农业大学农学院,黑龙江 哈尔滨 150300)
土壤盐化和碱化是2种不同的非生物胁迫,但经常同时发生。土壤中的可溶性盐碱浓度超出一定范围会影响土壤的理化性质,造成土壤盐碱化。全球土壤盐碱化日益严重,盐碱地面积的逐年增加与过量使用肥料及不合理灌溉等因素密切相关,目前盐碱化已成为制约农业发展的全球性问题[1]。盐碱地在中国的西北、华北和东北等粮食主产区均有分布且影响着粮食的生产及其品质[2]。黑龙江省盐碱地面积达1.34×106hm2,大部分属于苏打碱化型,多为轻度盐碱化土地,占黑龙江耕地面积的7%,主要分布在松嫩平原西部。种子萌发是幼苗生长的前提,也是衡量植物耐盐碱能力的标准之一[3]。衡量种子萌发程度和能力的指标有多种,其中发芽率、发芽势和发芽指数可以较为准确地反应种子萌发能力,研究结果表明在混合盐碱条件下,相关种子萌发指标均显著降低[4-5]。土壤中盐碱浓度超过0.2%就会抑制玉米植株吸水,超过0.4%玉米植株体内水分开始外渗。植物遭受盐碱危害首先发生渗透胁迫,使植株产生生理性缺水并抑制植物对水分、养分及矿物质的吸收,盐碱胁迫还会抑制植物组织的生长和分化,使植株产生离子胁迫,影响呼吸作用,导致植株发育迟缓,甚至死亡[6-7]。盐碱胁迫还会使细胞内积累大量活性氧(ROS),使细胞膜过氧化,发生氧化胁迫[8]。抗坏血酸-谷胱甘肽循环(AsA-GSH)是植物体内清除ROS的重要途径,通过相关抗氧化酶和抗氧化物形成抗氧化系统,该系统对保障植物在逆境胁迫下的抗氧化能力起着重要作用[9]。增强作物抗盐碱能力的措施包括改变土壤物理性质,改良耕作措施,培育耐盐碱品种以及施用外源物调节作物生理代谢过程等[10-12]。目前在农业生产上应用外源物增强作物抗盐碱性已经取得一定进展,如亚精胺[13]、水杨酸[14]、γ-氨基丁酸[15]、油菜素内酯[16]等均可有效缓解盐碱胁迫对作物的伤害。
环烯醚萜类化合物主要广泛分布于双子叶植物中,具有多种生物活性,主要包括龙胆苦苷、香草酰醇和京尼平苷等。京尼平苷(GD)也称栀子苷,在栀子中含量约5%,为天然提取物,无毒,具有很高的生物活性,易溶于水,使用安全方便。GD在药理中应用广泛,是栀子中保肝利胆功效的主要成分[17],在神经保护[18]、抗糖尿病[19]、抗炎[20]等方面均有显著疗效。张伯熙等[21-24]的研究结果表明,GD配制的复方增产剂能有效提高黄瓜、棉花、小麦和豇豆产量。钱善勤等[25-26]的研究结果表明,喷施GD能显著促进玉米幼苗生长,并且提高青菜叶片中叶绿素含量和叶绿素光能转换效率,增强叶片光合能力,进而增加可溶性糖和可溶性蛋白质含量。GD有促进植物根系生长,增加根系活性,提高植株成活率的作用,并具有抗氧化活性[27-28],在盐碱胁迫下GD对玉米种子萌发及玉米幼苗生长发育的影响尚未见报道。本研究采用营养液水培法,以不同耐盐碱玉米品种为供试材料,探究外源GD对盐碱胁迫下不同耐盐碱性玉米种子萌发、幼苗生长形态、幼苗生物量、根系渗透调节物质含量及抗氧化系统的缓解效应,为GD应用于玉米盐碱地生产提供理论和依据。
1 材料与方法
1.1 试验材料
供试玉米品种为吉龙2(耐盐碱)和欣煊58(不耐盐碱),由黑龙江省久龙种业有限公司和沈阳市欣煊农业科技有限公司提供。根据前期预备试验结果,盐碱胁迫处理的盐碱组成为NaCl∶Na2SO4∶NaHCO3∶Na2CO3=1∶9∶9∶1(摩尔浓度比),供试试剂为京尼平苷(GD),GD处理质量浓度为5 mg/L,相对分子质量为388.37,由广西山云生化科技有限公司提供,纯度>98%。
1.2 试验方法
发芽试验和水培试验于2019年6月在东北农业大学农学院220栽培生理研究室内进行。
发芽试验:选取籽粒饱满的玉米种子进行消毒处理,先将种子浸泡在10%次氯酸钠(NaClO)中消毒2 min,用蒸馏水反复冲洗并在室温下浸种8 h后置于培养皿中,每个培养皿(底部铺放2层滤纸)各放置50粒种子。设4个处理组,分别加入:(1)1/2 Hoagland营养液(CK);(2)京尼平苷+1/2 Hoagland营养液(GD);(3)盐碱溶液+1/2 Hoagland营养液(SAS);(4)京尼平苷+盐碱溶液+1/2 Hoagland营养液(SAS+GD)。京尼平苷质量浓度为5 mg/L,盐碱溶液浓度为150 mmol/L。将各处理的培养皿置于黑暗条件下的(25±1) ℃恒温培养箱中,每个培养皿分别添加20 ml相应处理液,进行种子萌发,3次重复。为了保持种子萌发环境不变,每天更换滤纸和处理液。每天定时记录种子发芽数,以胚根或胚芽冲破种皮为发芽标准,连续4 d不再有种子发芽为萌发截止。
水培试验:选取饱满均匀的玉米种子,用10% NaClO溶液浸泡消毒2 min,用蒸馏水冲洗3次并浸种8 h,移至(25±1) ℃恒温培养箱中进行催芽,48 h后选取25株长势一致的出芽种子转移至培养盆(长60 cm、宽30 cm、高15 cm)里,每盆盛有15 L 1/2 Hoagland营养液(pH为6.0±0.1)。环境条件为:保证光照12 h,温度(28±1) ℃,光照度4 000 lx,相对湿度65%~75%,每3 d更换1次营养液,每天定时用气泵通气40 min。设4个处理组,待幼苗长至三叶一心时,选取株高整齐一致的幼苗进行处理,各组处理如下:(1)对照组(CK),1/2 Hoagland营养液;(2)GD处理(GD),1/2 Hoagland营养液中添加5 mg/L GD;(3)盐碱胁迫处理(SAS),1/2 Hoagland营养液中添加混合盐碱试剂使盐碱浓度达到150 mmol/L;(4)GD和盐碱胁迫结合处理(SAS+GD),在1/2 Hoagland营养液中施用5 mg/L GD,再添加混合盐碱试剂使盐碱浓度达到150 mmol/L。为避免盐碱胁迫对玉米幼苗产生冲击,玉米三叶一心时加入5mg/L GD 12 h后,分3次加入盐碱溶液至150 mmol/L,每次加入50 mmol/L混合盐碱,间隔为12 h,GD浓度和盐碱胁迫浓度均是基于前期预备试验筛选而来。处理第4 d取样测定相应指标,以盐碱溶液浓度达到150 mmol/L记为处理0 d,各项指标均重复3次。
1.3 测定项目与方法
发芽试验测定:发芽率=[第7 d发芽种子数/培养皿内种子总数]×100%;发芽势=[第4 d发芽的种子数/培养皿内种子总数]×100%;发芽指数=∑(每日发芽种子数/发芽天数)。
水培试验测定:于处理第4 d,在各处理组取3株长势一致的幼苗,蒸馏水清洗后用滤纸吸去水分,称量茎叶与根系鲜质量。将样品放入烘箱,105 ℃下杀青30 min,然后在80 ℃下烘至恒质量,称量干质量,结果取平均值。选取各处理组3株长势一致的幼苗,用直尺从幼苗叶片最高点测量垂直高度,计算平均值。根冠比(R/T)=根干质量/地上部干质量。取幼苗根系,采用蒽酮比色法和考马斯亮蓝G-250染色法分别测定可溶性糖和可溶性蛋白质含量。取幼苗根系分别测定还原型抗坏血酸(AsA)、还原型谷胱甘肽(GSH)、脱氢抗坏血酸(DHA)含量以及氧化型谷胱甘肽(GSSG)含量[29-30],单脱氢抗坏血酸还原酶(MDHAR)活性、脱氢抗坏血酸还原酶(DHAR)活性、抗坏血酸过氧化物酶(APX)活性以及谷胱甘肽还原酶(GR)活性[31]。
1.4 数据统计
试验数据处理使用Excel2010,方法分析使用SPSS17.0软件,采用LSD法进行差异显著性分析。
2 结果与分析
2.1 京尼平苷对盐碱胁迫下玉米种子萌发的影响
构建良好的玉米种子萌发率和整齐度对于群体保障和产量保障均具有重要意义。生产上通常用发芽势、发芽率和发芽指数来反映种子萌发的能力。如表1所示,与CK相比,在盐碱胁迫下吉龙2和欣煊58的发芽势、发芽率和发芽指数均显著下降,欣煊58的下降幅度大于吉龙2;在SAS+GD处理下,与SAS处理相比,吉龙2发芽势以及两品种玉米种子的发芽率和发芽指数均明显提高,欣煊58增加幅度大于吉龙2。

表1 京尼平苷对盐碱胁迫下玉米种子发芽势、发芽率和发芽指数的影响
2.2 京尼平苷对盐碱胁迫下玉米幼苗形态的影响
如图1所示,与CK相比,两品种幼苗在盐碱胁迫(SAS)处理4 d后明显受到盐碱胁迫的伤害,其叶片和根系长度变短,株高明显低于对照组,叶片萎蔫失绿,根系发黄,须根减少,植株生长受到抑制,欣煊58叶片发黄面积多于吉龙2;SAS+GD处理有效减少叶片萎蔫失绿面积,增加须根;与CK相比,GD处理下幼苗长势旺盛,叶片宽长,根系发白,须根增多。
2.3 京尼平苷对盐碱胁迫下玉米干质量、鲜质量、株高及根冠比的影响
如表2所示,两品种玉米幼苗生长明显受到盐碱胁迫抑制,与CK相比,吉龙2和欣煊58在SAS处理下,玉米幼苗地上部和地下部的鲜质量和干质量均显著降低,株高显著降低,根冠比显著增加。与SAS处理相比,在SAS+GD处理下,吉龙2和欣煊58幼苗地上部分鲜质量、地上部干质量、地下部鲜质量均显著增加,株高显著增加,根冠比显著降低。单纯GD处理下两品种玉米幼苗干质量和鲜质量明显高于CK,同时株高增加,根冠比则无显著变化。这表明玉米幼苗生长受到盐碱胁迫的抑制,GD能有效缓解盐碱胁迫造成的伤害,对地上部分促进作用尤其显著,且对耐盐碱性较弱的品种欣煊58效果更为明显。
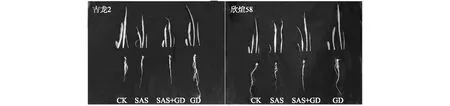
CK、SAS、SAS+GD、GD处理分别见表1注。图1 京尼平苷对盐碱胁迫下处理4 d玉米生长形态的影响Fig.1 Effects of GD on growth morphology of maize under saline-alkali stress for four days

表2 京尼平苷对盐碱胁迫下处理4 d玉米干质量、鲜质量、株高及根冠比的影响
2.4 京尼平苷对盐碱胁迫下玉米根系可溶性蛋白质和可溶性糖含量的影响
作为重要的渗透调节物质和营养物质,可溶性蛋白质对调节植物细胞内代谢和保护细胞膜起着重要作用。如图2所示,在盐碱胁迫下,与CK相比,吉龙2可溶性蛋白质含量提高66.42%,欣煊58可溶性蛋白质含量降低48.2%。与SAS处理相比,SAS+GD处理下吉龙2和欣煊58玉米幼苗根系中可溶性蛋白质含量分别提高38.2%和41.5%,吉龙2根系中可溶性蛋白质增加不显著,欣煊58根系中可溶性蛋白质含量增加显著,施用GD能够缓解盐碱胁迫对玉米根系造成的伤害。可溶性糖对稳定细胞分子结构具有重要作用。在盐碱胁迫下,与CK相比,吉龙2可溶性糖提高25.1%,欣煊58降低26.4%。与SAS处理相比,在SAS+GD处理下两品种可溶性糖含量分别提高19.1%和37.2%,差异显著。这表明耐盐碱玉米对盐碱胁迫的适应性途径之一是通过提高可溶性蛋白质和可溶性糖含量实现的,在盐碱胁迫下,GD处理可以促进渗透调节物质积累,进而缓解玉米根系受到逆境伤害。
2.5 京尼平苷对盐碱胁迫下玉米根系MDHAR、DHAR、APX和GR活性的影响
MDHAR、DHAR、APX和GR均是AsA-GSH循环中的关键抗氧化酶。如图3所示,在SAS处理下,吉龙2和欣煊58幼苗根系中MDHAR活性显著高于CK,分别提高35.8%和38.4%,DHAR活性显著低于CK,分别降低15.9%和21.5%,APX和GR活性与CK无显著差异;与SAS处理相比,在SAS+GD处理下吉龙2和欣煊58玉米根系MDHAR活性分别显著提高11.0%和10.7%,DHAR活性提高43.2%和43.1%,APX活性提高38.3%和43.5%,GR活性提高22.4%和43.9%,均差异显著,这表明GD可有效提高抗氧化酶活性以缓解幼苗根系遭受的盐碱胁迫。

同一品种不同小写字母表示处理间在0.05水平上差异显著。CK、SAS、SAS+GD、GD处理分别见表1注。图2 京尼平苷对盐碱胁迫下处理4 d玉米根系可溶性蛋白质和可溶性糖含量的影响Fig.2 Effects of GD on soluble protein and soluble sugar content in roots of maize under saline-alkali stress for four days

图3 京尼平苷对盐碱胁迫下处理4 d玉米根系APX、GR、DHAR和MDHAR活性的影响Fig.3 Effects of GD on the activities of APX, GR, DHAR and MDHAR in roots of maize under saline-alkali stress for four days
2.6 京尼平苷对盐碱胁迫下玉米根系AsA含量及AsA/DHA的影响
抗坏血酸(AsA)和脱氢抗坏血酸(DHA)均为重要的抗氧化物质,在植物细胞中起着重要作用,AsA的氧化还原势可以用抗坏血酸与脱氢抗坏血酸的比值(AsA/DHA)来表示,在逆境胁迫下AsA/DHA会发生变化,AsA/DHA降低抗氧化能力随之降低。如图4所示,SAS处理下,吉龙2和欣煊58的AsA含量显著低于CK,分别降低14.6%和16.3%,AsA/DHA也均显著低于 CK;与SAS处理相比,在SAS+GD处理下,两品种AsA含量分别显著提高31.2%和50.0%,吉龙2中AsA/DHA无显著差异,欣煊58中AsA/DHA则显著增加。这表明GD能有效促进抗氧化物含量提高,增强玉米幼苗根系在盐碱胁迫下的抗氧化能力,且对欣煊58的促进作用高于吉龙2。
2.7 京尼平苷对盐碱胁迫下玉米根系GSH含量及GSH/GSSG的影响
植物细胞中的ROS通过消耗GSH而被清除,同时生成了GSSG,GSH的氧化还原势可以用GSH/GSSG来表示。如图5所示,与CK相比,SAS处理下吉龙2和欣煊58的GSH含量分别降低27.7%和47.6%,吉龙2中GSH/GSSG与CK无显著差异,欣煊58中GSH/GSSG则显著低于CK;比起SAS处理,在SAS+GD处理下,吉龙2和欣煊58的GSH含量分别显著提高81.6%和88.2%,吉龙2中GSH/GSSG无显著变化,欣煊58中GSH/GSSG则显著高于SAS处理。在盐碱胁迫下,GD处理对两品种的GSH含量和GSH/GSSG的促进效果不同,欣煊58根系中GSH含量和GSH/GSSG变化幅度均大于吉龙2,这说明GD对不耐盐碱品种的影响作用更明显。
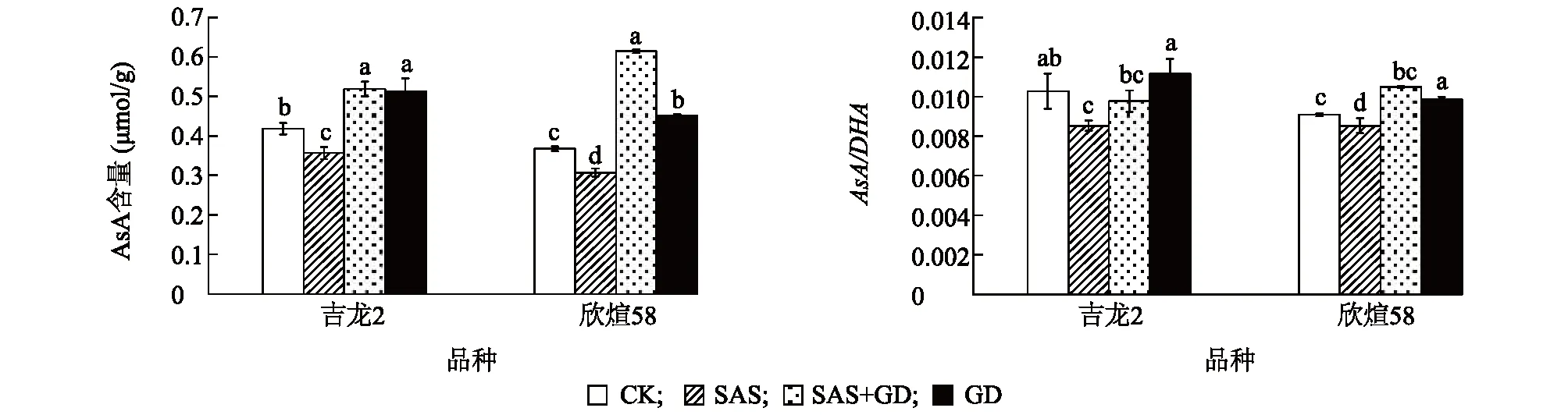
图4 京尼平苷对盐碱胁迫下处理4 d玉米根系AsA含量及AsA/DHA的影响Fig.4 Effects of GD on the content of AsA and AsA/DHA in roots of maize under saline-alkali stress for four days

图5 京尼平苷对盐碱胁迫下处理4 d玉米根系GSH含量及GSH/GSSG的影响Fig.5 Effects of GD on the content of GSH and GSH/GSSG in roots of maize under saline-alkali stress for four days
3 讨 论
两个品种玉米种子发芽势、发芽率和发芽指数在盐碱胁迫下明显降低,同时还降低玉米幼苗干质量、鲜质量及株高,增加根冠比,导致叶片萎蔫失绿,根系短黄,吉龙2根系中可溶性蛋白质和可溶性糖含量无显著变化,不足以缓解盐碱胁迫条件下活性氧积累造成的氧化胁迫,欣煊58根系中可溶性蛋白质和可溶性糖含量均显著降低,两品种根系中MDHAR酶活性增加,DHAR活性降低,AsA和GSH含量减少,AsA/DHA降低,吉龙2根系中GSH/GSSG无显著变化,欣煊58根系中GSH/GSSG降低,5 mg/L GD处理能有效缓解盐碱胁迫对玉米种子萌发和幼苗生长造成的伤害,并提高植株干质量、鲜质量及株高,降低根冠比,促进不耐盐碱品种欣煊58根系中可溶性糖和可溶性蛋白含量积累,两玉米品种根系中抗氧化酶(MDHAR、DHAR、APX和GR)活性提高,抗氧化物AsA和GSH含量增加,欣煊58根系中AsA/DHA和GSH/GSSG明显提高,GD使AsA-GSH循环中清除ROS的代谢途径达到稳定和平衡,玉米根系的抗氧化能力得到增强。GD有助于缓解盐碱胁迫对玉米种子萌发和幼苗生长的抑制作用,且GD的促进作用对不耐盐碱品种欣煊58的效果更为明显。
3.1 京尼平苷对盐碱胁迫下玉米种子萌发和生长的影响
在大田生产中,种子的萌发率和整齐度对作物生产具有重要意义,而发芽能力是保证作物高产的基础。本研究结果表明,两品种玉米种子发芽势、发芽率和发芽指数在盐碱胁迫下显著降低,说明盐碱胁迫抑制玉米种子萌发,与李玉梅等[32]的研究结果一致。这说明高浓度盐碱胁迫导致渗透压过高,种子在高渗透压环境下吸水不充分,进而影响种子萌发[33],而GD处理明显增强种子活力,提高欣煊58的发芽势以及两品种玉米种子的发芽率和发芽指数,缓解盐碱胁迫对种子萌发的伤害,其中对耐盐碱性较弱的欣煊58效果更为明显。钱善勤等[25-26,34]的研究结果表明,喷施1 mg/L、10 mg/L和100 mg/L GD均对玉米幼苗株高有显著促进作用,喷洒25mg/L GD显著提高青菜干质量和鲜质量,同时对萝卜块茎和叶鲜质量及其根冠比也有显著的提高作用,张伯熙等[21-24]的研究结果表明,京尼平苷及其复方能显著提高黄瓜与豇豆幼苗根茎的干质量和鲜质量,本研究结果表明,与对照相比,单纯GD处理能明显提高玉米幼苗干质量和鲜质量,与前人研究结果一致,这说明GD可作为生长调节剂促进玉米幼苗生长。盐碱胁迫通过抑制玉米组织和器官的生长及分化,使玉米植株发育迟缓,叶片短窄,根系发黄变短,植株的光合面积减少,根系吸收也受到抑制,植株的碳同化量随之降低,进而导致植株干质量和鲜质量降低[35]。本研究结果还表明,在盐碱胁迫下两品种玉米幼苗生长发育均受到明显抑制,叶片萎蔫失绿,根系发黄,叶片、根系长度低于对照,干质量、鲜质量降低,根冠比增加,与景宇鹏等[36]的研究结论一致。而在盐碱胁迫下,GD处理能减少叶片枯黄面积,增加干质量、鲜质量及株高,使根冠比降低,有效缓解盐碱胁迫对玉米幼苗的伤害。这说明GD不仅能作为促根生长剂应用,还能增强玉米幼苗的抗盐碱性。
3.2 京尼平苷对盐碱胁迫下玉米根系可溶性蛋白和可溶性糖含量的影响
盐碱胁迫通常导致土壤渗透压高于植物细胞,进而导致玉米细胞内水势降低,植物根部产生渗透胁迫。严重时会引发植株生理性干旱,缺水死亡,同时对植物的养分及矿物质吸收产生抑制[37]。玉米幼苗的根系比茎叶更容易受盐碱胁迫的影响,为了保证根系对水分和养分的吸收,营养物质优先分配给根系,盐碱胁迫下可溶性蛋白质和可溶性糖的积累对调节玉米幼苗渗透代谢过程有着重要意义,一来渗透调节物质可平衡渗透,增加膨压降低水势,缓解植株细胞吸水困难,维持细胞的稳定性;二来可溶性糖还能通过调节产生活性氧的代谢途径来调节ROS的产生,也可通过增加NADPH的代谢来参与抗氧化过程[38]。Kholova等[39]研究结果表明,盐碱胁迫下,渗透物质含量增加。本研究结果表明,在盐碱胁迫下,与CK相比,吉龙2根系中可溶性蛋白质和可溶性糖含量差异不显著,而欣煊58根系可溶性蛋白质和可溶性糖含量均显著降低,这说明耐盐碱品种在盐碱胁迫条件下能通过调节渗透物质含量提高耐盐碱能力。而GD处理能有效缓解盐碱胁迫对幼苗根系的抑制作用,在盐碱胁迫下,GD使欣煊58根系中可溶性蛋白质和可溶性糖含量均显著增加,这表明根系渗透调节能力提高,能缓解盐碱胁迫伤害,对根系细胞吸水性增强和维持细胞膜稳定有着重要作用。钱善勤等[25-26]的研究结果表明,GD处理能有效促进玉米幼苗、青菜叶片中可溶性蛋白质和可溶性糖含量增加。张颖等[40]的研究结果表明,喷施30 mg/L GD柳树叶片中可溶性蛋白质和可溶性糖含量明显增加。本研究中,GD处理能明显提高欣煊58根系中可溶性糖和可溶性蛋白质含量,这说明GD有利于不耐盐碱品种根系中可溶性蛋白质和可溶性糖的合成和积累,促进根系生长,根系的吸收能力提高对植株生长发育有重要作用。
3.3 京尼平苷对盐碱胁迫下玉米根系AsA-GSH循环的影响
盐碱胁迫会使植物体内积累大量的活性氧(ROS),破坏生物膜结构,使电解质外渗、酶失活。清除植物体内的ROS是保证细胞正常生理代谢的基础,抗氧化系统主要有两类,一种是非酶促类,包括GSH和AsA等抗氧化物质;另一种是酶促类,包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、APX、GR、DHAR以及MDHAR等[41-42]。AsA-GSH循环是植物体内重要的抗氧化系统,该循环中AsA在APX酶的作用下与H2O2发生反应生成MDHA,MDHA在MDHAR酶的作用下,一部分歧化生成AsA,一部分则氧化生成DHA,DHA以GSH为底物,在DHAR作用下生成AsA。GSH作为中介将H2O2还原成H2O。GSH氧化成GSSG,GSSG在GR作用下还原为GSH[43]。AsA/DHA和GSH/GSSG反映了AsA-GSH循环转运速率和植株对逆境胁迫的适应性,可作为调节抗氧化机制的信号[44]。GSH是重要的酶活性调节物质,GSH含量和GSH/GSSG是激活植物抗性基因的信号分子之一,因此GSH含量与植物抗逆能力密切相关[45]。孙德智等[46]研究发现盐碱胁迫明显降低AsA和GSH含量以及AsA/DHA、GSH/GSSG。本研究中,在盐碱胁迫下,与CK 相比,两品种玉米根系中MDHAR活性均显著升高,DHAR活性降低,抗氧化物质AsA和GSH含量显著减少,AsA/DHA以及欣煊58根系中GSH/GSSG亦降低。这说明盐碱胁迫下根系中活性氧大量积累,AsA和GSH作为抗氧化剂清除过量活性氧自由基被大量消耗,AsA含量减少促使MDHA歧化过程加快,MDHAR活性增加,MDHA大量歧化抑制了MDHA氧化为DHA的过程,因此AsA/DHA降低,同时GSH含量减少,DHAR活性降低,GR活性无明显变化,这表明GSH氧化途径受到抑制,还原途径则正常转化,对不耐盐碱品种影响明显,因此欣煊58根系中GSH/GSSG降低,盐碱胁迫明显抑制根系细胞内抗氧化系统的速率和能力。吉龙2根系中抗氧化酶活性和抗氧化物含量变化幅度明显小于欣煊58,这表明耐盐碱品种对逆境的适应性明显高于不耐盐碱品种。本研究结果还表明,在盐碱胁迫下,GD处理显著促进两玉米品种根系中APX、MDHAR、DHAR和GR酶活性增加,并提高了AsA和GSH含量以及欣煊58根系中AsA/DHA和GSH/GSSG。这表明GD通过促进抗氧化酶活性增加以及抗氧化物AsA和GSH再生,进而提高了两品种根系抗氧化系统的运行效率和抗氧化能力,根系受到的氧化胁迫伤害得到明显缓解,这说明GD有助于提高玉米幼苗根系的耐盐碱性,对不耐盐碱品种作用更为明显。

