水稻超大籽粒形成的重要基因和调控通路的转录组分析
梁文化, 孙旭超, 岳红亮, 田 铮, 陈 涛, 赵庆勇, 朱 镇, 赵 凌, 赵春芳,姚 姝, 路 凯, 王才林, 张亚东
(江苏省农业科学院粮食作物研究所/江苏省优质水稻工程技术研究中心/国家水稻改良中心南京分中心,江苏 南京 210014)
水稻粒型包括粒长、粒宽和粒厚等3个基本要素,是影响水稻产量和品质的重要农艺性状[1-2],因此粒型基因的发掘和利用一直倍受重视。目前人们已经在水稻中定位了400多个与粒型相关的数量性状座位(Quantitative trait locus, QTL),克隆的粒型基因已经超过60个,其中控制粒长的基因有GS3、GL3.1/qGL3、GLW7、TGW3、OsMADS1、GS9等[3-9],控制粒宽的基因有GW2、GW5/qSW5、GS5、GW7/GL7、GW8等[10-16],控制粒厚的基因有WTG1[17-18]。以上研究结果证实,通过调节水稻的籽粒性状可以增加水稻千粒质量,从而提高水稻产量。
GS3是水稻中控制粒长、粒质量的重要基因,对粒宽、粒厚也有一定影响,全长的GS3基因编码1个跨膜蛋白,是G蛋白的γ亚基之一,在水稻幼穗中高表达[3,19-20]。qGL3/GL3.1基因编码含有2个Kelch功能域的蛋白磷酸酶OsPPKL1,在幼穗中表达量较高,通过调控细胞周期蛋白T1;3来控制颖壳的细胞分裂,最终影响水稻籽粒大小[4-5]。GW2是控制水稻粒宽和粒质量的主效基因,在水稻各组织中都表达,该基因编码1个环型E3泛素连接酶,通过泛素介导的蛋白质降解途径负调控细胞分裂[10]。qSW5/GW5基因编码钙调素结合蛋白,对水稻粒宽、粒质量有显著影响,qSW5/GW5基因在水稻各个组织、器官中都表达,在幼穗中表达量最高[11-12,21]。GS5基因是控制水稻粒宽、粒质量和充实度的主效QTL,在幼穗中表达量较高,通过促进外稃/内稃细胞分裂和细胞膨胀而正调控水稻籽粒的大小[13,22]。GW7/GL7基因编码拟南芥LONGIFOLIA蛋白的同源蛋白,在水稻幼穗和分生组织中高表达,通过调控谷粒的细胞分裂而影响粒型[14-15]。GW8是1个SBP(Squamosa promoter binding protein)家族的转录因子,在7 cm长的水稻幼穗中表达量最高,该基因的高表达会促进细胞增殖和籽粒灌浆,从而使籽粒变宽,进而提高产量,GW8基因与GW7基因的启动子结合并抑制GW7基因的表达[16]。
本研究中的水稻材料TD70是来源于天鹅谷///9520//(72-496/苏御糯)后代粒质量超双亲的超大粒稳定品系,Kasalath为印度的常规籼稻品种,2012年正季在南京种植的TD70千粒质量为65.0 g,Kasalath千粒质量为17.4 g[23]。在前期的研究中,笔者利用TD70与小粒籼稻Kasalath构建了重组自交系(RIL)群体,共检测到19个稳定遗传的粒型相关QTL,这些QTL区间包含GS3、qGL3、GW2、qSW5/GW5、GS5、GW7及GW8共7个已克隆的粒型基因位点,遗传效应分析结果表明,TD70中这些粒型基因位点对水稻籽粒大小具有正向作用,Kasalath中不含有这些粒型基因的增效位点;进一步研究发现,TD70中不同粒型的基因组合对籽粒大小具有累加效应[24-26]。由此可见,多个粒型基因的聚合是TD70具有超大籽粒的原因,然而在多个粒型基因聚合后,水稻孕穗期幼穗表达谱中穗发育相关基因的表达和代谢通路的变化并不清晰。
近年来,转录组测序(RNA-Seq)技术已经成为研究表达谱的有力工具,研究者利用RNA-Seq技术在水稻的育性、穗发育、耐盐、耐热等方面展开了相关研究[27-33]。为了研究水稻粒型相关基因孕穗期在幼穗发育中的调控机制,本研究对超大粒粳稻TD70和小粒籼稻Kasalath孕穗期不同阶段的幼穗进行转录组测序。通过对差异表达基因的基因本体(Gene ontology, GO)富集和代谢通路的分析,从基因表达水平、代谢通路的变化方面对大粒水稻品种形成的分子调控网络进行解析,以期为在水稻育种中高效利用粒型基因奠定基础。
1 材料与方法
1.1 材料的种植与取样
大粒粳稻品系TD70为天鹅谷///9520//(72-496/苏御糯)的后代,是本研究团队自主创制的稳定品系;Kasalath是印度的一个常规籼稻品种,由江苏省种质资源保护与利用平台提供。以上材料于2018年种植于江苏省农业科学院试验田中,于2018年5月12日播种,6月12日移栽,每个小区种植4行,每行10株,株距为13.5 cm,行距为26.5 cm,每个品种种植3个小区,采用常规栽培和管理措施。研究发现,粒型相关基因在水稻幼穗中的表达比较活跃[5-7]。为了全面分析水稻抽穗前幼穗发育不同阶段表达谱的变化,笔者在水稻孕穗期取3个不同发育时期的幼穗[分别记作P1(幼穗长度为1~3 cm)、P2(幼穗长度为4~7 cm)、P3(幼穗长度为8~10 cm)]进行转录组测序,每个时期的样品取3个生物学重复,共18个幼穗样本。幼穗样品分离后立即置于液氮中速冻,于-80 ℃保存至RNA提取。
1.2 成熟种子粒型相关性状的测定
分别取5株成熟TD70、Kasalath单株的种子。每个单株随机挑选10粒饱满的种子,使用游标卡尺(精度为0.01 mm)测量种子粒长、粒宽和粒厚,千粒质量(即单株水稻1 000粒风干种子的质量)用电子天平(精度0.001 g)测定。每个性状以5株水稻所测平均值作为最终数值。
1.3 RNA提取、文库构建及转录组测序
使用TRIzol®RNA Purification Kit (Invitrogen)对水稻幼穗组织进行总RNA的提取,并用1%琼脂糖凝胶进行电泳检测。使用NanoDrop 2000、Qubit2.0、Agilent 2100分别对RNA进行纯度、浓度、完整性检测。以mRNA为模板,利用AMPure XP beads试剂盒对RNA进行纯化、打断、修复、片段选择、PCR富集等操作,构建cDNA文库。对于质量检测合格的文库,由安诺优达基因科技(北京)有限公司使用Illumina公司的NovaSeq 6000平台进行测序,测序模式为Paired-end 150 bp。
1.4 测序数据分析
原始数据下机后,首先用fastQC(Ver 0.11.9)进行测序数据质量检测与评估;原始测序数据中的接头和低质量序列,采用软件fastp(Ver 0.20.0)进行处理,设定参数保证两端序列的最小长度均≥50 bp,进而获得高质量的干净读长(clean reads)。本研究基于日本晴(Nipponbare)水稻参考基因组(http://plants.ensembl.org/index.html,IRGSP-1.0),按照Trapnell等已发表的转录组分析的经典流程进行数据分析[34]。首先,用软件包Tophat2(Ver 2.1.1)将得到的clean reads与参考基因组进行比对[34-35],进一步利用Samtools(Ver 1.6)软件获得特异性比对结果[36]。然后,基于Tophat 2比对的结果,使用Cufflinks(Ver 2.2.1)软件包进行基因表达量的计算和差异基因的寻找。采用FPKM(Fragments per kilobase of transcript per million fragments mapped)评价每个基因的表达丰度,同时过滤多个样本中FPKM<1的假阳性转录本。进一步利用软件Cuffdiff(Ver 2.2.1)对水稻幼穗不同发育阶段的差异表达基因(Differentially expressed genes, DEGs)进行鉴定,差异表达基因的筛选条件如下:log2(fold change)≥1(fold change代表某个基因在2个材料中的表达量),q值<0.05[34]。将DEGs与美国国家生物信息中心(National Center for Biotechnology Information, NCBI)网站上的nr蛋白数据库进行比对,预测其基因功能,然后利用GO、KEGG数据库对差异表达基因进行功能分类和代谢途径的富集分析。
1.5 荧光定量PCR(qRT-PCR)验证
利用qRT-PCR定量技术分析部分差异表达基因的表达丰度。使用Primer Premier(Ver 5.0)软件进行引物设计,16个基因的引物序列见表1。用与RNA-Seq建库同批次的RNA进行qRT-PCR验证。使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix kit (TransGen Biotech)进行cDNA第一链合成。定量PCR在ABI Step One Plus Real-Time PCR System (Applied Biosystems)上进行,使用的试剂为SYBR PremixExTaqTMRT-PCR kit (TaKaRa)。以水稻基因OsActin-1[基因识别号(ID):Os03g0718100]作为内标,通过相对定量的方法获得测定值[37]。
2 结果与分析
2.1 TD70与Kasalath的粒型分析
研究发现,特大粒水稻品系TD70中聚合了GS3、qGL3、GW2、qSW5/GW5、GS5、GW7及GW8共7个对籽粒大小具有正向效应的粒型基因;小粒籼稻Kasalath中不含有上述基因[24-26]。于2018年正季测定成熟水稻的籽粒大小,由图1可以看出,TD70平均粒长11.78 mm,粒宽4.49 mm,粒厚2.99 mm,千粒质量66.72 g,其千粒质量显著高于Kasalath(17.94 g)。t检验结果表明,TD70的粒长、粒宽、粒厚及千粒质量均高于Kasalath,2份材料之间的差异达到极显著水平(P<0.01);而TD70的长宽比则小于Kasalath,二者之间的差异也达到极显著水平(P<0.01)。由此可见,多个粒型基因的聚合增加了水稻粒长、粒宽和粒厚,从而产生了超大籽粒,进而提高了千粒质量。

表1 用于qRT-PCR表达分析的引物序列
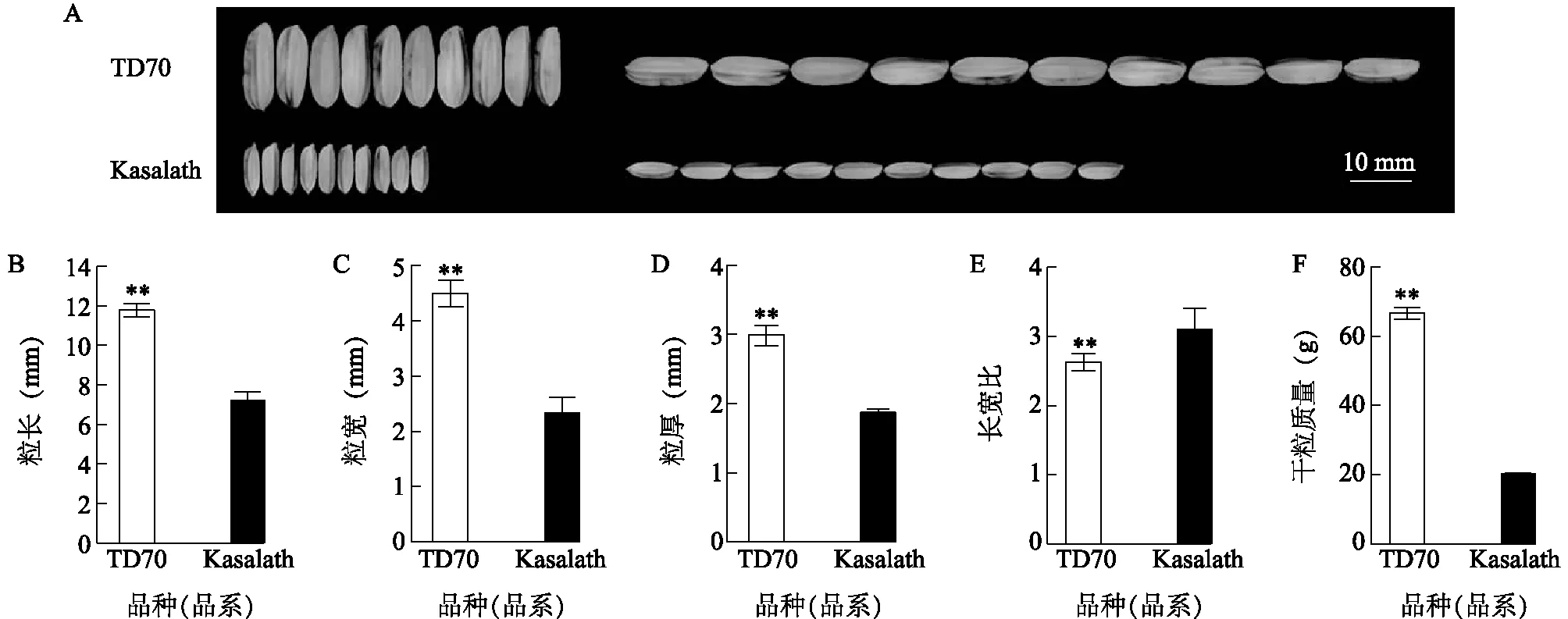
A:籽粒形态特征;B:粒长;C:粒宽;D:粒厚;E:长宽比;F:千粒质量;各表型特征图中的**表示经t检验,2个材料间存在极显著差异(P<0.01)。图1 TD70和Kasalath的籽粒表型特征差异Fig.1 Differences of grains phenotypic characteristics between TD70 and Kasalath
2.2 2个水稻材料幼穗中转录组测序及序列比对
本研究通过对2个水稻材料的18个水稻幼穗样本测序文库进行测序,得到的原始read数共为857 017 092条,平均每个测序文库得到47 612 061条原始read。进行去除接头、去污染和去低质量处理后,平均每个测序文库获得的clean read数量为45 474 692条。通过FastQC软件对clean数据的测序质量进行检测,结果表明,18个测序文库碱基的Q30(测序碱基准确率为99.9%的read)比例最低为91.9%,最高为93.0%,平均为92.2%,可见测序质量较高。利用Tophat软件包将测序得到的每个clean数据回贴到参考基因组中。从表2可以看出,clean数据比对到参考基因组的最低概率为83.2%,最高达到90.9%。特异性比对(Unique alignment)到日本晴基因组中唯一位点的概率为74.4%~85.1%,平均为79.9%。TD70比对到参考基因组的概率明显高于Kasalath,这可能是籼粳稻之间基因组的差异造成的。
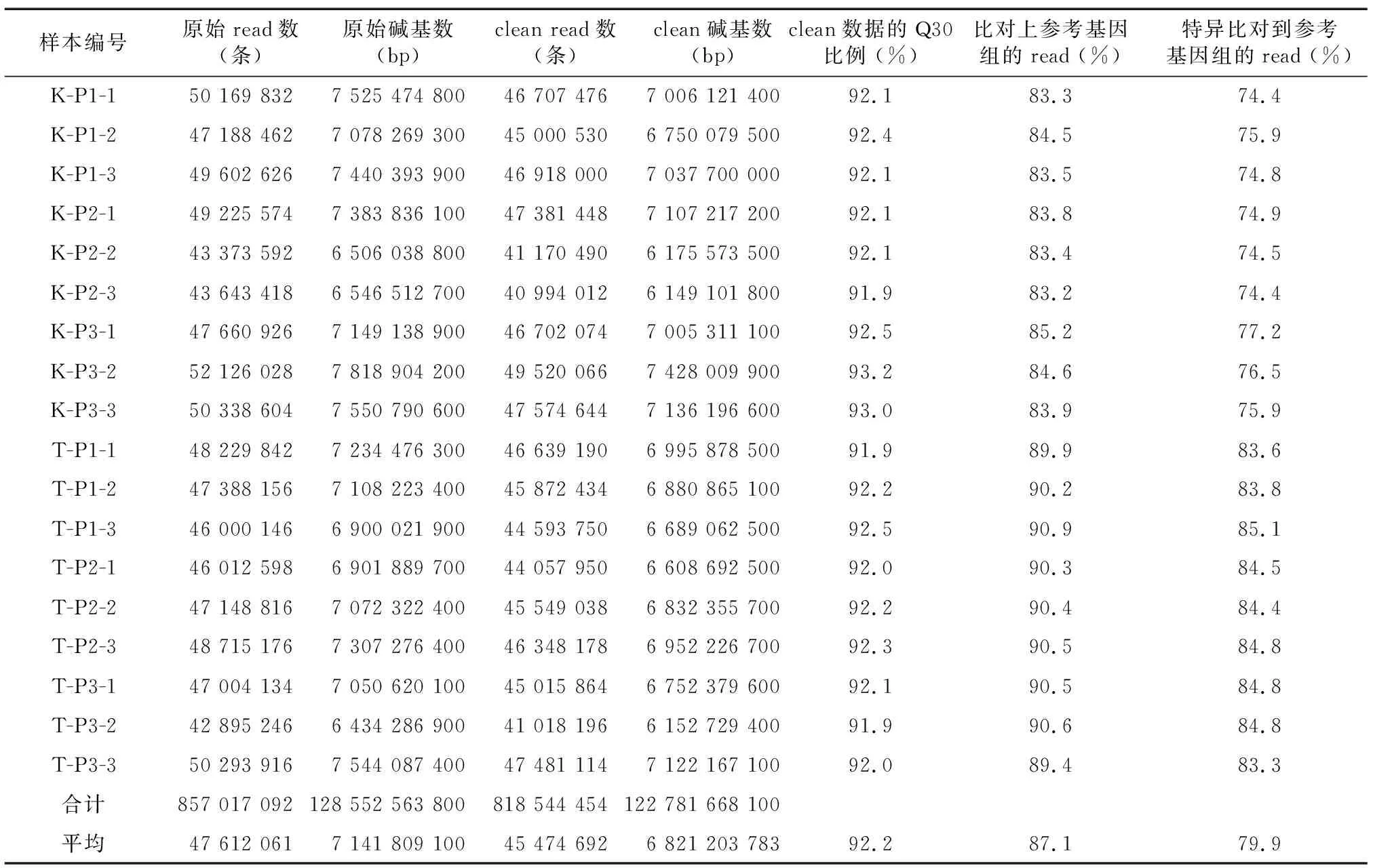
表2 测序数据统计及与水稻幼穗中基因组比对
2.3 2个水稻材料幼穗中转录组的整体分析
为了分析TD70和Kasalath在水稻孕穗期幼穗中表达谱的动态差异,笔者对至少在1个样本中表达的基因进行斯皮尔曼相关系数(Sppanicleman correlation coefficient, SCC)分析和主成分分析(Principal component analysis, PCA)。结果显示,每个样本的3个生物学重复间的最低相关系数为0. 947 2,说明测序样本生物学重复具有较好的重现性。从图2A可以看出,同一水稻材料不同时期的样本间也存在相关性;2个水稻材料在相同发育时期的幼穗间存在一定差异;TD70中后期(P2和P3)的幼穗具有一定的相似性而与前期的差异较大,Kasalath也存在类似的情况。由图2B可以看出,2个水稻材料在早期(P1)幼穗中表达谱具有明显差异;随着水稻幼穗的发育,在中后期(P2、P3)幼穗中表达谱的差异进一步扩大,这暗示2个水稻材料在幼穗发育早期表达谱已经出现差异,可能是造成后期水稻籽粒大小差异的原因。
2.4 2个水稻材料幼穗中差异表达基因分析
根据Cufdiff的检测结果,设定差异表达基因的标准为q<0.05,差异表达倍数≥2,对TD70与Kasalath不同大小幼穗的3个比较组(TD70-P1/Kasalath-P1、TD70-P2/Kasalath-P2、TD70-P3/Kasalath-P3)进行差异表达基因分析。结果显示,P1期有3 618个差异表达基因,其中2 436个基因上调表达,1 182个基因下调表达;P2期共获得4 183个差异表达基因,其中2 368个基因上调表达,1 815个基因下调表达;P3期获得的差异表达基因数共5 254个,其中2 426个基因上调表达,2 828个基因下调表达。由图3A可见,随着水稻幼穗的发育,2个材料间差异表达的基因数明显增多,说明后期有更多基因参与到小穗发育进程中。从差异表达基因文氏图(图3B)看出,在3个时期都差异表达的基因有1 742个,在P1、P2、P3时期特异的差异表达基因分别有1 055个、990个、2 096个。说明水稻幼穗在不同发育时期的差异表达基因既有共性的,也有不同时期特异性的。
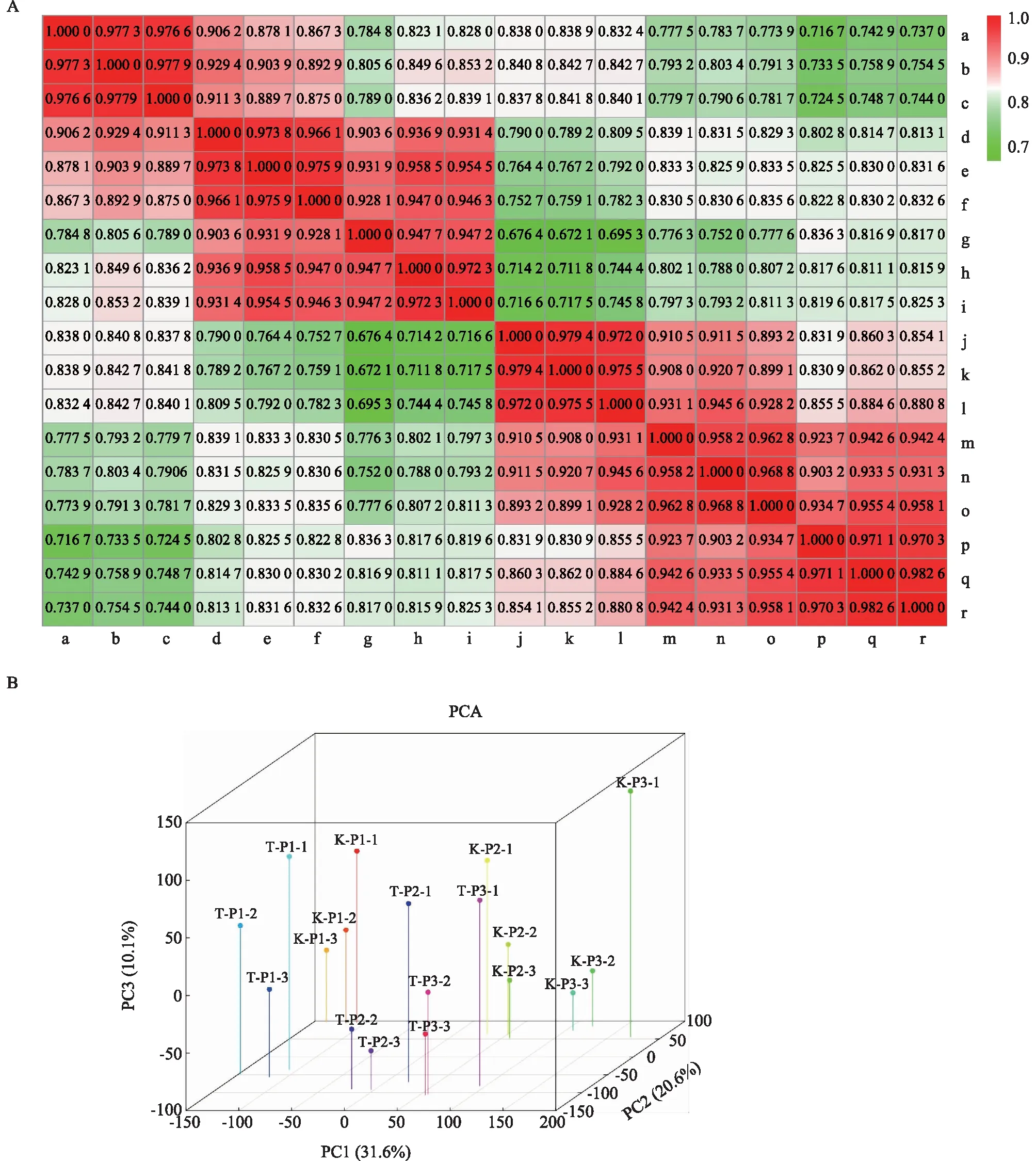
A:通过Sppanicleman相关系数计算3个生物学重复之间的相关性,比例尺中数据表示斯皮尔曼相关系数;B:主成分分析显示TD70和Kasalath不同发育阶段幼穗的转录组聚类关系。图A中,a:K-P1-1;b:K-P1-2;c:K-P1-3;d:K-P2-1;e:K-P2-2;f:K-P2-3;g:K-P3-1;h:K-P3-2;i:K-P3-3;j:T-P1-1;k:T-P1-2;l:T-P1-3;m:T-P2-1;n:T-P2-2;o:T-P2-3;p:T-P3-1;q:T-P3-2;r:T-P3-3。K:Kasalath;T:TD70;P1、P2、P3:孕穗期1~3 cm、4~7 cm、8~10 cm长度的幼穗;1、2、3:样本的3个生物学重复。图2 2个水稻材料幼穗发育不同阶段转录组之间的相关性Fig.2 Correlation between transcriptomes of two rice materials at different young panicles development stages

A:TD70和Kasalath幼穗发育不同时期差异表达基因统计结果;B:差异表达基因在水稻幼穗发育3个时期的分布情况。K:Kasalath;T:TD70;P1、P2、P3:孕穗期1~3 cm、4~7 cm、8~10 cm长度的幼穗;1、2、3:样本的3个生物学重复。图3 2个水稻材料幼穗间差异表达基因的统计Fig.3 Statistics of differentially expressed genes between two rice materials
2.5 2个水稻材料幼穗中差异表达基因的qRT-PCR表达验证
从转录组测序结果中选取16个基因,包括TD70中已知的7个粒型基因GS3、qGL3、GW2、qSW5/GW5、GS5、GW7和GW8。利用qRT-PCR分析这些基因在2个水稻材料不同发育时期幼穗中的相对表达水平,对转录组数据进行可靠性验证。图4显示,16个基因的转录组测序结果与qRT-PCR结果一致,表明转录组测序结果可靠。同时,对粒型基因在不同发育时期幼穗中的表达模式进行分析,结果发现,qGL3基因在TD70幼穗发育早期下调表达,随着幼穗的发育,在中后期表现为上调表达;GW7、GW8基因在TD70幼穗发育过程中始终上调表达;其余4个粒型基因在Kasalath 3个幼穗发育时期的表达水平均高于TD70。由此可见,以上7个粒型基因在2个水稻材料幼穗中具有不同的表达模式,对水稻籽粒发育调控的作用和时期亦不同。

A:识别号(ID)为Os03g0646900、Os03g0407400、Os08g0531600、Os05g0187500基因分析;B:识别号(ID)为Os02g0244100、Os07g0603300、Os05g0158500、Os11g0247300基因分析;C:识别号(ID)为Os03g0687700、Os04g0580700、Os09g0309600、Os02g0638650基因分析;D:识别号(ID)为Os06g0147500、Os12g0114800、Os01g0944200、Os03g0712800基因分析。fold change表示某个基因在2个水稻材料幼穗中的表达量。x坐标轴上的1、2、3分别表示比较组T-P1/K-P1、T-P2/K-P2、T-P3/K-P3;T:TD70;K:Kasalath;P1、P2、P3:孕穗期1~3 cm、4~7 cm、8~10 cm长度的幼穗。图4 2个水稻材料幼穗中差异表达基因的qRT-PCR分析Fig.4 The qRT-PCR analysis of differentially expressed genes in two rice cultivars
2.6 2个水稻材料幼穗中差异表达基因的GO富集与代谢通路分析
生物体内生物学功能的行使需要不同基因共同协调完成,为了探究差异表达基因的生物学功能,笔者对2个水稻材料3个幼穗发育时期的差异表达基因(数量分别为3 618个、4 183个、5 254个)按照GO的3个类别的生物进程(Biological processes, BP)、细胞组分(Cellular components, CC)和分子功能(Molecular functions, MF)进行功能富集分析。结果显示,共有4 374个差异表达基因得到注释,P1、P2和P3这3个时期分别注释到1 825个(50.44%)、2 267个(54.20%)、2 929个(55.75%)基因。在水稻幼穗发育的P1阶段,代谢进程(GO编号:0008152)、DNA结合(GO编号:0005488)及细胞进程(GO编号:0005623)分别是生物学进程、分子功能和细胞组分3个类别中富集到最多基因的分组。差异表达基因在生物学途径中的生物进程调节(GO编号:0050789)、信号(GO编号:0023052)、生殖进程(GO编号:0022414)及发育过程(GO编号:0032502)等二级分类中较为集中。同时,在生长(GO编号:0040007)、细胞增殖(GO编号:0008283)等可能与水稻颖壳大小密切相关的代谢途径中也有差异表达基因显著富集。在分子功能方面,差异表达基因主要富集在催化活性(GO编号:0003824)、转运活性(GO编号:0005215)及分子功能调节(GO编号:0098772)等功能类别中。在细胞组分方面,膜系统(GO编号:0016020)、细胞器(GO编号:0043226)及蛋白质复合体(GO编号:0032991)等细胞代谢相关的重要组分的差异表达基因较多。通过以上GO富集分析发现,在水稻幼穗发育过程中,基因的转录调控、物质的合成与运输以及信号转导等代谢活动较为活跃。此外,随着水稻幼穗的生长发育,富集到的差异表达基因数量逐渐增加,说明在幼穗发育后期,生物学进程更加活跃、复杂,因而参与调控的基因也更多(图5)。
利用KEGG数据库对差异表达基因进行代谢通路分析。结果表明,在水稻的3个幼穗发育时期分别有217个、258个、332个基因得到注释,共涉及119条KEGG代谢通路。同一个KEGG中包含10个以上差异表达基因的通路主要有内质网中的蛋白质加工通路、淀粉和蔗糖代谢通路、激素信号转导通路、氨基酸生物合成通路、碳代谢通路以及核糖体通路等,其中内质网中的蛋白质加工通路在水稻的3个幼穗发育阶段都被显著富集,淀粉和蔗糖代谢通路、碳代谢通路在水稻幼穗发育后期显著富集。此外,次生代谢产物的生物合成通路也富集到大量基因,表明次生代谢产物在水稻幼穗发育过程中可能也有重要作用(表3)。
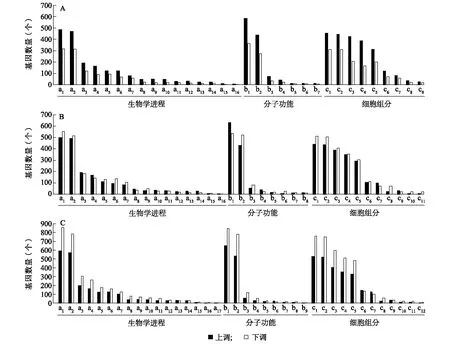
A:T-P1/K-P1差异表达基因的GO结果;B:T-P2/K-P2差异表达基因的GO结果;C:T-P3/K-P3差异表达基因的GO结果。T:TD70;K:Kasalath;P1、P2、P3:孕穗期1~3 cm、4~7 cm、8~10 cm长度的幼穗。图A中,a1:代谢进程;a2:细胞进程;a3:生物调节;a4:生物进程调节;a5:刺激反应;a6:定位;a7:细胞组分组织或生物发生;a8:信号;a9:多细胞有机体进程;a10:发育进程;a11:生物进程正调节;a12:多种生物进程;a13:生殖进程;a14:生殖;a15:生长;a16:细胞增殖;b1:DNA结合;b2:催化活性;b3:转运活性;b4:转运调节活性;b5:结构分子活性;b6:分子功能调节;b7:抗氧化活性;c1:细胞;c2:细胞部分;c3:膜;c4:膜部分;c5:细胞器;c6:细胞器部分;c7:蛋白质复合体;c8:胞外区;c9:膜封闭腔。图B中,a1:代谢进程;a2:细胞进程;a3:生物调节;a4:生物进程调节;a5:刺激反应;a6:定位;a7:细胞组分组织或生物发生;a8:信号;a9:发育进程;a10:多细胞有机体进程;a11:生物进程正调节;a12:多种生物进程;a13:生殖进程;a14:生殖;a15:生长;a16:细胞增殖;b1:DNA结合;b2:催化活性;b3:转运活性;b4:转运调节活性;b5:分子功能调节;b6:抗氧化活性;b7:结构分子活性; b8:分子转运活性;c1:细胞;c2:细胞部分;c3:膜;c4:膜部分;c5:细胞器;c6:细胞器部分;c7:蛋白质复合体;c8:胞外区;c9:膜封闭腔;c10:细胞连接;c11:共质体。图C中,a1:代谢进程;a2:细胞进程;a3:生物调节;a4:生物进程调节;a5:刺激反应;a6:定位;a7:细胞组分组织或生物发生;a8:发育进程;a9:信号;a10:多细胞有机体进程;a11:生物进程正调节;a12:多种生物进程;a13:生殖;a14:生殖进程;a15:生长;a16:免疫系统过程;a17:细胞增殖;b1:DNA结合;b2:催化活性;b3:转运活性;b4:转运调节活性;b5:分子功能调节;b6:结构分子活性;b7:分子转运活性;b8:抗氧化活性;b9:分子转运活性;c1:细胞;c2:细胞部分;c3:膜;c4:膜部分;c5:细胞器;c6:细胞器部分;c7:蛋白质复合体;c8:胞外区;c9:膜封闭腔;c10:细胞连接;c11:共质体;c12:超分子复合物。图5 TD70和Kasalath在水稻幼穗不同时期差异表达基因的功能分析Fig.5 Functional analysis of differentially expressed genes in TD70 and Kasalath at different stages of young panicles
2.7 2个水稻材料幼穗中差异表达的转录因子分析
转录因子通过结合到靶基因启动子区域特定的元件上以调控基因的表达,在植物生长发育中起着重要作用。已克隆的粒型基因GW8基因属于SBP转录因子家族,GLW7属于SPL(Squamosa promoter binding protein-like)转录因子家族,LG3属于AP2转录因子家族,OsMADS1为MADS-box家族转录因子[6,8,15,38]。由此可见,转录因子在水稻幼穗发育中有重要的调控作用。通过转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)和NCBI的nr数据库对差异表达基因进行注释,共得到来自43个家族的349个已知或者预测的转录因子,如图6所示,其中有3个ARF(生长素相应因子)家族的转录因子,32个bHLH(Basic helix-loop-helix)家族的转录因子,34个ERF(乙烯相应因子)家族的转录因子,10个MADS-box家族的转录因子,这些差异表达的转录因子可能对幼穗发育具有重要的调控作用。进一步分析发现,与Kasalath相比,TD70中粒型基因OsLG3在P1期显著上调表达,在P2、P3期的表达量没有显著差异;GW8基因在幼穗中3个时期均上调表达,但差异不显著,GLW7基因的表达模式与GW8基因相反;OsMADS1基因表达量在2个材料间差异不显著。这可能是由于TD70与Kasalath的遗传背景差异较大,同时TD70中聚合了多个粒型基因,而不同基因在调控水平上可能存在互作等。

表3 KEGG通路中10个以上差异表达基因的代谢通路信息
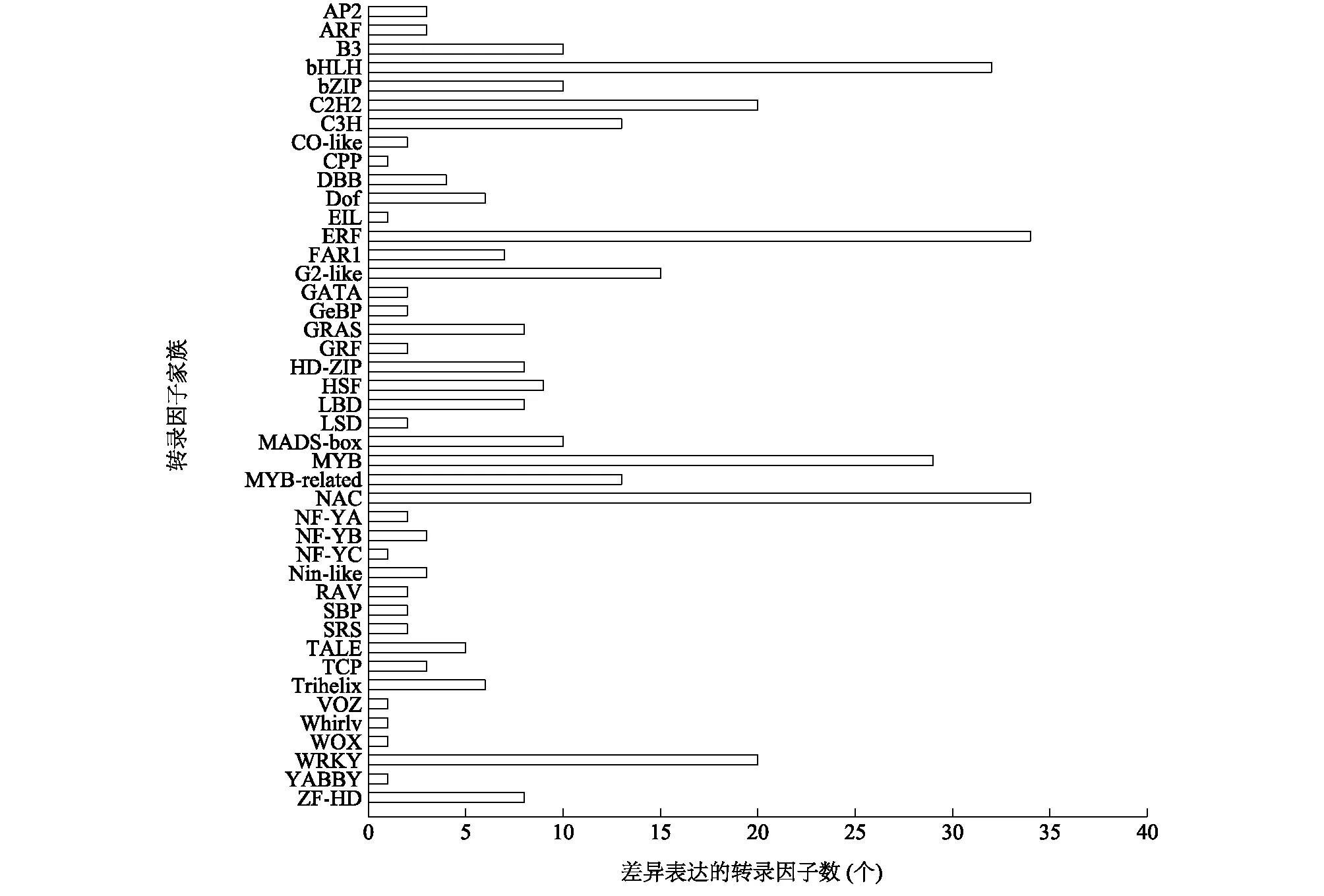
图6 2个水稻材料幼穗中差异表达的转录因子分析Fig.6 Analysis of differentially expressed transcription factors in two rice materials
3 讨 论
水稻粒型基因的研究一直倍受重视,目前研究者已经定位并克隆了大量粒型基因,然而水稻超大籽粒形成的分子机制尚不清晰。本研究对相同发育阶段TD70、Kasalath水稻的幼穗进行比较,在P1、P2和P3发育阶段分别获得3 618个、4 183个和5 254个差异表达基因,差异表达基因的数量随着幼穗的发育逐渐增加,可能由于在幼穗发育后期,调控网络更加复杂,参与的基因也更多。GO富集分析显示,这些差异表达基因涉及的生物学途径主要集中在信号(GO编号:0023052)、细胞增殖(GO编号:0008283)、催化活性(GO编号:0003824)、转运活性(GO编号:0005215)、膜系统(GO编号:0016020)、蛋白质复合体(GO编号:0032991)等细胞代谢相关的重要途径。由此可见,孕穗期幼穗的发育涉及信号转导、细胞分裂、物质转运等重要进程,这些生物学途径在孕穗期对水稻幼穗的发育起到至关重要的作用。以上研究结果与前人对水稻幼穗的转录组研究结果基本一致[31-33]。研究发现,GS5、GW7/GL7、GW8等粒型基因通过调控水稻颖壳细胞周期的变化而调控粒型[14-16,21]。TD70超大籽粒是多个粒型基因聚合的结果,不同粒型基因涉及膜蛋白、激素以及各类酶类等大分子相关途径,通过调节颖壳细胞分裂和生长而最终影响籽粒大小[24-26]。通过KEGG数据库对幼穗3个发育时期都差异表达的基因进行代谢通路的富集分析,结果显示,差异表达基因共涉及119条KEGG代谢通路;内质网中的蛋白质加工、淀粉和蔗糖代谢、碳代谢、激素信号转导等多个通路代谢旺盛。细胞周期蛋白和细胞分裂素相关基因在幼穗发育的3个时期表现出显著差异,推测在幼穗发育过程中2个材料颖壳细胞分裂的差异是后期二者籽粒大小差异的重要原因。通过GO和KEGG分析发现,调控通路的差异涉及生命大分子物质的合成与代谢、激素信号转导及膜系统等,可以为水稻幼穗细胞分裂、生长与分化等生命过程提供重要的物质基础、能量来源以及重要的分子信号等。
转录因子作为重要的调节蛋白,在水稻穗发育和籽粒形成过程中起着重要作用[39]。本研究发现,在2个水稻材料幼穗中349个转录因子的表达量存在显著差异,其中包括AP2、ARF、bHLH、MYB、MADS等家族的转录因子。在多个物种中的功能鉴定结果表明,植物中MYB转录因子家族具有调节植物发育、开花时间等不同的功能[40]。MADS转录因子家族在植物生殖器官发育中起到重要的调节作用,OsMADS1基因与水稻G蛋白互作对籽粒大小具有调控作用[8]。综上可见,转录因子对水稻孕穗期幼穗的发育和籽粒形态有重要的调控作用。
本研究通过对不同大小的水稻幼穗进行转录组深度测序,系统地揭示了特大粒水稻TD70幼穗发育在不同时期表达谱的变化,为进一步研究水稻籽粒发育过程中基因互作网络以及粒型基因在分子育种中的有效利用提供了理论依据。

