桃金娘鞣质抗猪流行性腹泻病毒作用研究
刘 伟,银慧慧,何 颖,赵 武,冯林川,孟 菲,施 文,姜源明,覃振华,孙建华
(1.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁 530001; 2.广西康普动物保健品股份有限公司,南宁 530001; 3. 广西大学动物科学技术学院,南宁 530005)
鞣质是广泛分布于植物体内的一类结构比较复杂的多元酚类化合物[1],具有抑菌、抗氧化、抗病毒等多方面的药理活性[2]。鞣质含有多个酚羟基具有较强极性,遇金属离子生成缩合物而不易提出,遇酸碱不稳定,温度过高发生分解或变性,多数水溶性多酚类化合物能溶于水,但同时发生水解[2-3]。因此,从植物中提取分离完整的鞣质成分并保存其生物活性,对工艺条件有较高的要求。课题组在前期研究中曾利用超临界CO2萃取技术在低温、非水溶剂状态下从桃金娘[Rhodomyrtustomentosa(Ait)Hassk., Myrtle]根茎中分离得到一种鞣质[4]。当前,对桃金娘鞣质抗病毒作用的研究还比较少,因此本研究进行了桃金娘鞣质抗猪流行性腹泻病毒(Porcine Epidemic Diarrhae Virus,PEDV)试验,以期为开发桃金娘新兽药提供试验基础和理论依据。
1 材料与方法
1.1 材料
1.1.1 试验药物 桃金娘鞣质,由广西兽医研究所兽药新技术开发中心从野生桃金娘根茎中分离,制成50 mg/mL无菌溶液;利巴韦林注射液,江苏鹏鹞药业有限公司,国药准字H19993415,产品批号: 1804292611。
1.1.2 病毒和细胞株 猪流行性腹泻病毒分离株(PEDV-CH/GX/2015/750A),由广西兽医研究所病毒研究室分离鉴定、保存;PK细胞株,广西壮族自治区兽医研究所生物技术重点实验室保存。
1.1.3 主要试剂与设备 胎牛血清、MTT购自Gibco公司;DMEM培养基、PBS、胰蛋白酶购自Sigma公司;猪流行性腹泻病毒实时荧光RT-PCR检测试剂盒购自北京世纪元亨公司;其他试剂均为分析纯;Lightcycler2.0荧光定量PCR仪,Roche公司。
1.2 试验方法
1.2.1 PEDV细胞毒力测定 对数生长期的细胞经胰酶消化,调整浓度为1×105/mL,按100 μL/孔加入96孔细胞培养板,培养24 h长成单层,弃培养液,依次接种经10倍连续稀释的病毒液100 μL/孔,每浓度重复8孔,设细胞对照;37 ℃ 5% CO2培养箱中培养24 h,倒置显微镜观察细胞病变(CPE),并按MTT法酶标仪测定各孔在波长490 nm处吸光度A490,根据 Reed-Muench公式计算PEDV半数感染浓度(TCID50)。
细胞存活率=各组A490值/正常细胞A490值×100%
比距=(高于50%病变率-50%)/(高于50%病变率-低于50%病变率)×100%
TCID50=Antilog(高于50%病变的病毒最高稀释度对数+比距×稀释系数的对数)
1.2.2 桃金娘鞣质细胞毒力测定 对数生长期的细胞经胰酶消化,调整浓度为1×105/mL,按100 μL/孔加入96孔细胞培养板,培养24 h长成单层,弃培养液,桃金娘鞣质用细胞维持液按2倍比稀释10个浓度梯度,按100 μL/孔依次接种,每浓度重复8孔,设空白对照组和细胞对照;37 ℃ 5% CO2培养箱中培养24 h,倒置显微镜观察细胞病变(CPE),按MTT法,酶标仪测定各孔在波长490 nm处吸光度A490,根据 Reed-Muench公式计算药物半数中毒浓度(TC50),依靠浓度梯度试验直接测定最大无毒浓度(TC0)。
TC50=(Antilog高于50%CPE百分率病毒稀释度对数+比距)×初始浓度
1.2.3 桃金娘鞣质体外抗PEDV测定 将1×105/mL对数生长期的细胞按100 μL/孔加入96孔细胞培养板,培养24 h长成单层,弃培养液;试验药物组将桃金娘鞣质从最大无毒浓度按10倍比稀释5个滴度浓度,50 μL/孔依次加入96孔板中,随后加入100 TCID50的病毒液50 μL/孔,混合均匀,每浓度重复8孔;同步设利巴韦林药物对照组、细胞对照组、病毒对照组和空白对照组。37 ℃ 5% CO2培养箱中培养48 h,倒置显微镜观察细胞病变(CPE),按MTT法,酶标仪测定各孔在波长490 nm处吸光度A490,根据 Reed-Muench公式计算药物半数有效浓度(EC50)及治疗指数(TI)。
EC50=Antilog(高于50%CPE百分率病毒稀释度的值-比距)×初始浓度
TI=半数毒性浓度(TC50)/半数有效浓度(EC50)
1.2.4 桃金娘鞣质体内抗PEDV试验 60只昆明种小鼠,雌雄各半,随机均分为6组。第1组为药物低剂量组,给予桃金娘鞣质25 mg/kg;第2组为药物中剂量组,给予桃金娘鞣质50 mg/kg;第3组为药物高剂量组,给予桃金娘鞣质100 mg/kg;第4组为阳性药物组,给予利巴韦林25 mg/kg;灌胃给药,灌服容积为1 mL/只,给药0.5 h后各组均以100 TCID50剂量PEDV灌胃攻毒;第5第6组分别为病毒对照组和阴性对照组。攻毒后第48 h,处死试验小鼠,摘取并称量肠系膜淋巴结,置于研磨器中加入无菌生理盐水或PBS缓冲液研磨,匀浆后转至灭菌离心管中,反复冻融3次,8000 r/min离心2 min,取上清-80 ℃保存备用。按照北京世纪元亨公司柱式RNA核酸提取试剂盒使用说明书进行PEDV RNA提取;按照世纪元亨猪流行性腹泻病毒实时荧光RT-PCR检测试剂盒使用说明书进行PEDV的扩增,主要反应条件为42 ℃ 5 min,95 ℃ 10 s;循环95 ℃ 5 s,60 ℃ 35 s,共40次;在每次循环第二步(60 ℃ 35 s)收集荧光信号;每个样品做3个重复。按照F=2-△△Ct公式计算相对病毒载量。
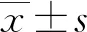
2 结果与分析
2.1 桃金娘鞣质体外抗病毒作用 经测试,PEDV对PK细胞的TCID50为10-4.1。由表1可知,桃金娘鞣质与对照药物利巴韦林对PK细胞体系中的PEDV都具有一定的抑制作用,桃金娘鞣质EC50高于利巴韦林(P<0.05),表明桃金娘鞣质抑制病毒需要更高的药物浓度;桃金娘鞣质对PEDV的TI值显著优于利巴韦林(P<0.05),表明桃金娘鞣质及其成分具有较大抗病毒研究价值。
2.2 桃金娘鞣质体内抗病毒作用 由图1可知,桃金娘鞣质高、中、低剂量组和对照药物利巴韦林组小鼠肠系膜淋巴结PEDV含量均显著低于病毒对照组(P<0.05),显示体内抑制PEDV增殖作用;桃金娘鞣质高、中剂量组体内抑制病毒效果明显优于对照药物利巴韦林组(P<0.05);桃金娘鞣质高剂量、中剂量、低剂量组间对PEDV的抑制作用具有生物统计学差异(P<0.05),呈现一定量效关系。

表1 桃金娘鞣质体外抗PEDV作用Tab 1 Effects of myrtle tannins anti-PEDV in vitro
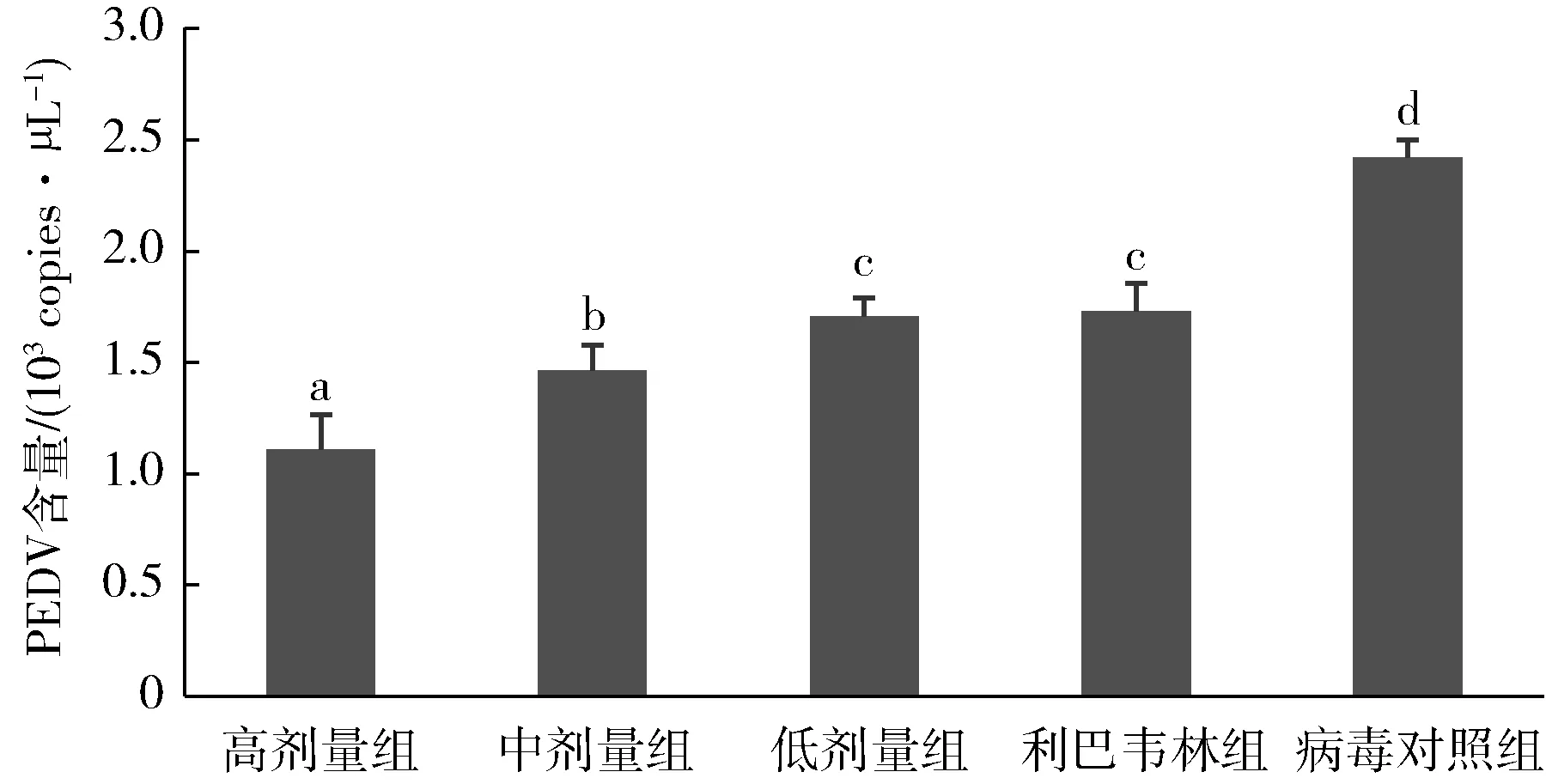
标注不同字母表示组间差异显著(P<0.05) different letters indicate that there are significant differences between groups(P<0.05)图1 桃金娘鞣质对小鼠肠系膜淋巴结PEDV含量的影响Fig 1 Effects of myrtle tannins on PEDV content in mesenteric lymph nodes of mice
3 讨论与结论
PEDV属于冠状病毒科冠状病毒属病毒,引起以呕吐、腹泻、脱水为主要临床特征的猪流行性腹泻(PED)。PED尤其危害仔猪,年龄越小越易感,症状越重,死亡率越高,临床上缺乏防治特效药物,PED每年都给养猪业造成严重损失[5]。研究中草药抗PEDV药理活性,从传统中草药中发掘抗PEDV化学成分或组方,是研发PED临床防治药物的重要途径。桃金娘是中国南方地区特别是壮族地区传统中草药,民间广泛用于治疗急/慢性肠胃炎、消化不良、痢疾、腹泻、呕吐、肝炎、出血等疾病[6]。桃金娘富含鞣质类成分,鞣质是一类结构复杂的酚类化合物,具有广泛的生物活性[7]。研究表明,桃金娘总多酚具有抗氧化活性和自由基清除活性[8],还具有显著的乙酰胆碱酯酶抑制活性[9],从桃金娘鞣质中检测到没食子酸、鞣花酸、白皮杉醇和白藜芦醇4种酚类物质[10];鞣花酸能增强拉米夫定(3TC)抗乙型肝炎病毒(HBV)作用[11]。
本试验考察了桃金娘鞣质在体外PK细胞体系和小鼠体内抗PEDV的效果。体外试验结果表明,桃金娘鞣质达到一定质量浓度时,对正常PK细胞具有一定的毒性作用,半数中毒浓度TC50为7.6 mg/mL,最大无毒浓度TC0为2.3 mg/mL;桃金娘鞣质对PK细胞体系中的PEDV具有明显抑制作用,半数有效浓度EC50为0.021 mg/mL,对PEDV的治疗指数TI为361.9,高于抗病毒药物利巴韦林TI值214.28。治疗指数TI值是药物的安全性指标,可以用来衡量药物的潜在研究价值,TI值越大药物的研究价值越大,TI>2表示药物作用明显,TI>4表示药物具有开发价值。从桃金娘鞣质对PEDV的TI值分析,桃金娘鞣质可能具有很好的抗病毒药物开发价值;并推测桃金娘鞣质对PED的治疗作用优于利巴韦林。体内试验采用PEDV感染小鼠,通过检测病毒含量来考察桃金娘鞣质体内抗病毒作用,结果表明,与病毒对照组相比,桃金娘鞣质显著降低肠系膜淋巴结PEDV含量,据此推测桃金娘鞣质具有体内抑制PEDV增殖作用。桃金娘鞣质在体外、体内均具有一定抗PEDV药理活性,但具体是哪一种或几种化学成分具有抗病毒作用,抗病毒作用机制如何,以及对PED临床治疗效果如何,均有待进一步研究。
桃金娘鞣质能明显抑制PEDV引起的细胞病变,半数有效浓度为0.021 mg/mL,治疗指数为361.9;能有效降低PEDV感染小鼠体内病毒数量;桃金娘鞣质具有体外、体内抗PEDV药理活性,具有进一步开发抗病毒药物的价值。

