308 nm准分子光对小鼠湿疹模型表皮及Th细胞因子的影响
蔡海斌,徐顺明,曹艳云,徐徉
(上海市浦东新区人民医院,上海201299)
湿疹是皮肤科常见疾病,临床上多选择外用糖皮质激素制剂、口服抗组胺药物等进行治疗。近年来,308 nm准分子光已经广泛应用于银屑病、斑秃、白癜风等的治疗[1],同样用于特应性皮炎、湿疹的治疗也取得了不错的疗效[1-2],但至今为止,308 nm准分子光治疗湿疹的作用机制仍不明确。本研究通过2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)激发,建立BALB/C小鼠的湿疹模型,通过308 nm准分子光照射治疗,观察其对小鼠湿疹模型表皮厚度的变化及皮损中白细胞介素(IL)-2、IL-9、IL-10和IL-17等细胞因子表达情况,初步探讨308 nm准分子光治疗湿疹的作用机制。
1 材料与方法
1.1 实验对象 清洁级BALB/C小鼠35只,雄性,7~9周龄,体质量23~28 g,购于北京维通利华实验动物技术有限公司,由上海康明药德动物实验中心SPF级动物房饲养,室内温度(25±2)℃,相对湿度控制在50%~60%,昼夜时间控制在各12 h,自由进食与饮水。所有实验遵循国家有关实验动物的使用、福利和伦理学要求等项规定。
1.2 主要实验材料及设备
1.2.1 主要试剂 2,4-二硝基氯苯(西格玛奥德里奇有限公司,货号237329)、IL-2抗体(Servicebio公司、货号 GB11114)、IL-9抗体(Servicebio公司,货号 GB11684)、IL-10抗体(Servicebio公司,货号GB12108)、IL-17 抗体 (Servicebio 公司,货号GB11110)、抗小鼠二抗(Servicebio公司,货号G1216)和DAB显色试剂盒(Servicebio公司,货号G1212-200)、莫米松乳膏(上海通用药业股份有限公司,国药准字H20040853)。
1.2.2 主要设备 308 nm准分子光治疗仪(GSD公司GP908A),光学显微镜(奥林巴斯CH20),石蜡切片机(徕克公司/SQ2125),石蜡切片机(德国LEICA公司),组织漂烘片机(常州市雅博电子设备有限公司)等。
1.3 方法
1.3.1 小鼠湿疹模型的制备与分组 将35只BALB/C小鼠采用DNCB外涂法造模[3]。具体造模方法为:先随机选取5只小鼠建模:在所有小鼠背部皮肤剃毛(面积2 cm×3 cm),于第1天开始用DNCB连续刺激4 d,1周后重复刺激4 d,建模成功,符合湿疹皮损要求后,在建模部位皮损区皮肤切片做组织病理观察是否建模成功,确认建模成功后对另外30只小组按上述建模方法进行,按随机数字法分成308 nm准分子光治疗组(A组)和莫米松治疗组(B组)及模型组(C组),每组各10只。
1.3.2 实验方法 ①A组:模拟患者治疗流程,首先确定小鼠最小红斑量(Minimalerythemaldose,MED),根据MED值选择治疗起剂量(本实验初始照射剂量为75 mJ/cm2),再根据治疗反应逐渐增加治疗剂量,剂量调整参考设备生产商推荐治疗剂量,隔天治疗1次,连续治疗10次,记录每次光照剂量及皮损情况。②B组:皮损处外用莫米松1次/d,至A组治疗结束,共19 d。③C组:实验期间不给予任何特殊处理。
1.3.3 组织病理切片及免疫组化染色 治疗结束后,所有入组小鼠在造模区域分别取组织块制备成组织蜡块,进一步观察皮损组织病理变化,免疫组化染色根据Servicebio公司提供的鼠抗体免疫组化试剂盒的说明严格按照免疫组织化学操作流程进行。
1.3.4 表皮厚度测量 表皮厚度测量参照黑色素瘤中Breslow厚度的测量方法。测量时测量颗粒层最表浅处至表皮基底层底部最深处之间的垂直距离,测量结果用μm记录,测量时先通过切片扫描仪把HE切片进行扫描存档,然后应用Image Scoper软件自带测距功能进行测量。
1.3.5 免疫组化结果判定 对结果进行半定量分析,即从阳性细胞数百分比及细胞着色程度2项计分:①阳性细胞百分比:随机选择400倍光镜下的3个视野,计算每个视野内阳性细胞占细胞总数的百分比,取其平均值分0~4级:0级为无色,1级为<10%的细胞染色,2级为10%~20%的细胞染色,3级为>20%的细胞染色。②细胞着色程度:无着色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分;上述2项相加为着色程度积分,染色总评分表示白介素在皮肤组织中表达的强弱。结果:0,1为阴性;2为弱阳性(+);3为阳性(2+);4及>4为强阳性(3+),弱阳性及以上视为阳性表达。
1.4 数据分析与统计学方法 使用GraphPad Prism8.0软件进行数据处理,采用单因子分析的非成对t检验(等方差双尾检验)以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 组织病理变化 治疗结束时,C组小鼠皮损区仍表现为鳞状上皮增生明显,表皮可见5~6层角质形成细胞,局部呈乳头状增生,真皮浅层血管周围可见少量炎性细胞浸润,血管扩张、充血,小鼠皮损区表皮平均厚度(105.50±18.43)μm,见图 1A;而 A组,见图1B和B组,见图1C,小鼠表皮较C组小鼠皮损区明显变薄。与C组相比,A组小鼠表皮平均厚度为(67.35±11.50)μm,差异有统计学意义(F=2.566,P<0.01);B 组表皮平均厚度(29.01±6.88 μm),同样差异有统计学意义(F=7.718,P<0.01)。B组表皮厚度改善程度优于A组,2组比较差异有统计学意义(F=2.797,P<0.01),见图 2。

图1A 治疗结束时C组表皮(HE染色×200)

图1B:治疗结束时A组表皮(HE 染色×200)

图1C:治疗结束时B组表皮(HE染色×200)

图2 治疗结束时3组小鼠表皮厚度差异比较
2.2 免疫组化染色结果 IL-2、IL-9、IL-10和IL-17阳性表达主要是指小鼠表皮全层的角质形成细胞和真皮浅层浸润的淋巴细胞胞质中,呈棕黄色颗粒。
2.2.1 各组小鼠皮损区IL-2和IL-9的表达情况 IL-2阳性表达:C组4只弱阳性,1只阳性,其余5只均为阴性;A组和B组则均有9只小鼠阳性,仅1只为阴性。结果显示,A组和B组小鼠皮损区IL-2的表达水平均明显高于C组,差异有统计学意义(均F=1.455,P<0.05)。A组和B组之间小鼠皮损区IL-2表达水平差异无统计学意义(F=1.0000,P=1.000 0)。A组小鼠皮损IL-2阳性与阴性表达见图 3A、B。

图3 A组小鼠IL-2和IL-9免疫组化染色模式(×200)
IL-9阳性表达:C组10只小鼠均为阳性;而A组和B组各有8只阳性,2只阴性表达。A组和B组小鼠皮损区IL-9表达水平均低于C组(F=1.408,P<0.05 和 F=1.225,P<0.01),差异有统计学意义,而A组和B组之间小鼠皮损区IL-9表达水平差异无统计学意义(F=1.725,P=0.777 1)。A组小鼠皮损IL-9阳性与阴性表达见图3C、D。治疗结束时3组小鼠皮损区IL-2和IL-9的表达水平,见表1。

表1 治疗结束时3组小鼠皮损区IL-2和IL-9表达水平 例
2.2.2 各组小鼠皮损区IL-10和IL-17的表达情况IL-10阳性表达:C组6只小鼠为弱阳性,4只为阴性;A组和B组则均有9只小鼠阳性表达,各仅1只阴性。A组和B组小鼠皮损区IL-10的表达水平均明显高于C组,其差异均有统计学意义(F=3.542,2.667,均P<0.05),而A组和B组之间小鼠皮损区IL-10表达水平差异无统计学意义(F=1.328,P=0.808 6)。A组小鼠皮损IL-10阳性与阴性表达见图 4A、B。
IL-17阳性表达:C组9只小鼠阳性,1只阴性;A组5只阳性,B组6只小鼠阳性,其阳性程度也有差异,明显低于C组,差异有统计学意义(F=1.459,1.589,均P<0.01),而A组和B组小鼠皮损 区之间IL-17的表达水平差异无统计学意义(F=1.08,P=0.784 7)。A组小鼠皮损IL-17阳性与阴性表达见图4C、D。治疗结束时3组小鼠皮损区IL-10和IL-17表达水平,见表2。
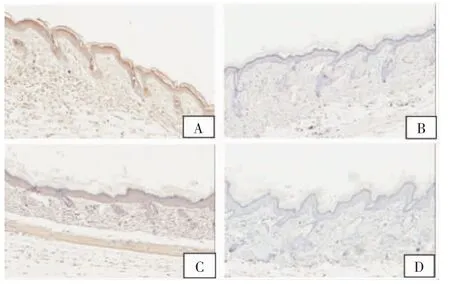
图4 A组小鼠IL-10和IL-17免疫组化染色模式(×200)

表2 治疗结束时3组小鼠IL-10和IL-17表达水平 例
3 讨论
如何提高湿疹的临床疗效、抑制复发和减少药物不良反应发生,已经成为近年来治疗湿疹皮炎的热点。308 nm准分子光是一种新型的紫外线光源,其针对湿疹的治疗有确切疗效[2],但具体的作用机制鲜有报道。湿疹的发病机制复杂,免疫紊乱与失衡是发病的主要因素。Th1/Th2、Th17/Treg细胞均参与了湿疹的发病,并且Th2和Th17细胞处于湿疹发病的主导地位[4]。308 nm准分子光在治疗湿疹的过程中对Th1/Th2、Th17/Treg细胞相关因子的影响目前尚不完全明确。
本实验通过308 nm准分子光对小鼠湿疹模型进行治疗,观察皮损区表皮的变化情况。结果表明,308 nm准分子光可以改善湿疹皮损表皮的厚度。这一结果证明了308 nm准分子光在湿疹治疗中的临床意义。临床上,湿疹尤其是慢性湿疹由于反复搔抓等因素,往往皮肤增厚、粗糙,导致瘙痒明显加重,严重影响患者的生活质量。308 nm准分子光通过改善皮损厚度,促进皮损恢复,有利于湿疹症状的缓解,因此可以作为治疗湿疹的一种有效手段。实验结果也表明,B组在相同的时间内,对小鼠湿疹模型的皮损改善程度优于A组。这可能与莫米松的外用除通过降低湿疹皮损中Th2和Th17细胞因子水平,提高Th1和Treg细胞因子水平起到治疗作用之外,尚可以通过抑制包括内被蛋白、丝聚合蛋白原/丝聚合蛋白在内的多种重要结构蛋白的表达,抑制表皮角质形成细胞增殖从而导致表皮变薄[5-6],达到治疗效果。
本实验在观察皮损区表皮变化的同时,也进一步观察了皮损中Th细胞因子的表达情况。以往研究认为湿疹的主要机制为Th1/Th2平衡失调,而有效治疗后往往表现为Th1/Th2细胞因子失衡的改善[7],在发病机制上,目前认为除了Th1和Th2细胞外,其他T细胞亚群包括Th17和Treg细胞亦参与了湿疹的发病[8-9]。Th17细胞通过分泌IL-17等起着促进炎性反应的作用,参与并诱导自身免疫反应[10]。Treg细胞有抑制炎性反应的作用,通过细胞——细胞接触抑制和分泌抑制性细胞因子如转化生长因子(TGF)-β、IL-10 而发挥维持自身免疫耐受功能[4],湿疹症状的加重往往与IL-10水平的降低有关[11]。IL-10作为Treg细胞分泌的抑制性细胞因子,不仅可以通过诱导B细胞向浆细胞的终末分化从而决定过敏反应性,还可通过负反馈机制调节Th1/Th2平衡和炎性反应[12]。本实验的免疫组化染色结果显示,A组IL-2和IL-10的表达较C组有不同程度的升高,而IL-9和IL-17表达水平较C组均有所下降。IL-2、IL-9分别作为Th1和Th2细胞主要的炎性因子之一,在308 nm准分子光治疗后,其结果较C组表达分别为上升和下降,这一变化反应了308nm准分子光的治疗对湿疹皮损Th1/Th2的作用,这与以往的研究显示有效治疗后往往表现为Th1/Th2细胞因子失衡的改善一致[7]。A组中小鼠皮损区IL-10表达水平明显高于C组,表明308 nm准分子光照射可以促进对小鼠模型湿疹IL-10的表达。此外,IL-10可抑制IL-17的产生,从而减轻皮肤的炎性反应[11]。IL-17在湿疹的病理生理学上发挥着至关重要的作用,在湿疹的急性期和复发期其明显升高,可能是湿疹的持续和加剧的因素之一[13]。Leonardi等[14]也观察到湿疹患儿血清IL-17水平明显高于健康组,而血清IL-10水平明显低于健康组这一结果。本实验C组中IL-17高表达,A组治疗后的皮损中IL-17表达水平明显下降,表明308 nm准分子光对小鼠湿疹模型皮损中IL-17的表达有明显抑制作用。本实验结果也提示,莫米松外用治疗湿疹在调节皮损区上述4种Th细胞因子的表达方面与308 nm准分子光的治疗结果相一致,二者的作用机制上有相同之处。
本实验结果显示了308 nm准分子光的治疗可减轻湿疹模型的表皮厚度,改善小鼠模型的皮肤损害;同时可下调IL-9和IL-17、上调IL-2和IL-10的表达,这两方面均有利于湿疹皮损的转归。由于湿疹的发病机制复杂,308 nm准分子光治疗后的表皮厚度改善与上述4种细胞因子表达的变化是否相关尚不清楚,有待今后进一步研究。

