二甲双胍通过mTOR 信号通路调节自噬减轻心肌梗死小鼠心肌损伤
徐志成,张久旭,张景智,孙腾飞,姜晓华,宋春霞
缺血性心脏病严重威胁着人类健康,其中冠状动脉阻塞导致的心肌梗死(myocardial infarction,MI)造成心肌细胞不可逆转坏死。 近年来,随着心血管介入技术的不断发展,大大增加了患者心梗后的存活率,而梗死后并发症导致的心功能下降却越来越普遍[1]。 如何进一步减轻心梗后心肌损伤、改善心功能成为心脏康复研究的重要领域。 既往研究表明心梗损伤机制与炎症刺激、氧化应激反应、凋亡等相关,最新研究表明心肌细胞的mTOR 信号通路介导的自噬在MI 后心室重构中发挥重要作用[2-6]。二甲双胍(metformin,Met)以往在临床上作为降糖药用于治疗2 型糖尿病(type 2 diabetes mellitus,T2DM),近年来不断有文献报道其多样性应用研究,研究发现缺血性心脏病、糖尿病伴心力衰竭的患者使用二甲双胍安全有效[7-9]。 Met 通过信号分子的调控改善心肌功能、发挥心脏保护作用的研究也越来越多[10-12]。 本实验在小鼠MI 模型中发现,Met可以通过调节Akt/mTOR 信号通路来下调自噬水平减轻MI 后心肌损伤,从而为Met 用于MI 的临床应用积累更多的实验依据。
1 材料和方法
1.1 仪器设备及材料 激光共聚焦显微镜、光学显微镜(奥林巴斯公司,日本),Western blot 电泳设备(Bio-Rad 公司,美国)。 C57BL/6 小鼠(健康,雄性,8 周龄)80 只,购于斯贝福(北京)生物技术有限公司。 Met(Sigma 公司,美国),辣根过氧化物酶标记山羊抗小鼠、辣根过氧化物酶标记山羊抗兔IgG、mTOR、磷酸化mTOR (mammalian target of rapamycin, 哺乳动物雷帕霉素靶蛋白) 、p62、LC3B 和Beclin1(Abcom 公司,美国),TUNEL 试剂盒购(Roche公司),肌酸激酶同工酶(creatine kinase, CKMB)试剂盒(R&D 公司)。
1.2 方法
1.2.1 小鼠MI 模型建立 异氟烷麻醉后,固定(仰卧位),连接心电图电极,记录心电图。 开胸暴露后,在小鼠心脏左心耳下方2 ~3 mm 处以6-0 号线结扎。 心电图II 导联ST 段抬高,结扎线下心肌缺血,模型建立成功。 假手术组仅开胸暴露。 所有小鼠随机分4 组,即假手术组(Sham 组)、单纯二甲双胍[300 mg/(kg·d)]处理组(Met 组)、MI 组和Met[300 mg/(kg·d)]干预MI 组(Met+MI 组)。 Met组和Met+MI 组小鼠手术后以灌胃方式给予Met[300 mg/(kg·d)]至术后1月,Sham 组和MI 组手术后不做任何干预,记录并计算各组小鼠死亡率,绘制生存曲线。
1.2.1 HE 染色 MI 建立1月后,迅速剪下心脏,冷PBS 缓冲液冲洗, 40 g/L 多聚甲醛固定72 h,石蜡包埋、切片及染色。
1.2.3 CKMB 检测 MI 建立后3 d,异氟烷麻醉,快速取小鼠颈动脉血至4 ml EP 管中,4℃低温静置8 h 后,3000 r/min 离心15 min,取上清即为血清。 严格按照CKMB 试剂盒说明书检测各组血清中CKMB的含量,结果以U/L 为单位表示。
1.2.4 TUNEL 染色 切取小鼠左室前壁组织,石蜡包埋、切片、脱蜡、复水,按TUNEL 试剂盒说明书检测,采集图像。 每张切片随机选取10个高倍镜视野计算细胞凋亡指数(apoptotic index, AI),凋亡细胞核为绿色,正常细胞核为蓝色。 AI =(凋亡细胞核数/总细胞核数)×100%。
1.2.5 LC3B 免疫荧光染色 切取小鼠左室前壁组织,石蜡包埋、切片、脱蜡、复水,用PBS 缓冲溶液洗5 次(3 min/次),Triton-X100(2 g/L)处理15 min,PBS 液冲洗5 次(3 min/次),山羊血清室温封闭1.5 h,PBS 液洗5 次(3 min/次),每个切片加LC3B 抗体(1 ∶100)50 μl,4 ℃孵育15 h, PBS 液洗5 次(3 min/次),暗室内每张切片加荧光二抗(1 ∶500) 50 μl,PBS 液洗5 次(3 min/次),避光条件下每张切片加DAPI 溶液50 μl,PBS 液洗5 次( 3 min/次),用荧光防淬灭液封片,采集图像。
1.2.6 Western-blot 检测 切取小鼠左心室前壁组织50 mg,加入裂解液后低温研磨裂解30 min,离心20 min(4 ℃,12000 g),取上清,定量采用BCA 比色法。 分别配置80 ml/L、100 ml/L 和120 ml/L 的分离胶进行电泳,转膜至PVDF 膜上,牛奶常温封闭2 h,切下目的条带,放入相应的mTOR(1 ∶1000)、pmTOR(1 ∶1000)、Beclin1(1 ∶1000)、p62(1 ∶1000)和GAPDH(1 ∶5000)一抗中,4 ℃孵育过夜,再用TBST 溶液洗膜5 次(3 min/次),二抗常温孵育2 h,TBST 洗膜5 次(3 min/次),以GAPDH 为内参,发光液显色,采集图像。
1.3 统计学处理 GraphPad Prism 5.0 进行统计学分析并作图,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析(One-way ANOVA),P<0.05 为差异有统计学意义。
2 结 果
2.1 对小鼠生存分析曲线的影响 各组小鼠4 周后的生存率Kaplane-Meier 分析表明MI+Met 组比MI 组的死亡率明显降低(P<0.05),主要死亡原因与心梗后心力衰竭有关,见图1。
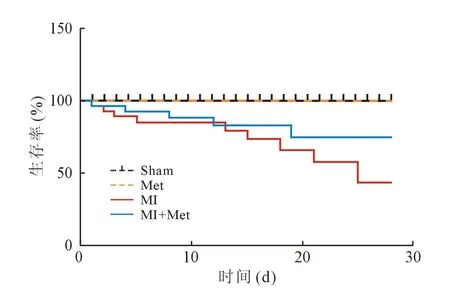
图1 各组小鼠生存分析曲线
2.1 血清CKMB 含量的变化 Sham 组与Met 组血清CKMB 水平比较没有明显差异(P>0.05);与Sham 组相比,MI 组血清CKMB 水平明显升高(P<0.05);Met+MI 组血清中CKMB 水平比MI 组显著降低(P<0.05)。 见图2。
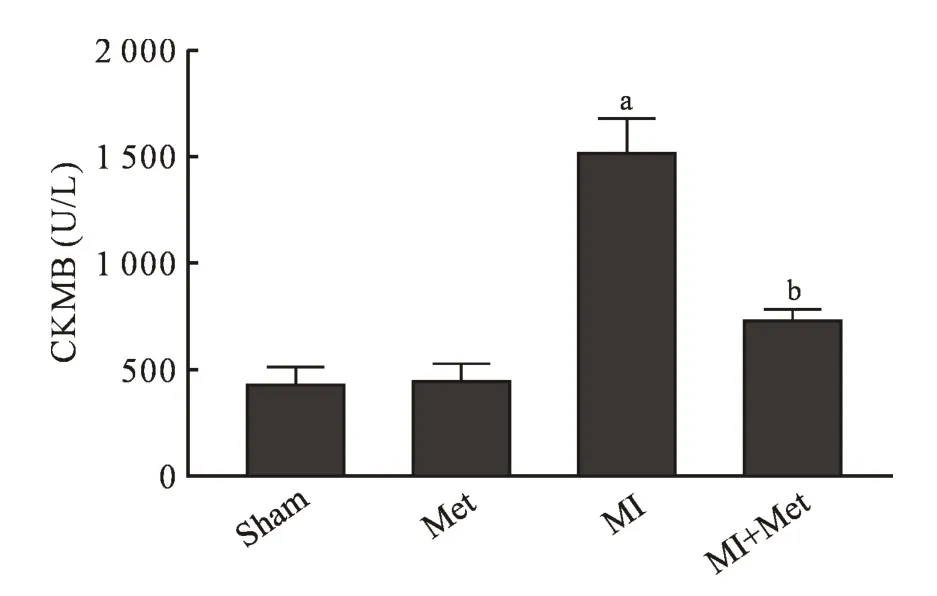
图2 血清中CKMB 的含量
2.3 心肌组织TUNEL 染色 Sham 组与Met+Sham 组TUNEL 阳性细胞核染色较少且无差异(P>0.05);,MI 组比Sham 组TUNEL 阳性细胞核染色数量明显增多(P<0.05);与MI 组相比,Met+MI 组可明显减少TUNEL 阳性细胞核染色数量(P<0.05)。 见图3。
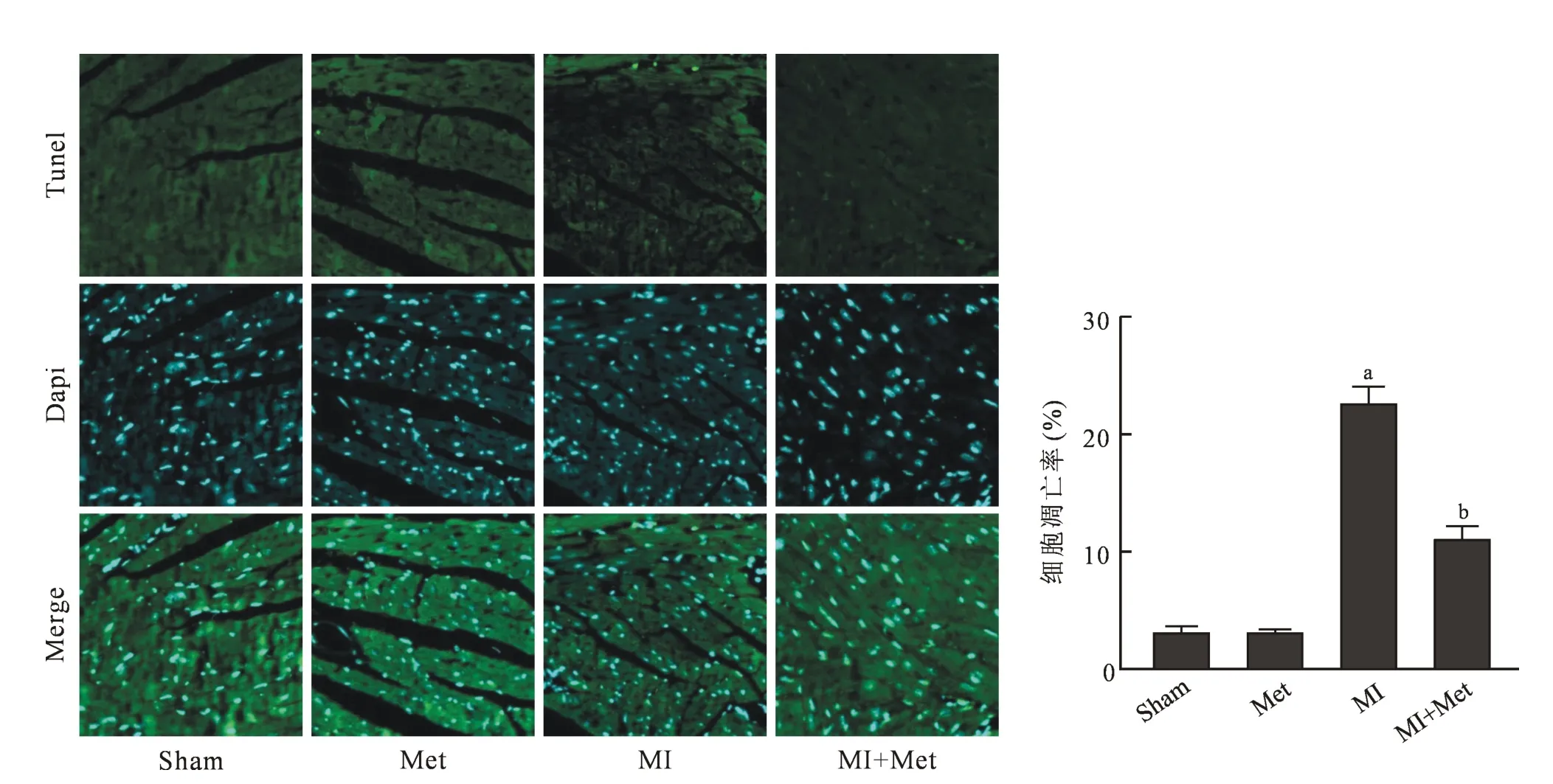
图3 各组小鼠心肌组织TUNEL 染色和凋亡率
2.4 各组小鼠心肌自噬相关蛋白表达的变化Sham 组与Met 组自噬相关蛋白的含量无差异(P>0.05);MI 组比Sham 组p-mTOR 表达明显降低(P<0.05),Beclin1、p62 含量显著增高(P<0.05);MI+Met 组比MI 组的p-mTOR 的含量显著升高(P<0.05),Beclin1、p62 含量显著显著降低(P<0.05)。见图4。
2.5 心肌LC3B 表达的免疫荧光染色 与Sham 组相比,Met 组LC3B 蛋白免疫荧光染色无统计学差异;与Sham 组相比,MI 组LC3B 蛋白免疫荧光染色数量明显增多(P<0.05);与MI 组相比, MI+Met 组LC3B 蛋白染色的数量显著减少(P<0.05),见图5。
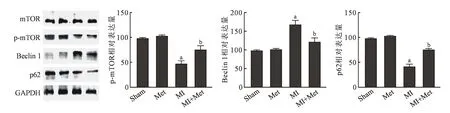
图4 各组自噬相关蛋白表达的变化

图4 小鼠心肌组织LC3B 免疫荧光染色
3 讨 论
急性MI 是常见的心血管急危重症,起病较为隐袭,且具有高死亡率,目前多数入院患者行经皮冠状动脉支架植入术(percutaneous coronary stent implantatio,PCI)后,症状能够明显缓解,术后心功能明显改善。 然而,MI 后的心肌损伤造成心功能下降,限制PCI 术后的效果[13]。 本研究建立小鼠MI 模型,探究MI 损伤相关指标和自噬相关指标变化,结果提示,MI 组心肌损伤加重、mTOR 的磷酸化表达被明显抑制,并伴有自噬增强。 给予Met 处理后,心肌损伤明显减轻、mTOR 的磷酸化表达增强,且伴有自噬降低。 上述结果提示,MI 损伤中,由mTOR 信号通路介导的自噬发挥重要作用。 本实验中,Met通过激活mTOR 信号通路、降低自噬,从而减轻MI造成的心肌损伤。
正常生理状态下,自噬的作用是清除受损细胞器、错误折叠的蛋白质、维持细胞稳态,广泛存在于细胞内[14]。 mTOR 作为PI3K 相关激酶家族成员及PI3K/Akt 信号通路下游分子,参与多种生物学过程,是自噬的调控中的关键分子,且与自噬过程呈负相关,mTOR 根据与其结合的蛋白质复合体的不同主要分为mTORC1 与mTORC2, 前者主要调节细胞能量代谢及蛋白合成。 本实验结果提示,在小鼠MI模型中,p-mTOR 表达降低,自噬相关蛋白Beclin1和LC3B 表达增加,p62 表达降低;而mTOR 被激活即p-mTOR 表达增高时,自噬相关蛋白Beclin1 和LC3B 表达减少,p62 表达增加,提示mTOR 信号通路介导自噬与小鼠MI 模型心肌损伤密切相关。
Met 是治疗T2DM 的重要降糖药物,以往专家共识中明确指出:可以将Met 列入T2DM 患者的第一步治疗中,即在单纯饮食控制和体育锻炼的同时接受Met 治疗[1]。 近年来,关于Met 的研究不断拓展到其他领域,研究发现能够抑制T2DM 患者消化系统及泌尿系统肿瘤的进程并改善预后,同时对于肿瘤治疗,还可以增强化疗疗效,但其具体作用机制尚未完全阐明。 Met 可以有效降低糖尿病相关心脏疾病风险,其心血管保护机制降糖、代谢改变以及细胞功能改善等相关[15-18]。 本实验发现Met 在减轻心血管损伤中发挥保护作用,其机制可能与自噬过程密切相关。 Met 可明显改善MI 后心肌纤维化程度及心肌细胞凋亡,减少血清中梗死标志物CKMB的含量,结果证实了Met 减轻MI 损伤的作用;同时,笔者还发现,Met 组自噬相关蛋白的表达与Sham 组均无明显变化;与Sham 组相比,MI 组p-mTOR 表达明显降低,LC3B 和Beclin1 的表达显著升高,p62表达降低;MI+Met 组p-mTOR 的表达比MI 组明显增高,自噬相关蛋白LC3B、Beclin1 的表达显著降低,p62 表达升高,表明Met 可以激活mTOR 信号降低自噬改善MI 损伤。 初步认为MI 心肌缺血抑制mTOR 信号通路的激活;Met 通过激活mTOR 信号通路下调自噬水平减轻MI 损伤。
根据以上实验研究结果,本研究已经证实Met通过激活mTOR 信号通路下调自噬减轻MI 损伤,为Met 在MI 中发挥保护作用提供了新的实验依据。然而,Met 激活mTOR 信号通路向下调MI 自噬具体机制仍有待进一步研究证实。

