表达禽流感H5N1 血凝素抗原(HA)和H9N2 血凝素抗原(HA)融合基因重组腺病毒二价苗的构建
王增利, 张 哲, 李鹏坤, 霍惠玲, 李 娥, 甄 理, 董维亚, 化金津, 冯亚文, 仇国明
(1.河北省动物疫病预防控制中心 050035;2.河北省动物卫生监督所 050000;3.天津保信立德生物科技有限公司300000;4.河北省兽药监察所 050035;5.天津豪威生物科技有限公司 300000;6.河北省农业招商中心 050000)
禽流感(avian influenza, AI)是由A 型流感病毒引起的一种禽类的急性、烈性、接触性呼吸道传染病[1]。 禽流感不仅可以感染禽类,也可以跨宿主感染人类及其他的哺乳动物,因此对禽流感的防控具有公共卫生学意义[4-5]。
禽流感根据AIV 血凝素(hemagglutinin, HA)和神经氨酸酶(neuraminidase, NA) 的不同可分为16 个HA 亚型,9 个NA 亚型[2,6],目前H5 和H9 亚型是我国养禽场主要禽流感,对养禽业的威胁严重。
疫苗接种是防控禽流感的主要方法。 目前我国使用的是鸡胚培养制作的油乳剂灭活疫苗, 在防控禽流感的实践中发挥了重要作用[7-8]。 但该类疫苗也存在着鸡胚质量控制难度大、工艺复杂、产生废物较多、总体生产成本高等缺点,人们开始积极探索新型禽流感疫苗,在类颗粒病毒(VLP)和病毒载体疫苗禽流感疫苗的研发方面取得了一定的进展[4,8]。 国外多位学者用腺病毒载体携带H5N1 完整HA 基因的重组腺病毒免疫小鼠和SPF 鸡都获得良好的保护[9-11];国内学者成功地构建了共表达H5N1 亚型禽流感病毒膜蛋白基因M 和HA 的重组腺病毒[12]和共表达H5N1 禽流感病毒HA 和NA 基因重组腺病毒载体[5],都为新型禽流感疫苗的研发提供了更多的技术路线和方案。 国内外研究的结果显示,以禽流感血凝素抗原HA 为主要保护性抗原基因构建重组的腺病毒禽流感疫苗具有良好的免疫效果和应用前景。
为经济有效防控养禽场流行的H5N1 和H9N2 两个禽流感病毒亚型,本试验设计并构建了含有H5N1HA 和H9N2HA 融合基因表达的重组腺病毒,并经过鉴定H5N1HA 和H9N2HA 在同一个重组腺病毒中得到了良好表达,用重组腺病毒Ad-H5H9HA免疫SPF 鸡,诱导了特异性免疫反应,H5N1HA 抗体和H9N2HA抗体都达到了国家免疫标准, 提示该重组腺病毒Ad-H5H9HA可以作为同时预防H5N1 和H9N2 的二价苗使用,为日后禽流感的防控提供候选疫苗。
1 材料
1.1 细胞及菌株
人胚胎肾细胞(HEK293T,美国ATCC 公司);大肠杆菌感受态细胞DH5α 购自北京所莱宝生物公司;TOP10 感受态细胞购自天根生化科技(北京)有限公司。
1.2 工具酶及主要试剂
AdMax 腺病毒载体系统的穿梭质粒pDC315 和腺病毒系统的基因组质粒购自Microbix Biosystems 公司; 质粒中提试剂盒QIAGEN midiprep Kit 和胶纯化试剂盒, 质粒小提试剂盒miniprep kit 均购自QIAGEN 公司; 限制性内切酶、T4DNA 连接酶等购自NewBiolab;Lipofectamine 2000 脂质体转染试剂购自Invitrogen; 含有绿色荧光蛋白GFP 基因的重组腺病毒rAd-GFP由天津保信立德生物科技公司提供; 实验所用仪器设备及分析纯试剂由河北省动物疾病预防控制中心提供。 引物合成和基因测序工作委托上海生工(用不用全称)完成。
1.3 实验动物
实验动物为21 日龄的SPF 鸡,由保定瑞普提供;动物免疫和抗体检测在保定瑞普完成。
2 方法
2.1 H5N1HA 和H9N2HA 融合基因质粒的克隆
根据流行病学调查(数据待发表)并结合国家权威机构的研究结果,确定了H5N1 和H9N2 的优势毒株及基因序列,据此合成了H5N1 和H9N2 的保护性抗原基HA 的融合基因H5N1HAH9N2HA(简写为H5H9HA),然后将融合基因H5H9HA克隆到pUC57 载体中。 克隆策略的设计是将H5N1HA 的基因中的终止密码子及后续序列去除后,紧接H9N2HA 的起始密码子,直至H9N2HA 的终止密码子,使H5N1HA 和H9N2HA 基因成为一个融合基因(H5H9HA),并且对H9N2HA 的个别位点做了点突变; 在H5N1HA 启动子之前加上kozak 序列GCCACC 并在该序列之前增加了EcoRI 酶切位点; 在H9N2HA 终止子后边增加了NheI 和HindIII 两个酶切位点。用GeneArt 无缝克隆和组装试剂盒将融合基因克隆到载体pUC57 中, 形成带有目的融合基因H5H9HA 的质粒pUC57-H5H9HA。
2.2 带有目的融合基因的腺病毒穿梭质粒pDC315-H5H9HA 的构建
首先用EcoRI 酶切载体质粒pDC315 和带有目的基因的质粒pUC57-H5H9HA, 分别得到大小3.9kb 和6.1kb 的线性化质粒。 用乙醇沉淀经EcoRI 酶切处理的pDC315 和pUC57-H5H9HA 片段, 去除酶切反应的Buffer 后, 再用第二个酶NheI做酶切。 将经过双酶切后的载体片段pDC315(EcoRI/NheI)和从pUC57-H5H9HA 中得到的H5H9HA 融合基因(EcoRI/NheI)片段(3415bp)胶回收,回收后分别取1μL,用1%的琼脂糖胶作一个量化分析(见图2),以确定连接反应的反应体系。 而后进行连接反应。 将连接产物转化入DH5ɑ 后,从过夜培养的平板上挑取单克隆,小提质粒,用NheI/XmaI 一次双酶切鉴定出阳性克隆,经过测序进一步确认目的基因H5H9HA 融合基因是否成功克隆入腺病毒穿梭载体pDC315 中,即是否成功的构建了腺病毒穿梭质粒pDC315-H5H9HA。
2.3 重组腺病毒载体的包装和扩繁
运用AdMax 腺病毒包装体系,将1.2 项中制备的腺病毒穿梭质粒pDC315-H5H9HA 与辅助包装质粒pBHGlox(delta)E1,3Cre 通 过LipofectamineTM 2000 共 转 染 至HEK293T 细 胞中:用于转染的细胞密度为50%~60%,转染前2h 将细胞培养基更换为无血清OMEM 培养基, 向一无菌离心管中加入所制备的DNA 溶液(穿梭质粒5μg 和辅助质粒5μg)与OMEM 混合均匀,调整总体积为50μL,在室温下温育5min,取10uL Lipofectamine 2000 试剂在另一管中与50μL OMEM 混合, 在室温下温育5min并将其与DNA 稀释液进行混合,混合后,在室温下温育20min,以便形成DNA 与Lipo- fectamine 2000 稀释液的转染复合物。将DNA 与Lipofectamine 2000 混合液转移至HEK293 细胞的培养液中,混匀,于37℃、5% CO2细胞培养箱中培养。 培养6~8h 后倒去含有转染混和物的培养基, 每瓶细胞加入2mL 的PBS 液,轻轻左右晃动一下培养瓶以洗涤残余的转染混和物, 然后倒去并补入含1%血清的培养基继续培养。 利用Cre/loxP 重组酶系统的作用实现重组, 产生重组腺病毒的细胞中会出现典型的细胞病变效应,待大部分细胞出现典型的细胞病变,且有50%细胞脱壁时收集毒液。离心收集细胞,细胞沉淀用PBS 重悬,冻融4 次,上清即为Ad-H5H9HA 病毒原液。 按1∶10 的比例感染新的293 细胞,如此反复制备出四代重组腺病毒。
2.4 重组腺病毒Ad-H5H9HA 的PCR 鉴定及扩增纯化
对2.3 收集到的病毒液进行PCR 鉴定。 将100μg/mL 的蛋白酶K 加入到病毒液中,煮沸5min,以此为模板。 以融合基因H5H9HA 的上游引物5’-gaattcctggatccgccaccatgga-3’,下游引物5’-ttatatacaaatgttgcatctgca-3’; 以H5HA 的上游引物5’-gaattcctggatccgccaccatgga-3’,下游引物5’-aatgcaaattctgcattgtaacg-3’做PCR 扩增,扩增产物用1%琼脂糖凝胶电泳检测。 挑取PCR 鉴定正确的病毒株进行扩增纯化进行后续实验。 在HEK293T 细胞中进行腺病毒扩增并按Adeno-XTMVirus Purification Kit 的步骤纯化重组腺病毒。
2.5 以编码H5N1H9N2 HA 融合基因的重组腺病毒疫苗免疫动物的抗体表达
将健康状况良好的21 日龄SPF 鸡,按照每组10 只分成四组。将重组rAd-H5H9HA 病毒和禽流感二价灭活苗(H5N1Re-6+H9N2Re-2)、rAd-GFP 分组免疫, 以293 细胞裂解物免疫作为空白对照。 免疫当天采血检测抗体,分别在免疫后第7、14、21、28d采血和收集血清,采用常规的血凝抑制方法检测抗体效价。
3 结果
3.1 H5N1HA 和 H9N2HA 融 合 基 因 质 粒 pUC57 -H5H9HA 的鉴定
用EcoRI/NheI 酶切鉴定得到的pUC57-H5H9HA 质粒,可以看到大小为3415bp 的融合基因片段和大小为2644bp 的载体片段(见图1),表明融合基因H5H9HA 成功的克隆到pUC57 载体中。
3.2 腺病毒穿梭质粒pDC315-H5H9HA 的构建
小提连接产物转化的单菌落, 用NheI/XmaI 一次双酶切再次鉴定确认, 出现5949bp 和1367bp 两个片段的克隆为阳性克隆,在挑选的菌落中得到了阳性克隆(见图3),对酶切鉴定阳性的克隆进一步基因测序验证, 证实了成功地构建了腺病毒穿梭质粒pDC315-H5H9HA。
3.3 重组腺病毒Ad-H5H9HA 的产生和PCR 鉴定
腺病毒穿梭质粒pDC315-H5H9HA 与辅助包装质粒pBHGlox(delta)E1,3Cre,利用Cre/loxP 重组酶系统的作用在293 细胞中实现重组。 产生重组腺病毒的293 细胞在质粒转染后继续培养5~7d 出现典型的细胞病变效应(CPE)(见图4)。通过对收获的重组病毒样品的PCR 鉴定,用H5N1HA 基因上游与H9N2HA 基因下游引物扩增出3404bp PCR 条带的为阳性重组腺病毒,用H5N1HA 基因上游与下游引物扩增出了1721bp 的片段 (见图5)。 证实在重组腺病毒Ad-H5H9HA 中, 既有H5N1HA 基因序列,同时也有融合基因H5H9HA 的序列。而进一步的基因测序结果也证明了重组腺病毒Ad-H5H9HA 中的融合基因序列与设计的H5N1HA 和H9N2HA 的融合基因H5H9HA 的基因序列完全吻合。
3.4 重组腺病毒疫苗免疫动物的抗体表达
结果表明, 携带H5N1H9N2 HA 基因的腺病毒和禽流感灭活疫苗免疫组鸡都产生特异性抗体。 用H5 亚型抗原检测HI 抗体,rAd-H5H9HA、 禽流感二价灭活苗(H5N1Re-6+H9N2Re-2)H5 亚型抗体产生,在第21d 重组病毒免疫组鸡抗体水平达到峰值,抗体水平均超过免疫标准(6.0)。 rAd-H5H9HA 和禽流感二价灭活苗(H5N1Re-6+H9N2Re-2)产生的抗体水平基本相当(见表1)。 同样,用H9N2 亚型抗原检测免疫效果,得出的结果是,rAd-H5H9HA 免疫组在21 d 就产生了高水平特异抗体, 与阳性对照组禽流感二价灭活苗(H5N1Re-6+H9N2Re-2) 免疫产生的抗体(在相同时间点)水平相当(见表2),与此对应的是携带GFP 的腺病毒rAd-GFP 和293 胞空白对照组不产生特异性抗体。
图1 pUC57H5H9HA 酶切鉴定
图2 pDC315(EcoRI/NheI)和H5H9HA(EcoRI/NheI)连接之前的体系
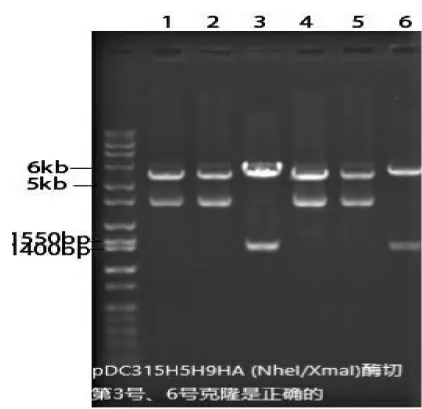
图3 腺病毒穿梭质粒pDC315-H5H9HA 的双酶切鉴定
图4 产生重组腺病毒的293 细胞出现典型空斑

图5 重组腺病毒rAdH5H9HA 的PCR 鉴定
表1 重组腺病毒免疫动物后的H5 亚型抗体检测结果

表2 重组腺病毒免疫动物后的H9 亚型抗体检测结果
4 讨论
据近些年禽流感的流行病学调查,结果显示H5N1 和H9N2两个禽流感亚型仍然是对我国养鸡业造成危害最严重的。 从经济角度及我国的国情出发,疫苗免疫是禽流感防控的首要措施,目前我国对H5 亚型高致病性禽流感仍采取强制免疫政策,对包括H9 在内的其他亚型禽流感提倡疫苗免疫。 现用的H5 强制免疫疫苗是哈兽研利用反向遗传操作技术研制的AI 疫苗,目前已经有H5 亚型Re-4 株、Re-5 株、Re-6 株、Re-7 株 和Re-8 株疫苗种毒,研制出H5 亚型单苗、二价苗和三价苗共10 多个产品的灭活疫苗,广泛用于我国多种家禽的H5 亚型A1 免疫预防。 此外,由中国农业科学院哈尔滨兽医研究所研发,可同时预防H5和H9 亚型AIV 的禽流感(H5+H9)二价灭活疫苗(HSNI Re-1+H9N2 Re- 2 株)于2007 年获得新兽药证书并开始应用;随着细胞培养技术的发展和成熟,用细胞培养AIV 来生产A1 灭活疫苗越来越受到关注和认可,一系列疫苗产品相继问世[3]。 在我国控制禽流感疫情中起到了重要的作用。 但由于该类疫苗用鸡胚培养来生产病毒抗原工艺上的局限, 鸡胚质量控制和标准化生产难度较大,生产工程产生的废弃物数量巨大,占用生产空间较大导致总体生产成本较高。 相对于此,以细胞大规模培养为生产工艺的类颗粒疫苗、 病毒载体疫苗等基因工程产品显示了良好的发展潜力[9-11]。
HA 作为流感病毒表面的主要糖蛋白之一, 在疫苗免疫压力下,基因突变和基因重组,是病毒发生抗原变异的主要原因[6]。尤为重要的是,HA 蛋白是具有免疫原性的结构蛋白, 不仅可以诱导产生特异性的中和抗体, 而且还可以刺激机体产生细胞毒性淋巴细胞反应, 因此,HA 一直被作为基因工程疫苗研究的首选靶基因[9]。 研究表明,基于禽流感HA 基因所研制的腺病毒载体疫苗、类颗粒病毒疫苗(VLP)对同一亚型病毒的攻击都产生了接近100%的保护,但对其他亚型病毒的攻击保护率较低。 这也是目前我国商品化的禽流感疫苗多数采用多价二价苗、 联苗的原因。 因此理想的禽流感疫苗在设计时就应充分考虑对不同亚型的保护性如何。
H5 亚型和H9 亚型禽流感在我国养禽场长期存在,并且呈现混合致病的趋势,是威胁养禽业的主要传染病。 通过临床的流行病学调查,结合国家权威机构数据,获得H5 和H9 亚型的优势流行毒株HA 序列。 利用H5 和H9 亚型优势流行毒株HA 基因保护性抗原基因来构建腺病毒载体H5、H9 二价苗, 将H9N2的HA 和H5N1 的HA 基因头尾相连融合在一起(为利于基因表达对个别位点做点突变),形成一个完整的融合基因,然后通过腺病毒穿梭质粒和腺病毒辅助包装质粒的重组, 在293 细胞中成功的重组了腺病毒禽流感H5H9 二价苗即rAdH5H9HA。 重组腺病毒rAdH5H9HA 经过特异引物PCR 鉴定和免疫SPF 鸡的特异性抗体检测, 充分证实了rAdH5H9HA 得以成功构建重组,目的保护性抗原基因在重组病毒中也得以忠实表达; 动物试验证实rAdH5H9HA 免疫动物后, 同时诱导了特异性H5 亚型HI 抗体和H9 亚型HI 抗体, 并且抗体的水平在同一时间点与对照的油乳剂灭活二价苗产生的抗体一致。 综合试验结果显示,重组腺病毒rAdH5H9HA 作为同时预防H5N1 和H9N2 亚型的禽流感的二价苗具有一定的数据基础, 是一类具有研究潜力的禽流感疫苗。 当然重组病毒的滴度以及安全性评价等方面还需做大量工作,这有待今后的研究中予以充实完善。 由于腺病毒载体本身具有较强的免疫原性,是抗原基因的产品的良好载体,而且腺病毒载体包装量大, 一个载体同时携带多个基因实现多基因的共表达,这对于多种亚型同时流行的禽流感疫苗的研究很有意义。

