脾脏硬化性血管瘤样结节性转化的CT诊断与鉴别
赵芳,马周鹏
(1.厦门大学附属第一医院 放射科,福建 厦门 361003;2.上海市金山区中西医结合医院/上海中医药大学附属龙华医院金山分院 放射科,上海 201501)
脾脏硬化性血管瘤样结节性转化(sclerosing angiomatoid nodular transformation of the spleen,SANT)是一种罕见的脾脏良性非肿瘤性病变,由Martel等于2004年正式命名[1]。由于发病率低,对其CT表现缺乏认识,既往术前往往误诊为血管瘤、错构瘤、炎性假瘤等其他病变[2]。笔者收集7例经手术病理学证实为SANT的患者CT资料进行回顾性分析,并复习有关文献,以提高对该病的认识,现报道如下。
1 资料和方法
1.1 一般资料
回顾性分析2011年3月至2019年10月厦门大学附属第一医院(3例)、上海中医药大学附属龙华医院金山分院(4例)诊治的7例SANT临床资料。7例中女5例,男2例,年龄43~68岁,中位年龄51岁。临床表现:6例表现为程度不等的左上腹隐痛不适,病程10 d至6个月;1例体检超声发现脾脏病变。体格检查:4例左上腹轻压痛。实验室检查及肿瘤学指标包括CEA、AFP、CA199、CA125检查均在正常范围。
1.2 CT检查与图像分析
采用GE Light speed 64排CT(4例)及Siemens Definition 64层CT(3例)行常规全腹部平扫、动脉期、门静脉期及延迟期扫描。对比剂均采用非离子型对比剂碘海醇(350 mg I/mL),剂量1 mL/kg(体重),流率均为3.0 mL/s。动脉期延迟25~30 s,门静脉期延迟55~60 s,延迟期延迟180 s。
由2名高年资CT医师共同对图像进行回顾性分析。观察内容:(1)病灶的部位、数目、形态、大小;(2)CT平扫的特点,密度与相邻正常脾脏组织比较分别为低、等、高密度;增强程度接近或低于腹壁肌肉为轻度强化,高于腹壁肌肉但低于正常脾组织为中度强化,接近正常脾组织为明显强化;(3)继发改变,邻近脾脏结构和其他组织器官的变化,有无腹水、腹腔及腹膜后淋巴结肿大等。
2 结果
2.1 CT表现
2.1.1 病灶的部位、数目、形态、大小:7例均为单发病灶,位于脾脏前端3个,后端4个;5个位于脏面(其中2个位于接近脾门区域),2个位于膈面。6个病灶呈较规则的类圆形,1个呈不规则形,直径约3.8~8.9 cm,平均6.9 cm(图1~3)。
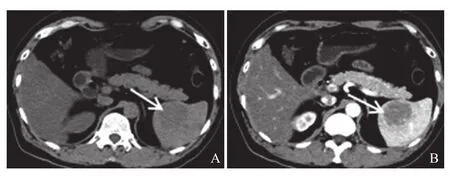
图1 病例1:脾脏脏面SANT

图2 病例2:脾脏膈面SANT
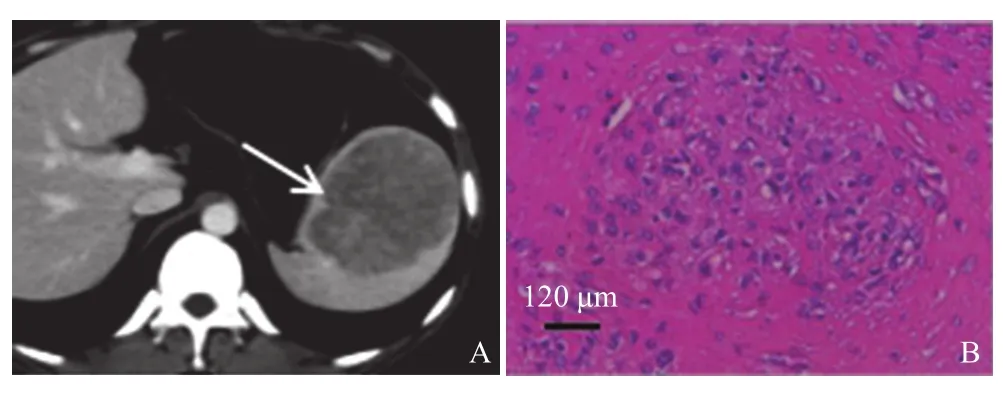
图3 病例3:脾脏上缘SANT
2.1.2 CT平扫及增强:CT平扫2例呈较均匀的低密度,边界较清晰(图1A、2A);其余5例密度欠均匀,以稍低密度为主,内部及边缘见条片等密度影,边界欠清晰,均未见明显钙化。增强动脉期7例均表现为病灶边缘及内部早期强化,其中2例周边明显环状强化,内部点状明显强化图2B,3例周边及内部斑点、条状明显强化,2例病灶边缘斑点状中度强化,内部未见强化。门静脉期及延迟期7例均持续向心样强化,其中5例强化明显,接近正常脾脏,2例中度强化,低于脾脏但高于腹壁肌肉。7例强化均不均匀,5例见较明显的“轮辐征”,即外周明显环状强化,内部放射状明显强化,内部夹杂轻微或无强化的条索样区域,以门静脉期较明显(图2、图3A)。增强后病灶边界较清晰,2例病灶与正常脾脏实质之间可见早期无强化的纤细环形低密度影,类似“假包膜”。
2.1.3 继发改变:7例病灶中1例最小者(直径约3.8 cm)脾脏外形未见改变,其余6例病灶所在区域脾脏增大,形态饱满,其中2例肿块巨大者局限突出脾脏轮廓,但主体位于脾脏内(图2)。7例均未见腹腔积液,周边组织结构未见侵犯及转移,腹腔及腹膜后未见肿大淋巴结。
2.2 病理学检查
7例均经病理学确诊为SANT。大体标本见肿块实性,切面灰白相间,质中等,内部未见明显囊变坏死。病灶边界均清楚,无明显包膜,结节内见不规则灰白色星芒状瘢痕组织。镜检显示病变区正常脾脏结构破坏,脾脏纤维硬化性间质边缘及内部见多个血管瘤样结节,部分融合,周围为增生纤维组织包绕,结节内或周围见含铁血黄素沉积(图3B)。免疫组化显示,7例CD31、CD34、CD8、vimentin和SMA均(+),CD21和desmin均(-)。
3 讨论
3.1 SANT的临床和病理学特征
SANT是一种罕见的脾脏良性脉管源性病变,过去曾被称为“索状毛细血管瘤或多结节性血管瘤”,直至2004年Martel等总结其组织形态学特征和免疫组化表型,提出了“硬化性血管瘤样结节性转化”命名并被广泛接受和使用[1]。该病目前缺乏大样本研究报道,朱朋成等分析l79例脾脏良性占位性病变中仅3例诊断为SANT,占比为1.68%[4]。SANT的发病机制尚不明确,有研究认为是错构瘤的一种特殊变异型,也有学者认为是脾内血肿的特殊转归[5]。
SANT可见于任何年龄,但以30~60岁居多,女性略多于男性[2,4]。临床症状多为左上腹部疼痛不适,查体可发现脾肿大,伴有轻度压痛,但一般无脾功能亢进,少数为体检发现,个别可为副脾发病[6]。病理学特征为纤维硬化间质中形成多个血管瘤样结节,大小不一,以周边分布为主,内部呈“辐射状”排列。纤维硬化间质以中心分布为主,形态类似星芒状,所占比例常较大[3,7]。镜下病变区由多结节性血管瘤样结构或肉芽肿样结构组成,细胞无明显异型性,血管瘤样结节中央可见裂隙样或窦样血管腔,内皮细胞通常肥胖或肿胀,血管腔隙周围为同心圆状增生的纤维结缔组织,其间伴有不等量的淋巴细胞、浆细胞浸润,部分间质可见玻璃样变、黏液样变以及含铁血黄素沉积[3-4]。免疫组化显示血管瘤样结节内由表达CD34阳性的小血管、表达CD8阳性的窦性腔隙及表达CD31阳性的内皮细胞组成[7]。
3.2 SANT的CT表现
SANT的病理学特征决定了其影像学表现。由于病理学特点为脾脏纤维硬化间质中形成多个血管瘤样结节,CT平扫SANT往往呈较规则的圆形或类圆形等或稍低密度病灶,接近正常脾组织而边界欠清晰[2]。病灶体积一般较大,王建军等[7]报道8例SANT中直径1.5~11.0 cm,平均直径6.2 cm。相应脾脏形态饱满,部分肿瘤可累及脾脏边缘甚至突出脾脏轮廓。本组7例即是如此,仅1例呈不规则形,其余6例均呈较规则的类圆形;CT平扫为低或稍低密度,最大直径平均6.9 cm。1例最小者(直径约3.8 cm)脾脏外形未见改变,其余6例见病灶区域脾脏局限增大。2例巨大肿块局限突出脾脏轮廓,但主体位于脾脏内。
多数研究认为SANT钙化少见[2,4-5],而马建兵等[8]研究中,6例中3例出现钙化,表现为病灶内大片“陨石坑”样或零星斑点状钙化,认为可能与病灶大小及其中纤维组织的多少有关,病灶越大、纤维组织量越多,出现钙化的概率越高。但本组7例均未见明显钙化,可能为病例较少的原因。
由于血管瘤样结节大小不一,以周边分布为主,且有“辐射状”排列的特点,典型CT增强表现为早期强化及持续向心性强化[2]。病灶内部的纤维硬化间质类似星芒状,所占比例较大,增强一般轻微延迟强化,与病灶周边及内部放射状排列明显强化的血管瘤样结节对比明显而呈现“轮辐征”[2,8]。有研究证实病灶中央的星芒状瘢痕动脉期及门静脉期无强化,但在延迟5 min之后会出现轻中度强化[5]。本组7例动脉期均表现为病灶边缘及内部早期强化,门静脉期及延迟期持续向心样强化,其中5例见较明显的“轮辐征”,病灶内均未见明显坏死囊变,增强后边界变清晰,与既往研究相符。SANT作为一种良性病变,即使突出脾脏外,也仅对周边结构推移压迫而并非侵犯破坏。本组7个病灶中2个突出脾脏轮廓,仅表现为周边结构的压迫而未见周边组织器官的侵犯,腹盆腔未见积液,也未见组织器官和淋巴结的转移。
3.3 SANT的鉴别诊断
3.3.1 血管瘤:CT平扫为等或低密度,较小病灶动脉期可完全均匀明显强化,较大病灶增强后周边结节状强化,随时间推移对比剂逐渐向中央充填,延迟期与脾脏呈等密度。由于病灶内无星芒状的纤维硬化间质,增强无“轮辐征”及“星芒征”。
3.3.2 错构瘤:CT平扫为体积较大的等或稍低密度实性肿块,少数可见脂肪成分;增强动脉期弥漫不均匀轻度强化或边缘斑片状强化,延迟呈渐进性强化,不同强化的区域交织呈破絮状改变;延迟期密度接近或稍高于脾实质时有助于诊断[9]。
3.3.3 转移瘤:多有明确的原发恶性肿瘤史;脾脏呈单或多发病灶,CT平扫呈等或较低密度,边界不清,常伴中心坏死,增强强化方式类似于原发肿瘤,有时可见其他组织、器官的转移灶及腹腔、腹膜后淋巴结转移。
3.3.4 窦岸细胞血管瘤:多有不同程度的脾脏增大,CT平扫呈单或多发的等、低密度病灶,边界不清,增强后低密度结节明显增多,即病灶结节增多征,呈渐进性充填强化类似血管瘤,但延迟期显示不清[10]。
综上所述,SANT的CT表现具有一定特征,往往表现为脾脏单发较大的圆形或类圆形肿块,平扫呈低或等密度及较低密度,边界欠清,动态增强持续向心性强化,并常表现为特征性“轮辐征”,边界较平扫变清晰;病灶一般局限于脾脏轮廓,少数突出脾脏轮廓,但不会出现周边组织器官的侵犯,也无淋巴结和其他组织器官的转移。CT对SANT的诊断和鉴别具有较大价值。