肝细胞生长因子对成骨细胞增殖、凋亡及成骨分化的影响
李若涵,佘文婷,华 超,骆 瑜,黄 丽,彭友俭
外伤、肿瘤、炎症等可能会导致大面积的骨组织缺损,为临床修复带来巨大挑战,缺损的组织修复成为了亟待解决的难题[1]。目前临床常用的传统骨修复方法效果通常不甚理想,常规治疗后仍有5%~10%的患者骨缺损不能正常愈合[2]。近年来,干细胞移植和生长因子改性的骨修复材料的出现在极大程度上解决了骨组织再生效果不良的问题。但骨修复材料的研究与应用目前尚处于起步阶段,仍需要开展大量相关的基础研究,为生物材料的研发奠定基础。
肝细胞生长因子(hepatocyte growth factor, HGF)作为能刺激肝细胞增殖的物质被发现,是一种来源于间叶组织的细胞外信号分子,由间充质细胞分泌,参与上皮-间充质相互作用[3]。HGF具有强大的促有丝分裂效应,通过自分泌和旁分泌作用促进肝脏、心脏和肌肉的营养吸收和利用,并促进组织修复[4-6]。骨的愈合过程(包括血管形成、炎症抑制和间充质细胞进入等)由细胞外信号分子介导[7]。血小板衍生生长因子、成纤维细胞生长因子和血管内皮生长因子等多种细胞外信号分子均可以促进骨折愈合和骨再生[8]。然而,HGF在骨组织生长发育过程中的调控作用尚未探明。因此,本研究拟通过在小鼠成骨细胞前体细胞系(MC3T3-E1)中外源加入HGF以探索HGF对MC3T3-E1细胞增殖、凋亡以及成骨分化和矿化能力的影响,旨在为HGF在骨组织工程领域的应用提供理论依据,并为新型骨生物材料的研发提供新思路。
1 材料与方法
1.1 主要试剂和仪器
CO2培养箱(Thermo,美国);离心机(Eppendorf,德国);PCR仪(Biorad,美国);HGF(Peprotech,美国);细胞计数试剂盒(cell counting kit-8, CCK-8)(Dojindo,日本);TUNEL细胞凋亡检测试剂盒(碧云天,上海);逆转录试剂盒,RT-PCR试剂盒(Takara,日本);碱性磷酸酶(alkaline phosphatase, ALP)、骨钙素(osteocalcin,OCN)、Runt相关转录因子(Runt-related transcription factor 2,Runx2)、成骨细胞特异性转录因子(osterix,OSX)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(ABCAM,美国)。
1.2 实验方法
1.2.1 细胞培养 将MC3T3-E1细胞培养于含10%胎牛血清的DMEM高糖培养基中,置于37 ℃、5% CO2的细胞培养箱内常规培养,2 d换液,3~4 d传代,待细胞进入对数生长期后进行实验。
1.2.2 CCK-8法检测 将MC3T3-E1细胞分为3组,每组设置5个复孔。对照组加入生理盐水,其他两组加入HGF溶液至终浓度分别为10 ng/mL、25 ng/mL。培养24 h、48 h、72 h后在避光处加入配制好的CCK-8液,37 ℃孵育2 h,450 nm检测其OD值。
1.2.3 TUNEL法检测 细胞分组及处理如上。培养24 h、48 h、72 h后,加入0.3% Triton X-100的PBS,室温孵育5 min。加入50 μL TUNEL检测液,37 ℃避光孵育60 min。用抗荧光淬灭液封片,在荧光显微镜下观察。随机选取5个视野,以凋亡细胞数与总细胞数的比值作为细胞的凋亡率。
1.2.4 碱性磷酸酶(ALP)和茜素红染色 将MC3T3-E1细胞分为对照组和实验组(HGF:25 ng/mL),成骨诱导培养基(含10 mmol/L β-甘油磷酸钠、10 nmol/L地塞米松、0.2 mmol/L维生素C)培养7 d后,按照说明进行ALP染色;成骨诱导14 d后,4%多聚甲醛固定1 h,现配的1%茜素红染液孵育30 min,自然干燥,观察拍照。
1.2.5 PCR检测 对照组和实验组的细胞在成骨诱导7 d后,Trizol法提取总RNA。按照说明书将mRNA反转录为cDNA,反应条件为:42 ℃,15 min,共3个循环,85 ℃,5 s。应用RT-PCR试剂盒检测成骨相关基因的mRNA水平,包括ALP、Runx2、OCN、OSX,引物序列见表1。PCR反应条件:预变性:95 ℃,2 min;PCR反应:95 ℃变性15 s,60 ℃退火+延伸60 s,共40个循环;绘制熔解曲线:95 ℃,5 s。以GAPDH为内参,使用2-ΔΔCt法计算相对表达量。

表1 实时荧光定量聚合酶链反应目的基因的引物序列
1.2.6 Western Blot检测 对照组和实验组的细胞在成骨诱导7 d后,加入RIPA裂解液冰上裂解30 min,离心后收集上清液。利用BCA法检测蛋白浓度,并将相同量的蛋白加入PAGE凝胶进行电泳分离,湿转膜至PVDF膜上,牛奶室温封闭1 h,一抗4 ℃孵育过夜,二抗室温摇床孵育2 h,底物化学发光ECL显色,凝胶成像仪曝光后进行图像分析。采用GAPDH作为内参,检测ALP、Runx2、OCN、OSX的表达情况,每组重复3次。
1.3 统计学分析
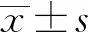
2 结 果
2.1 HGF对MC3T3-E1细胞增殖能力的影响
培养24 h时,10 ng/mL和25 ng/mL的HGF组与对照组的OD值无统计学差异。培养48 h时,高浓度组的OD值较对照组明显升高,提示细胞增殖能力的增强。培养72 h时,10 ng/mL组与25 ng/mL组的OD值与对照组比较差异具有显著性(P<0.05),说明10 ng/mL和25 ng/mL的HGF均明显促进了成骨细胞的增殖(表2)。

表2 肝细胞生长因子对MC3T3-E1细胞增殖活性的影响(OD值)
2.2 HGF对MC3T3-E1细胞凋亡的影响
培养24 h和48 h时,10 ng/mL组细胞的凋亡率与对照组无统计学差异,而在72 h时,10 ng/mL组明显低于对照组(7.67%vs. 10.05%,P<0.05)。25 ng/mL组细胞的凋亡率在24 h、48 h及72 h均低于对照组,差异具有统计学意义(P<0.05)(表3)。

表3 肝细胞生长因子对MC3T3-E1细胞凋亡率的影响
2.3 HGF对MC3T3-E1细胞矿化能力的影响
在对MC3T3-E1细胞进行成骨诱导7 d后,ALP染色可见细胞质呈紫色,实验组的染色明显深于对照组。细胞成骨诱导14 d后,茜素红染色显示红色钙结节形成,实验组钙结节的数量与颜色均高于对照组(图1)。
A、C:对照组ALP和茜素红染色结果;B、D:实验组ALP和茜素红染色结果
2.4 HGF对成骨相关因子mRNA和蛋白表达水平的影响
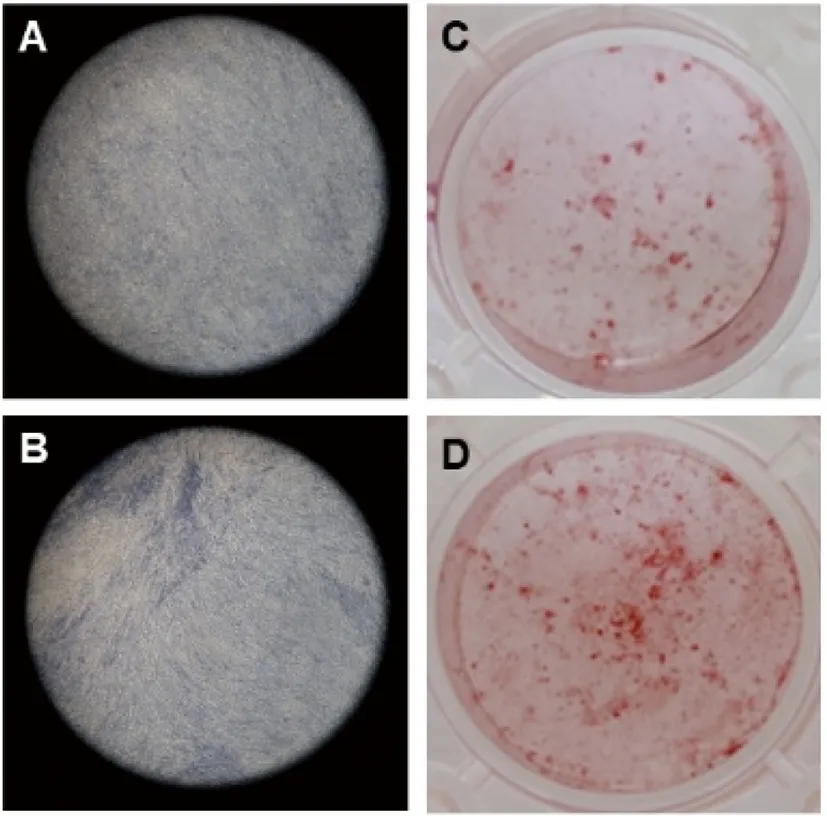
相较于对照组,实验组细胞中成骨相关因子ALP、Runx2、OCN、OSX的mRNA表达水平显著升高,相对表达量分别为1.78±0.17、3.49±0.26、1.60±0.04和1.82±0.17,以上差异较对照组均具有统计学意义(图2)。Western Blot结果显示,HGF也明显促进了成骨相关因子ALP、Runx2、OCN、OSX的蛋白表达(图3)。这些结果表明,HGF可促进MC3T3-E1细胞的成骨向分化。
与对照组比较,**:P<0.001

图3 MC3T3-E1细胞成骨相关蛋白的表达水平
3 讨 论
成骨细胞作为骨形成的主要功能细胞,参与骨基质的合成、分泌和矿化,从而调节骨形成和重建[9]。MC3T3-E1细胞具有高水平的成骨细胞分化特性,经诱导后形成矿化良好的细胞外基质,特异性表达成骨相关因子,可作为成骨细胞来进行研究[10]。因此,本研究应用MC3T3-E1细胞探究HGF对成骨细胞增殖、凋亡和成骨分化的影响。
HGF的生物学作用包括促有丝分裂、运动、形态发生和抗凋亡活性等,不仅作用于肝脏组织,也可作用于多种间叶来源的组织细胞[11-12]。本研究发现,HGF可以显著促进MC3T3-E1细胞的增殖,也对细胞凋亡具有明显的抑制作用,而且高浓度(25 ng/mL)的HGF相较于低浓度(10 ng/mL)作用更强。需要注意的是,HGF对破骨细胞和骨髓间充质干细胞同样具有促生长的作用[13-15]。这意味着,HGF对于骨再生和重建都具有重要作用,可能在骨缺损愈合过程中能够吸收愈合不良的异位骨痂,重建新生骨,从而维持良好骨稳态。因此,HGF在已发生不良愈合的骨再生环境中可能具有特异性的应用前景。
已有研究发现,骨髓瘤细胞可以合成HGF,并且HGF在多发骨髓瘤病人的骨髓中维持较高浓度[16]。郑彦文等[17]发现了HGF可以趋化诱导骨髓间充质干细胞定向迁移,表明HGF在成骨分化过程中具有重要作用。在本研究中,ALP染色可见HGF处理后的MC3T3-E1细胞矿化结节染色阳性比例明显升高,茜素红染色也显示出钙结节数量的增加,表明了HGF对MC3T3-E1细胞矿化结节形成具有明显的促进作用。
ALP作为反映成骨细胞分化和骨基质形成能力的标志物[18],在实验组中mRNA和蛋白表达水平显著高于对照组,表明HGF促进了MC3T3-E1的早期分化。OCN是成骨细胞的特异性生化指标,只表达于硬组织中,能够调节矿物质形成的速度和方向[19-20]。Runx2是成骨分化过程中重要的转录因子,是骨形成过程中最早和最具特征性的标志[21]。OSX是存在于Runx2下游的转录因子,仅在成骨细胞中特异性表达,主要在成骨分化晚期发挥作用[20]。通过对这些成骨相关因子的检测,发现高浓度(25 ng/mL)的HGF可以显著提高MC3T3-E1细胞中OCN、Runx2和OSX的mRNA和蛋白表达水平,与Wen等[22]对于骨髓间充质干细胞成骨分化的研究一致。成骨相关因子表达水平的升高意味着HGF促进了MC3T3-E1细胞的成骨分化,展现了HGF在骨组织再生领域的应用潜力。
综上所述,HGF能够促进体外培养的小鼠MC3T3-E1细胞的增殖,抑制其凋亡,并且能够促进MC3T3-E1矿化诱导过程中成骨相关基因及蛋白的表达,提升细胞的成骨分化和矿化能力,在成为骨生物材料改性因子方面具有极大的潜力和发展前景。本研究为HGF在骨组织再生中的应用提供了重要的理论依据,为新型骨生物材料的研发提供了新的思路。

