宁夏布鲁氏菌系统鉴定及16SrRNA基因序列分析
马学平,高建炜,杨 聪,韩 坤,张术斌,邹 悦,陈丽莉,海 娥,赵建华
布鲁氏菌病(Brucellosis)是目前世界上流行最广、危害最大的人畜共患病之一,广泛分布于世界各国[1]。1860年最早在地中海的马耳他岛发现布鲁氏菌病[2],我国流行的主要是牛种、羊种布鲁氏菌,羊种菌常造成人间布鲁氏菌病爆发,而牛种、猪种和犬种菌引起散发[3]。自1990年以来,国际上公认的布鲁氏菌有6种19个生物型[4],随后又分离出了田鼠型布鲁氏菌、鲸型布鲁氏菌、鳍型布鲁氏菌[5]。近年来,各地报道从动物和人体分离到布鲁氏菌,宁夏也相继从患者血液样本中分离到布鲁氏菌[6]。本研究采用传统生物学方法和分子生物学方法鉴定宁夏地区分离到的布鲁氏菌的种和生物型,经PCR(聚合酶链式反应)扩增16SrRNA(16S核糖体RNA)基因,测序分析构建遗传进化树,探讨16SrRNA基因测序分析法在布鲁氏菌鉴定中的应用,为布鲁氏菌的研究提供依据。
1 资料与方法
1.1 一般资料:宁夏地区布鲁氏菌历史菌株5株、标准参考菌株6株均由中国疾病控制中心传染病预防控制所布病室提供。其他9株具有代表性的布鲁氏菌株从2009-2016年宁夏地区布鲁氏菌感染人群分离菌株中选取。
1.2 仪器、试剂:美国BIO-RAD s1000型PCR基因扩增仪、德国艾本德5425型号高速离心机、北京六一仪器厂DDY-6C型电泳仪;美国BIO-RAD凝胶成像分析系统;引物由上海生工合成;DNA提取试剂盒和PCR试剂由北京天根生化科技有限公司购得。
1.3 方法
1.3.1 布鲁氏杆菌传统生物学鉴定:对20株布鲁氏菌采用革兰氏染色和柯氏染色做初步鉴定。单项特异性血清A、M、R,柯氏特异性染色和噬菌体鉴定布鲁氏菌的种和生物型。
1.3.2 布鲁氏杆菌的分子生物学鉴定:布鲁氏菌菌株在布氏琼脂上37 ℃培养48 h后,按照细菌基因组DNA提取试剂盒所附的操作说明书,提取布鲁氏菌基因组DNA。采用BCSP31-PCR(布鲁氏菌属特异性PCR)、Abortus Melitensis Ovis Suis PCR(AMOS-PCR)和多重PCR方法鉴定布鲁氏菌种和部分生物型,引物序列和PCR扩增程序参考文献操作[7-8]。
1.3.3 布鲁氏杆菌16SrRNA序列分析:从GeneBank下载与布鲁氏菌有共同抗原细菌的16SrRNA基因序列,采用DNAMAN设计引物。Primer1:R,5′-AGAGTTTGATCCTGGCTCAG -3′;F,5′- ACGGCTACCTTGTTACGACTT -3′,采用PCR方法扩增16SrRNA基因序列。PCR反应体系为:Pre-Mix 12.5 μl,引物各1 μl,DNA样本1 μl,超纯水9.5 μl,总体积25 μl,混合均匀,短暂离心。PCR扩增参数为:95 ℃预变性5 min,95 ℃变性30 s,54 ℃退火1.5 min,72 ℃延伸1.5 min,共30个循环;最后在72 ℃条件下延伸10 min,于4 ℃保存。用1.5%琼脂糖凝胶电泳(电压100V)检测扩增产物,并用凝胶成像分析仪拍照。
2 结果
2.1 布鲁氏菌分离鉴定:受检菌在双向培养瓶固相37 ℃培基上4~5 d 可见长出圆形、露珠样、大小不等的菌落,符合布鲁氏菌菌落形态。接种到布氏琼脂培养基上用革兰氏染色呈阴性小短杆菌,单个多呈无规则排列,很少双或链状的;柯氏染色呈红色散沙样。根据布鲁氏菌培养中CO2的需求和染料抑菌,A、M血清凝集和噬菌体裂解鉴定结果,见表1。
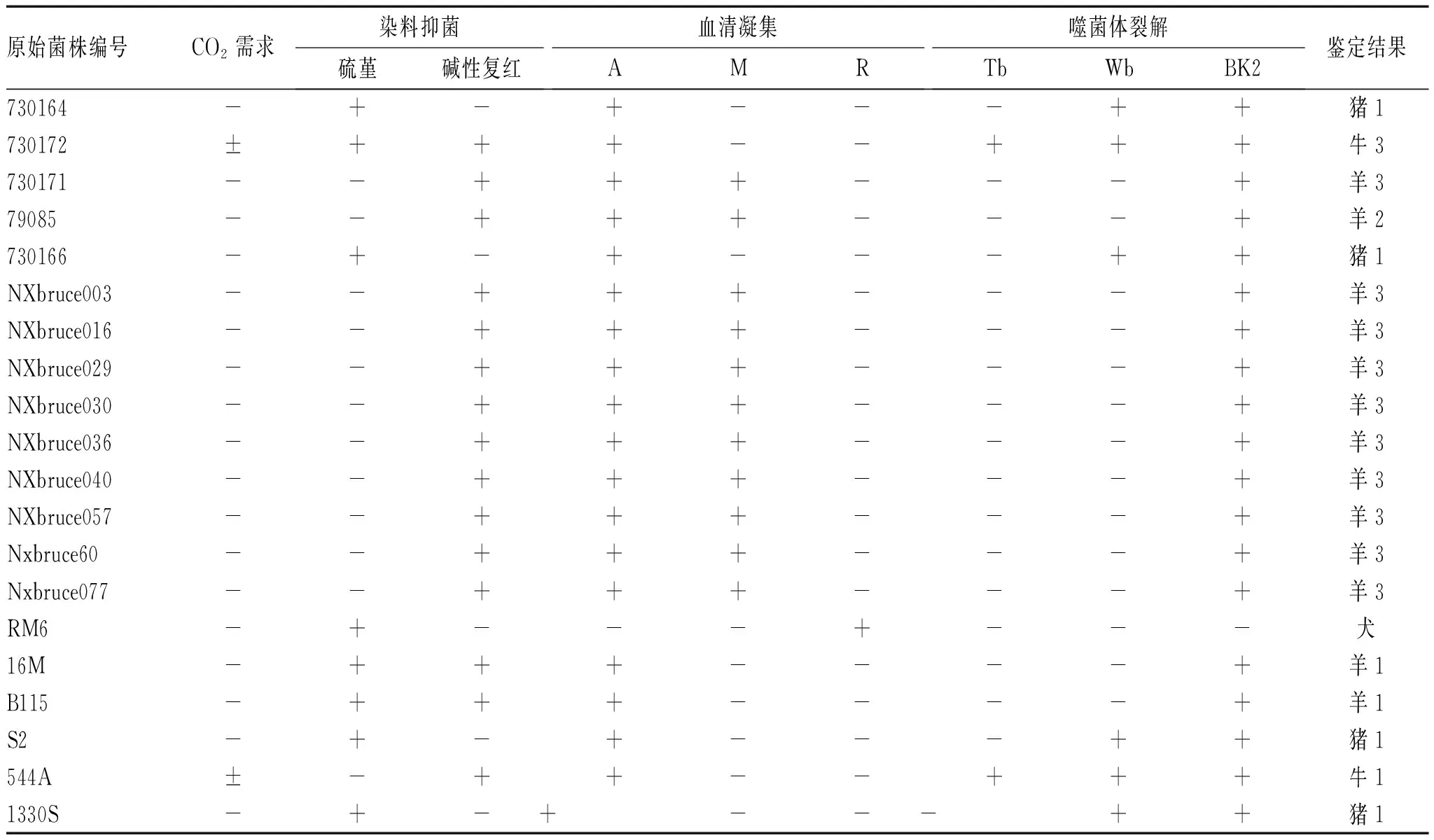
表1 布鲁氏菌传统生物学鉴定结果
经PCR扩增,所有菌株均获得223 bp大小的特异性片段,阴性对照未见特异基因片段,多次重复上述试验结果均一致。布鲁氏菌种AMOS-PCR可获得4条扩增带,其DNA扩增片段的大小为178、285、498和731 bp,所有菌株均能扩增出178 bp的片段,羊种生物型1、2、3型扩增出731 bp,猪种1型扩增出285 bp,牛种生物型1、3型扩增出498 bp,各种菌株之间电泳图谱不同,扩增的DNA片段多少不一。布鲁氏菌种多重PCR的鉴定,获得7条扩增带,根据各菌株间电泳条带不同进行鉴定。经BCSP31-PCR、AMOS-PCR和多重PCR分子生物学方法并结合血清凝集试验综合鉴定布鲁氏菌菌株生物型结果,见表2。

表2 布鲁氏菌传统生物学方法和分子生物学方法鉴定结果
2.2 布鲁氏杆菌16SrRNA序列分析
2.2.1 PCR扩增结果:经过PCR扩增体系优化后,均获得1 412 bp大小的特异性DNA片段,多次重复上述试验结果均一致,实验中未发现有其他特异的基因片段。
2.2.2 16SrRNA序列测定与分析:经基因公司的测序,获得各布鲁氏菌菌株单一的核酸序列,测序结果中删除峰值图两端可信度低的序列,所有菌株均得到了大约1 386 bp大小的基因序列。与布鲁氏菌标准菌株16SrRNA基因序列比对显示:Expect为0,Identities为100%,证明所选取的菌株基因序列与布鲁氏菌标准菌株16SrRNA基因序列吻合度为98.54%吻合。
布鲁氏菌16SrRNA基因测序构建的遗传进化树显示,布鲁氏菌的分离株与标准参考菌株在进化树的同一分支上,遗传距离近,无法精确地区分关系。人苍白杆菌与布鲁氏菌属形成分支,其同源性为98%,遗传距离为0.019,表明这两种菌之间亲缘关系较近。大肠杆菌和耶尔森菌同源性为95%。而布鲁氏菌与其均有共同抗原的霍乱弧菌、大肠杆菌和耶尔森菌属均没有在同一分支上,表明其遗传距离和亲缘关系较远。
3 讨论
自1887年英国军医Bruce首次分离到羊种布鲁氏菌以来,人们对布鲁氏菌的研究和认识不断深入,但是对布鲁氏菌的分种分型方法一直存在争议[9]。目前,国际上对布鲁氏菌分种分型的鉴定还没有一个确切的标准,主要是依据布鲁氏菌分离与培养过程中对H2S需求、染料抑菌、CO2需求、血清凝集、噬菌体裂解、革兰氏染色以及柯氏染色的特点等方法,但传统生物学对实验室要求高,鉴定耗时长,容易发生交叉反应导致出现误诊漏诊,且在活菌实验操作的过程中易造成实验室人员的感染和部分菌株无法鉴定等,难以满足现代细菌学对布鲁氏菌研究的需求。随着分子生物科学技术研究的深入,特别是基因组聚合酶链式反应技术和核酸技术的提出及研究的不断完善,产生了许多新的分类技术和方法,如AMOS-PCR、多重PCR、PCR指纹图、16SrRNA基因序列分析和构建遗传进化树等。PCR方法是一种快速、敏感、特异性强的检测方法,在布鲁氏分离菌株的鉴定中广泛应用[10]。近年来,国内各地不断有布鲁氏菌分离菌株报道,张红芳等用PCR和AMOS-PCR方法对浙江省桐乡市首例布鲁氏菌进行鉴定,其结果为羊种3型,与传统方法吻合[11]。毛玲玲等对2010年辽宁省分离的1株疑似犬种布鲁氏菌进行生物型及分子生物学鉴定[12],结果采用传统分型方法结合多重PCR提示犬种布鲁氏菌与猪种布鲁氏菌的亲缘关系较近。目前,AMOS-PCR在国内外被广泛应用,其鉴定结果与传统方法符合率高,羊种菌为100%,牛种菌为80%,猪种菌为90%,绵羊附睾种菌为 100%[13]。本实验利用传统的生物学方法与AMOS-PCR和多重PCR等分子生物学方法共同对宁夏地区2009-2016年分离布鲁氏菌部分代表性菌株进行鉴定,结果均为羊种3型布鲁氏菌,AMOS-PCR多重PCR方法鉴定结果与传统生物学方法的符合率为100%,与报道文献相一致。
16SrRNA为普遍存在于原核生物的一种核糖体RNA,其种类少,含量大,分子大小合适,在生物进化过程中基因序列变化非常缓慢,可以用来标记生物的进化距离和亲缘关系,在结构与功能上具有高度的保守性[14]。布鲁氏菌16SrRNA基因序列分析可以快速、准确地鉴定布鲁氏菌的分类地位和生物型,也可以用于研究其遗传特征和分子差异及遗传距离不同的各类生物间亲缘关系。本实验对选取具有代表性的20株宁夏地区的布鲁氏菌经BCSP31-PCR鉴定均为布鲁氏菌属。经16SrRNA序列测定并建立遗传进化树显示,不同年代、不同地区和种型的代表性分离菌株和标准参考菌株均在遗传进化树末端的分支上,表明分离株均为布鲁氏菌,则前后实验结果一致。但由于同源性高,遗传距离十分接近,没有办法精确地区分各种生物型间的相互关系,这与Boye K等研究结果一致[15]。布鲁氏菌16SrRNA基因遗传树提示,16SrRNA为高度保守序列,只适合于鉴定各种细菌属,但不适合做遗传进化分析的靶基因,因此要选择保守性较差的基因构建遗传进化树[16]。布鲁氏菌属与人苍白杆菌在进化树的同一次分支上,并且16SrRNA基因同源性为98%,遗传距离为0.019,说明这两种菌的亲缘关系较近。布鲁氏菌与霍乱弧菌、大肠杆菌O∶157、耶尔森菌O∶9等均没有在遗传进化树的同一分支上,并且遗传距离较远,遗传距离均大于0.02,提示其亲缘关系较远,这与刘国志等人的研究结果一致[16]。16SrRNA已经广泛应用于不能或不易培养的细菌或未知病原体的遗传特征和分类鉴定,不仅试验结果直观、分类鉴定准确,也便于信息化管理和构建数据库,可为后续基因遗传进化关系和分子差异的研究提供依据。

