骨膜蛋白在急性创伤性脑损伤大鼠中的表达及临床意义
王 华,凌 云,杨 欣
创伤性脑损伤(TBI)是由外力引起的创伤性结构损伤和/或脑功能障碍,可引起神经功能或细胞炎性反应甚至凋亡。资料显示该病为40岁以下人群死亡的最大单一因素,近年来发生率和死亡率均较高,且呈逐年上升趋势[1]。根据其体征恢复情况可分为急性TBI(Acute TBI,aTBI)和持续性TBI,aTBI具有疾病急骤、病情危重、疗效较差等特点,目前暂无对症疗法。aTBI常与急性应激反应、抑郁症等共存,其病理生理过程较复杂,考虑与分子表达和信号通路有关。罹患aTBI,常伴随脑水肿形成、缺血缺氧发生及细胞凋亡等脑组织屏障恶性反应,且神经功能呈进行性减退,直接导致死亡。TBI发生后,对损伤严重程度的判断及预后转归的评估逐渐成为临床医师关注的焦点。既往对微管结合蛋白2(MAP2)、基质金属蛋白酶-2(MMP-2)与脑损伤轻重程度关系探讨较多[3]。最新研究指出骨膜蛋白(Periostin)是一种重要且含量丰富的细胞外分泌蛋白,在多种生理及病理状态下均会表达,具有易检测和较高敏感性[4]。相关文献已发现Periostin能在脑膜瘤、乳腺癌等中表达,且可作为肿瘤级别和预后敏感性标志物。另有研究显示其能在中枢神经系统广泛表达,且在病理状态下表达更显著[5-6]。但目前未见Periostin与aTBI发病机制及其严重程度的报道,且既往研究中报道较多的相关蛋白分子对疾病发展及预后判断无特异性和敏感性。因此,本研究探讨Periostin在aTBI中的表达及其临床意义,为临床诊断和治疗该病提供参考,现作以下报告。
1 资料与方法
1.1 一般资料:实验动物购自北京市医疗器械检验所(动物实验中心),均为清洁级大鼠共36只;构建急性脑损伤手术模型。动物使用和处理符合中华人民共和国国家卫生研究院实验动物保护法和使用指导要求,且通过医学动物伦理委员会批准。所有大鼠体重(2.3~3.2)kg,平均(2.59±0.44)kg;饲养3~5个月,平均(4.20±0.09)个月;单笼饲养7 d;常规全面脑部检查排除脑部其他疾患。将建模成功后的大鼠随机分成A、B、C组,每组各12只大鼠,A组为空白对照健康大鼠、B组为aTBI大鼠、C组为接受Periostin干预的aTBI大鼠。每组6只用于Periostin浓度、认知和行为能力检测,另外6只用于HE染色。入选病例的随机化分组方法:①编号,按体重由轻到重顺序编为:01、02、03、04……23、24、25、26、27;②抄随机数,从随机数表第一行第一个数字开始,横向依次抄录27个随机数并依次除以3写下余数;③随机数编号,按余数0、1、2从小到大编;④归组,秩次为0编入A组(空白对照健康大鼠),秩次为1编入B组(aTBI大鼠),2编入C组(接受Periostin干预的aTBI大鼠)。
1.2 方法
1.2.1 建模:检查脑外部和神经情况排除脑外伤和脑部其他疾患,注射戊巴比妥钠(湖北鸿运隆生物科技有限公司)麻醉大鼠,剂量为50 mg/kg;外力击打冠状缝后1 mm和中线旁2 mm交叉处,并以此为中心作直线头皮切口;剃发备皮、消毒达无菌后用切片刀切开头皮,采用牙科磨钻钻开直径5 mm的颅骨骨孔;采用自由落体损伤装置将40 g击锤作25 cm高的自由落体撞击控制杆;然后采用缝针缝合头皮,常规包扎伤口。A组(空白对照健康大鼠)其他步骤与B、C组一样,但未接受自由落体外力击打。过程中死亡大鼠用无差异的存活大鼠补充,确保3组各有9只大鼠。
1.2.2 给药:建模成功后30 min A、B组经右侧脑室注射含1 μg正常IgG的PBS溶液2 μL,C组注射含1ug Periostin的PBS溶液2 μL。其中6只大鼠给药24 h后以80 mg/kg剂量的戊巴比妥钠深度麻醉大鼠,断头处死;挫伤灶行常规HE染色和组织化学染色。
1.3 判定标准
1.3.1 染色标准:①切片完整,厚度4~6 μm,厚薄均匀,无皱褶无刀痕;②染色核浆分明,红蓝适度,透明洁净,美观。由2位5年以上从事HE染色实验的临床专业医师在对临床病理资料不知情情况下,进行判断常规HE染色各细胞阳性表达情况。
1.3.2 染色判定标准:依据阳性细胞染色程度和所占比例进行评分:无色为0分,浅色为1分,正常为2分,深色为3分;细胞结构清晰无显色为阴性(-);染色1~2分为弱阳性(+);染色2~3分为阳性(++);≥4分为强阳性(+++)。
1.4 观察指标:①外周血Periostin浓度。眼眶采取大鼠静脉血1 mL,3 000 r/min离心15 min并保存,采用酶联免疫吸附测定法(ELISA)检测Periostin浓度,试剂购自江西江蓝纯生物试剂有限公司,名称大鼠Periostin ELISA试剂盒,货号JLC14363。②脑脊液Periostin浓度。麻醉大鼠后采用蝶形针经枕骨大孔穿刺待有落空感,注射器轻抽脑脊液注入EP管并与-70 ℃条件下保存。③炎性因子。ELISA法检测IL-6值;免疫比浊法检测C-反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α);试剂盒购自上海江莱生物科技有限公司,操作方法严格按说明书执行。④认知功能。采用Morris水迷宫实验测定,将大鼠面向池壁分别从两个象限入水点放入水中,记录其寻找到平台所需时间,根据时间计分,分数越高说明认知功能越差。⑤行为能力。采用改良神经功能缺损评分(NFDS),通过运动、感觉、反射、不正常运动和平衡试验五个方面依次量表计分,分数0~18分,分数越高说明神经功能缺损越严重。⑥神经细胞凋亡率。采用全自动UMNSAH/DF-1细胞系(上海宾穗生物科技有限公司)统计细胞凋亡数,操作方法参考说明书,且由专科医师操作;凋亡细胞为胞核固缩、有棕黄色颗粒或团块。⑦ Periostin对特异性蛋白表达的影响。采用蛋白免疫组化染色法检测大鼠脑皮层MAP2、MMP-2阳性表达率。⑧采用WB检测大鼠闭锁连接蛋白-1(ZO-1)、水通道蛋白-4(AQP-4)、Janus蛋白酪氨酸激酶2(P-JAK2)蛋白表达情况,探讨Periostin对TBI的分子机制。
1.5 统计学方法:采用SPSS 21.0统计软件,多组间计量资料比较采用单因素方差分析,两两比较采用Snk-q检验,组内治疗前后采用配对样本t检验;采用非参数检验Mann-Whitney法检验分级资料;计数资料比较采用χ2或Fisher确切概率法检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外周血、脑脊液Periostin浓度比较:3组外周血、脑脊液Periostin浓度比较差异有统计学意义(P<0.05),C组外周血、脑脊液Periostin浓度高于B组和A组(P<0.05),B组脑脊液Periostin浓度高于外周血浓度(P<0.05),见表1。

表1 外周血、脑脊液Periostin浓度比较
2.2 炎性因子比较:单因素方差分析,3组IL-6、TNF-α、CRP水平差异无统计学意义(P>0.05),见表2。肺部炎性细胞图见图1-图3(目录后)。
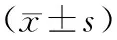
表2 炎性因子比较
2.3 认知功能、NFDs比较:3组NFDs差异有统计学意义(P<0.05),C组NFDs>B组>A组(P<0.05),见表3。
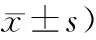
表3 认知功能、NFDs比较(分,
2.4 神经细胞凋亡率比较:A组神经细胞凋亡率(5.44±0.68)%,B组神经细胞凋亡率(14.39±2.20)%,C组神经细胞凋亡率(28.92±5.68)%,3组神经细胞凋亡率差异有统计学意义(F=15.166,P<0.05)。神经细胞形态变化和凋亡情况见图4-图6(目录后)。
2.5 Periostin对特异性蛋白表达率的影响:3组MAP2、MMP-2表达率差异有统计学意义(F=15.166,P<0.05),见表4。

表4 Periostin对特异性蛋白表达率的影响
2.6 Periostin对ZO-1、AQP-4、P-JAK2表达率的影响:3组ZO-1、AQP-4、P-JAK2表达率差异有统计学意义(P<0.05),C组ZO-1表达率低于B组和A组(P<0.05),C组AQP-4、P-JAK2表达率高于B组和A组(P<0.05),见图7(目录后)。
3 讨论
Periostin已被广泛应用于癌组织转移及浸润的研究中,被证实在受损细胞中可过度表达[6]。丁强等[7]文献指出,急性冠脉综合征患者Periostin浓度高于正常患者且其脑脊液中Periostin浓度高于血清中浓度,考虑其为神经细胞产生,可直接作用于脑组织和细胞。最新大鼠药敏实验也表明,Periostin可加重脑神经细胞炎性反应和破坏神经功能,提示其对脑组织具有较强毒副作用[8-9]。Davidson等[10]研究指出,Periostin可能通过激活患者体内各种特异性蛋白来发挥作用,而其作用机制包括激活P-JAK和MAP类蛋白。根据上述参考文献可得,Periostin产生于神经系统,含量丰富,易于检测,与aTBI发生与发展密切相关。本研究选择大鼠作为模型动物,因大鼠易操作,且价格较便宜,是临床建立动物模型常用实验动物。另早有研究指出大鼠脑结构和人脑相似度高,在脑损伤机制和各类因子表达上与人相似[11]。本研究将大鼠分为3组,除一般空白对照组和实验组外,增加Periostin干预组,能为进一步探讨Periostin对脑损伤作用机制提供更有力的参考依据。结果Periostin在aTBI体内显著表达,且其在脑脊液中的浓度高于外周血浓度,与既往报道结果一致,说明Periostin位置特异性决定其可参与神经系统生理过程。为进一步探讨Periostin对aTBI作用机制,依次分析了3组大鼠认知功能、NFDs及神经细胞凋亡率,结果存在脑损伤且Periostin异常上调情况下神经功能缺损和凋亡率最高,提示Periostin对TBI有恶化作用。
Periostin如何参与损伤的病理生理过程,根据文献测定与该病机制相关标志物水平发现,在Periostin作用下,MAP2、MMP-2表达率增高,考虑与其具有相关性。MAP2是一种可调节微管稳定和聚合的磷蛋白,对神经元兴奋发生、延长、稳定有重要作用。在正常脑组织中MAP2含量最丰富,可作为树突损伤潜在生物标志物。曹红玲等[12]发现重度TBI患者血清MAP2明显升高,且与患者认知功能、格拉斯哥昏迷密切相关。MMP-2是锌结合蛋白家族成员之一,在脑组织中含量最丰富,主要参与细胞外基质重塑,表达率越高提示脑损细胞损失越严重。李文鹤等[13]文献发现,MAP2、MMP-2在大鼠脑损伤后1 d、3 d、5 d均有明显升高,提示该特异性蛋白可作为脑损伤主要致病机制。根据TBI发病因素和MAP2、MMP-2分子性质可得,Periostin可刺激细胞及细胞外基质作出不同反应,从而进一步加重神经细胞凋亡,因MAP2、MMP-2参与血脑屏障通透性,脑损伤加重可引起其水平异常升高。另本研究探讨Periostin对信号分子作用机制发现,ZO-1表达增加,而AQP-4、P-JAK2表达下降,说明作用机制与分子通道有关。探讨分子机制得出ZO-1退化可破坏血脑屏障通透性,进而导致水肿和神经炎症。在谭海玲等[14]文献中发现,aTBI患者体内AQP-4水平显著高于慢性TBI,提示可作为脑水肿发展重要因子。当细胞信号通路受阻,P-JAK2值升高,提示其与TBI发病机制相关。王宝庆等[15]研究表明,ZO-1通路的激活可引起MAP2、MMP-2表达增加,提示分子机制与蛋白表达具有相关性,可能与Periostin激活ZO-1通道而增加了特异性蛋白表达有关。另外TBI进一步发展常刺激巨噬细胞、T细胞释放大量炎性因子,而IL-6、TNF-α、CRP作为重要炎性介质,可直接反映机体免疫能力。Vaughan等[16]文献指出,IL-6与受体结合后可诱导P-JAK类因子过度表达,加重脑损伤。CRP是一种敏感但缺乏特异性的生物标志物,感染、肿瘤、手术、烧伤等炎症反应均可促使其表达增高,之前被认为是TBI继发性损伤生物标志物。目前,研究认为CRP水平升高与进行性心理及认知功能障碍呈相关性[16]。本研究中Periostin干预组IL-6、TNF-α、CRP值最高,说明其可进一步加重肺部损伤。
Periostin可通过激活JAK2通路降低ZO-1表达,提高MAP2、MMP-2表达,加重脑损伤,抑制其表达可能成为aTBI治疗新方法,且来源于神经细胞,在aTBI患者脑脊液中呈高表达水平、含量丰富,可作为诊断和预测aTBI理想标志物。

