水貂阿留申病毒不同密度表位肽的串联表达研究
秦飞燕,孙 杰,马凡舒,张 蕾,闫喜军
(1.中国农业科学院特产研究所 特种经济动物分子生物学国家重点实验室 农业部经济动物疫病重点实验室,吉林 长春 130122 ; 2. 河南省农业科学院动物免疫学重点实验室 农业部动物免疫学重点实验室 河南省动物免疫学重点实验室,河南 郑州 450002)
水貂阿留申病(Aleutian disease,AD)是由细小病毒科(Parvoviridae)阿留申病毒属(Amdoparvovirus)的水貂阿留申病毒(Aleutian disease virus,ADV)感染引起,是一种世界范围内流行的慢性传染病[1-2]。水貂发病的症状与病毒和动物的自身情况相关[3]。不同的病毒毒株,动物的不同基因型和年龄表现的症状不同[4]。AD临床表现多样,经典的AD症状在成年水貂表现为自身免疫综合征,患病水貂高γ-球蛋白血症、肾小球肾炎、动脉血管炎,水貂繁殖能力大大下降,幼貂常发生急性间质性肺炎[5-6]。该病通过直接接触、间接接触以及垂直途径均可传播[3]。因此,ADV感染的貂厂难以净化,给世界各地水貂养殖场带来巨大的经济损失。
VP2蛋白作为病毒粒子的主要衣壳蛋白,是病毒主要的抗原表位区,携带ADV主要B淋巴细胞抗原表位,是ADV基因功能疫苗和诊断制品研发的重点[7]。通过基因工程技术将抗原表位肽进行串联,既提高了表位密度,又减少了无关干扰序列的影响[8]。目前,表位串联技术已经广泛应用于诊断抗原、免疫原的制备。本研究将ADV VP2蛋白抗原表位肽的编码序列反复串联,并在原核系统中诱导表达,然后通过Western Blot和对流免疫电泳(Convective immunoelectrophoresis,CIEP)鉴定重组蛋白抗原性,采用ELISA对重组蛋白的抗原性分析比较,以优选出可以作为检测抗原的重组蛋白。
1 材料
1.1 菌种、质粒 感受态细胞E.coliBL21(DE3),购自北京全式金生物技术有限公司;质粒pET-30a(+)和标准阴阳性血清,均由经济动物疫病防控研究室保存。
1.2 主要试剂及仪器 T4 DNA连接酶,购自TaKaRa公司;Protein Marker、限制性内切酶XhoⅠ和EcoRⅠ,均购自Thermo公司;CIEP商业抗原,购自特研生物公司;辣根过氧化物酶标记山羊抗雪貂抗体(IgG/HRP),购自KPL公司;His-Tagged Protein Purification Kit,购自康为世纪生物技术有限公司;蛋白电泳仪,购自Bio-Rad公司;SpectraMax190光吸收酶标仪,购自Molecular Devices公司;DYCP-38B型对流免疫电泳仪,购自北京六一仪器厂。
2 方法
2.1 不同表位密度串联体的设计与抗原性预测 基于前期工作基础,我们选取了ADV-DL株VP2的一段表位肽P(415~433aa,氨基酸序列为SNYYSDHEIEQHTAKQPKL)为基础,分别将2、4、6、8段表位肽P用柔性Linker(GGGGS)串联连接,并在基因序列首尾分别添加限制性内切酶XhoⅠ和EcoRⅠ的酶切位点,由生工生物工程(上海)股份有限公司合成。并采用DNASTAR软件中的Protean对多表位串联体进行抗原性分析。
2.2 不同表位密度重组表达质粒的构建 用限制性内切酶XhoⅠ和EcoRⅠ 双酶切pET-30a(+),使用DNA纯化回收试剂盒回收5 422 bp的载体片段。通过T4 DNA连接酶将串联表位基因定向连接到pET-30a(+)多克隆位点,构建含有不同数量表位肽的4个重组质粒;然后转化至E.coliBL21(DE3),于37 ℃震荡培养12 h后,涂布于卡那霉素抗性琼脂平板继续培养12 h;挑取单菌落培养后,提取质粒DNA进行双酶切鉴定,将阳性克隆送至生工生物工程(上海)股份有限公司测序验证,将测序正确的重组质粒命名为pET-P2、pET-P4、pET-P6和pET-P8。
2.3 不同表位密度重组蛋白的表达与纯化 将测序正确的阳性克隆菌种分别接种于4支装有5 mL新鲜LB培养基(含50 mg/L卡那霉素)的试管中,于37 ℃培养至OD600值达到0.4~0.6时,加入IPTG(终浓度为1 mmol/L),37 ℃诱导4 h。
诱导结束后,收集菌液,4 ℃、10 000 r/min离心5 min,弃上清。用预冷的PBS(pH值7.4)重悬菌体,在冰浴条件下超声破碎(功率300 w,工作5 s,间歇5 s,30次),然后4 ℃、12 000 r/min离心15 min,收集上清,经0.22 μm的滤器过滤,纯化策略参考康为世纪公司His-Tagged Protein Purification Kit说明书进行,将Ni-Agarose Resin填料混匀后加入层析柱,室温静置10 min,待凝胶与溶液分层后,把底部的出液孔打开,让乙醇通过重力作用缓慢流出;向装填好的柱中加入5倍体积的去离子水将乙醇冲洗干净后,再用8倍柱体积的Binding Buffer平衡柱子;取过滤后的上清负载上柱,流速为10倍柱体积/h,收集流穿液;使用15倍柱体积的Binding Buffer冲洗柱子,洗去杂蛋白。使用适量Elution Buffer洗脱并收集目的蛋白。通过BCA法测定蛋白浓度。
2.4 不同表位密度重组蛋白的抗原性鉴定
2.4.1 Western Blot鉴定抗原性 将纯化后的蛋白经SDS-PAGE分析,电转印至NC膜上,用含5% 脱脂乳的PBST封闭2 h,用PBST洗涤3次,10 min/次;抗ADV标准阳性血清(1∶200)37 ℃孵育1 h,用PBST洗涤5次,10 min/次;山羊抗雪貂IgG/HRP(1∶4 000)37 ℃孵育1 h,用PBST洗涤5次,10 min/次;TMB显色。
2.4.2 CIEP鉴定抗原性 制备含1%琼脂糖的巴比妥缓冲液(巴比妥1.84 g,巴比妥钠 10.3 g,溶于1 L水中,调节pH值至8.6),煮沸至琼脂糖充分溶解后,取20 mL该溶液平均覆盖于6 cm×6 cm玻璃板上,厚度应达到2~3 mm。待凝胶凝固后,用毛细管在凝胶表面打孔并挑去孔内琼脂块,小孔应成对排布,间隔1 cm左右。
将CIEP商业抗原、各重组蛋白抗原和抗ADV标准阴、阳性血清分别加到琼脂板上相应的孔中,将已加样品的琼脂板置于电泳槽内,两端用巴比妥缓冲液浸泡后的3层棉布搭桥,抗原接负极,抗体接正极。将设备置于90 V电压下电泳45 min,结束后由2个经验丰富的操作人员观察琼脂板上抗原和抗体间的沉淀线。
2.5 不同表位密度重组蛋白的抗原性比较 将纯化的重组抗原蛋白PP4、PP6和PP8分别均以质量浓度5、2.5、1 μg/ mL包被96孔酶标板,分别以1∶100稀释的抗ADV标准阴、阳性血清为一抗,山羊抗雪貂IgG/HRP(1∶4 000)为二抗,其余步骤按常规ELISA进行,最后读取OD450值,计算P/N值。比较不同重组抗原的抗原性。
3 结果
3.1 串联体的亲水性、抗原性和表面可及性预测结果 以8个表位肽串联为例,用Linker依次串联连接(具体DNA序列见图1),采用DNASTAR软件中的Protean对多表位串联体进行亲水性、抗原性和表面可及性分析,见中插彩版图2。结果显示,多表位串联体各自表位的亲水性基本没变;串联体仍具有原来各自的表位特征,也没有新的抗原表位产生,且Linker所在位置抗原性很低。由此可以推测该设计结果中串联体各表位具有独立的抗原性。

图1 8个表位肽串联体的DNA序列Fig.1 DNA sequence of 8 epitope peptide concatenates注:加粗部分是酶切位点序列,框内部分是Linker序列Note:The bold part is the sequence of restriction sites,and the part in the box is the Linker sequence
3.2 重组质粒的酶切鉴定 将4个重组质粒pET-2、4、6、8经限制性内切酶XhoⅠ和EcoR Ⅰ双酶切鉴定,琼脂糖凝胶电泳可见约1 159、1 303、1 447 bp和1 591 bp大小的DNA片段(见图3)。测序结果显示,片段大小与预期大小相符且读码框正确。
3.3 重组蛋白的抗原性鉴定 SDS-PAGE结果显示,重组蛋白PP2未能成功表达。Western Blot结果显示,成功表达的3个重组蛋白大小符合预期,且均能够被抗ADV阳性血清所识别(见图4),同时这些重组蛋白不与抗ADV阴性血清反应。另外,CIEP结果显示,在商业抗原和3个重组蛋白与抗ADV阳性血清间均产生了肉眼可见的沉淀线,与抗ADV阴性血清间均未形成沉淀线。结果表明,3个重组蛋白均能与抗ADV阳性血清发生特异性反应,具有一定的抗原性。
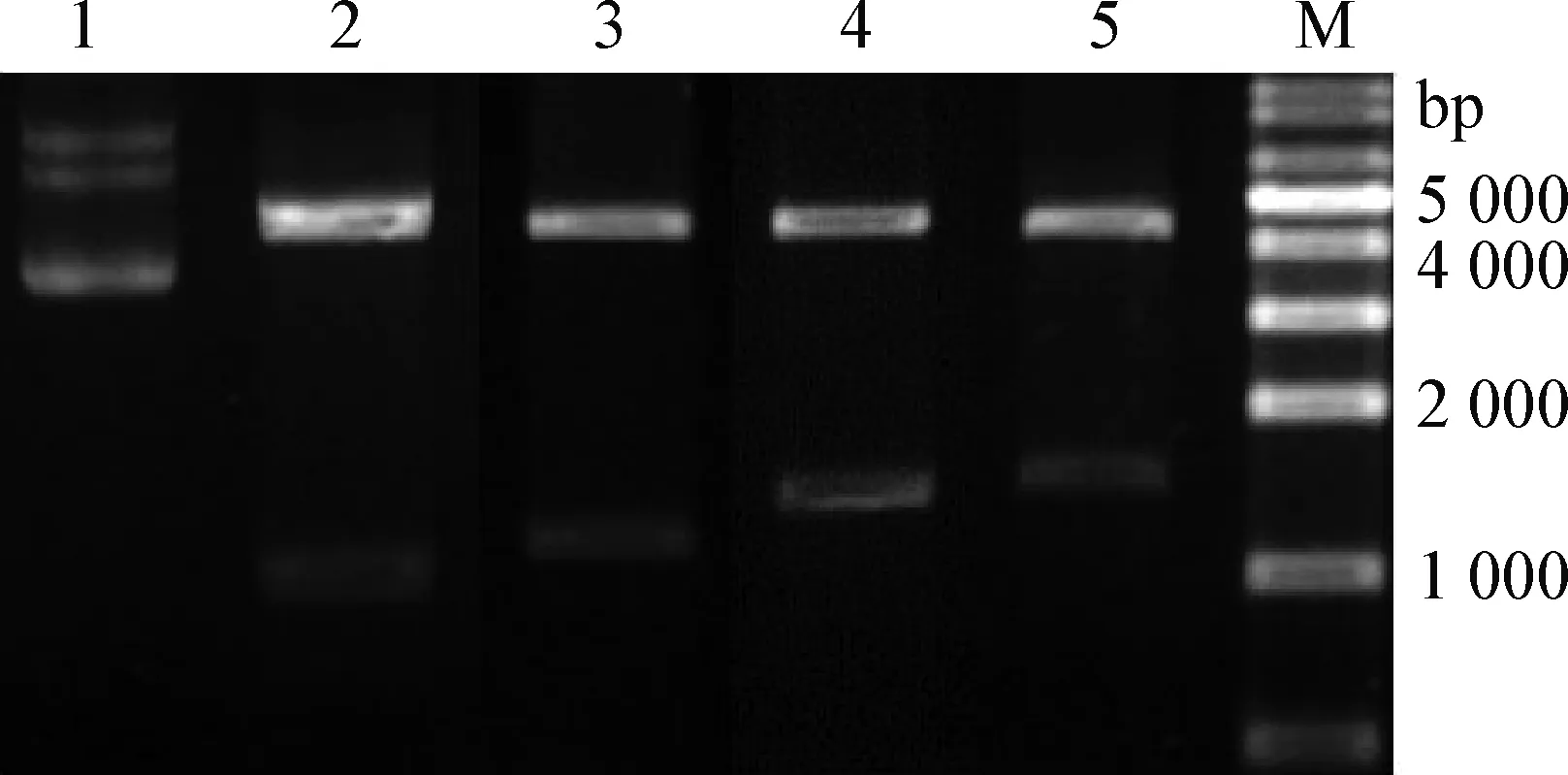
图3 重组质粒的双酶切鉴定Fig.3 Identification of recombinant plasmids by double enzyme digestionM:DL-10 000; 1:pET-30a(+)质粒对照; 2:pET-P2;3:pET-P4; 4:pET-P6; 5:pET-P8M:DL-10 000; 1:pET-30a(+)plasmid control;2:pET-P2; 3:pET-P4; 4:pET-P6; 5:pET-P8
3.4 重组蛋白抗原性的ELISA分析 采用ELISA方法鉴定纯化后的重组蛋白PP4、PP6和PP8的抗原性,结果显示,3个重组蛋白与ADV阳性血清反应OD450值均在2.0左右,呈现阳性;与阴性血清反应的OD450值均在0.1左右,呈现阴性。图5为在3种不同质量浓度下3个重组蛋白的检测结果P/N值。在3个重组蛋白中PP8的P/N值最高,PP6次之,PP4最低。结果表明,重组蛋白PP8的抗原性最强。
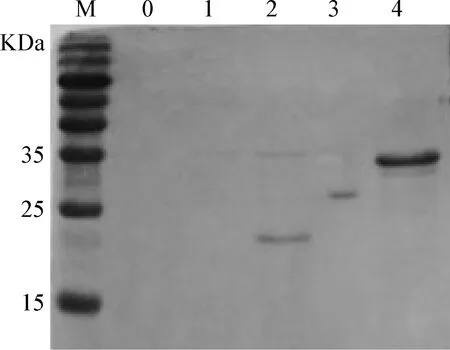
图4 重组蛋白的Western Blot分析Fig.4 Identification of the recombinant protein by Western BlotM:蛋白分子质量标准; 0:空载体对照; 1:PP2; 2:PP4; 3:PP6; 4:PP8M:Protein Marker; 0:Vector control; 1:PP2; 2:PP4; 3:PP6; 4:PP8
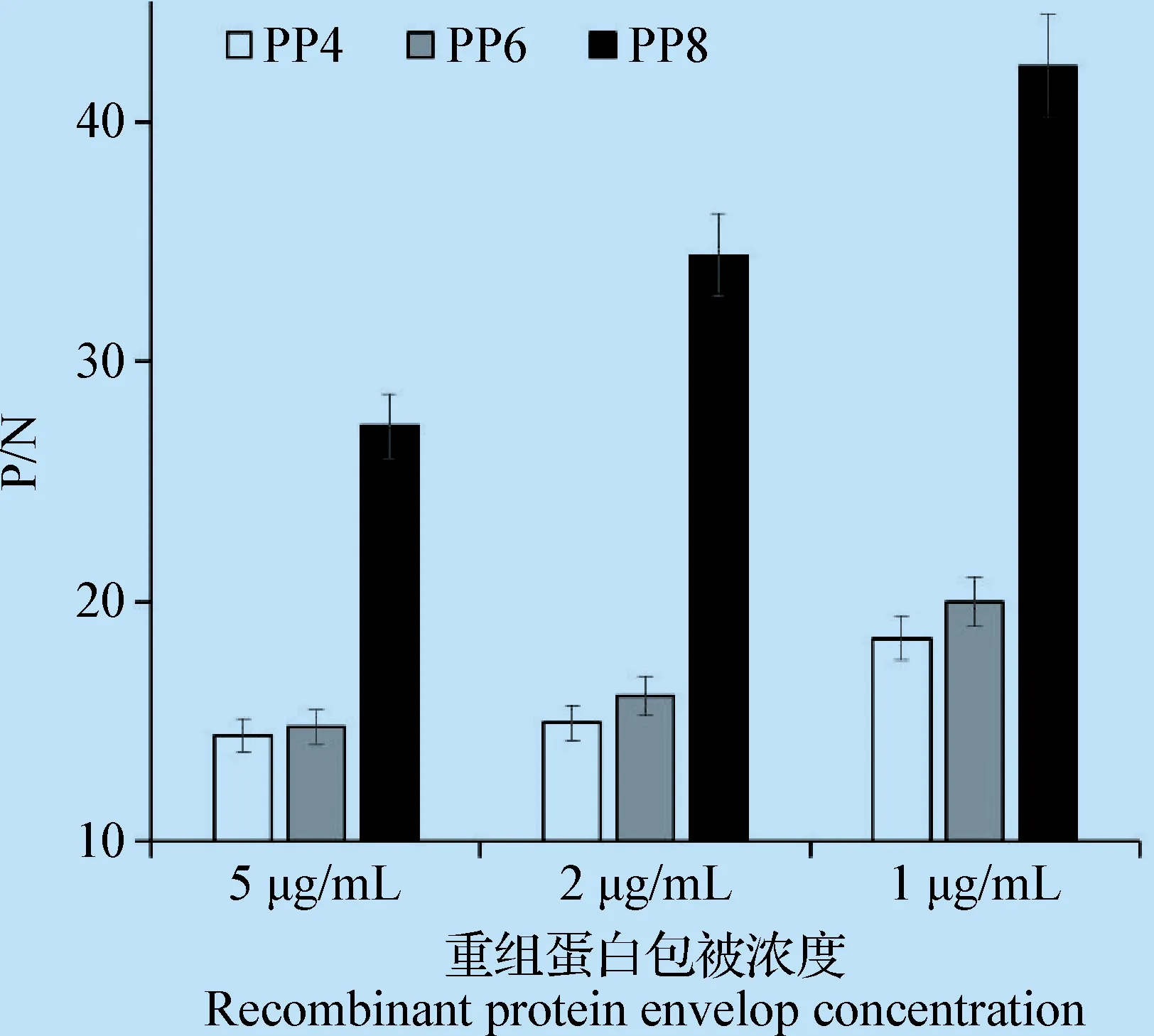
图5 ELISA比较不同抗原表位密度重组蛋白的抗原性Fig.5 Antigenicity comparison of the different multi-copy antigenic epitopes P by ELISA
4 讨论
现代免疫学认为,有效的免疫保护来源于一组表位的合理组合与搭配,表位抗原是目前诊断研究的一个热点[9]。综合文献发现,通过不断串联的方式提高表位密度,会导致串联基因的片段变大,可能会影响大肠杆菌的异源表达,降低重组蛋白的表达量,甚至不表达[10]。有研究报道,在牛病毒性腹泻病病毒(BVDV)的研究中,将BVDV的双表位基因进行串联,原核表达获得含有2、6、10、12个和14个 表位肽的5种重组蛋白,其中含有12个表位肽的重组蛋白的表达量和抗原性有别其他重组蛋白[8]。因此也并非抗原表位密度越高抗原性就越高。在ADV诊断抗原的研究中也有关于多表位串联的成功尝试[11],本研究试图以不同抗原表位密度的重组蛋白抗原性的差异作为抗原研究的一个新的切入点,对ADV多表位串联诊断抗原进行初步探究。
串联的抗原表位之间一般会采用连接肽进行连接以改善重组蛋白的折叠和活性[12]。早期的研究一般采用甘氨酸(G)和丝氨酸(S)联合应用于表位的Linker,只是单纯地考虑氨基酸的刚柔性以及避免连接的2个肽或蛋白域的相互作用[13]。目前,最常用的柔性连接肽就是由Huston等人提出的(GGGGS)n(n≤6)序列,通过调整重复数n来优化连接肽的长度,使得功能域适当分开或保持域间的作用,这几乎已经成为一种“通用连接肽”[14]。在本研究中应用了GGGGS作为Linker,具有良好的柔性,从而保证了各表位之间相互独立。但是并没有尝试其他长度的组合。其他类型的Linker对串联表位重组蛋白的表达量或者抗原性是否存在影响,值得进一步研究。
ADV的VP2蛋白是其主要抗原决定簇的载体,在AD的诊断上具有较高的价值[15]。Bloom通过将VP2分成9段进行原核表达,发现位于290~525位氨基酸之间的3个抗原表位具有稳定的免疫原性[3],基于此,本研究以415~433位的表位肽为基础,设计了2、4、6、8段表位肽重复串联的串联体,预测结果表明,均无新表位产生及表位漂移,能最大限度的保有串联体各表位的抗原性。经大肠杆菌系统诱导表达,结果3个串联体均以可溶性形式获得了高效表达,且重组蛋白PP8的表达量最高,经Ni-NTA亲和层析柱纯化后获得了纯度高达95%的重组蛋白,而PP2未能成功表达,可能是由于短肽太小,难以表达。Western Blot和CIEP均证明重组蛋白串联体可被ADV抗体特异性识别,具有良好的抗原性;经ELISA分析比较各重组蛋白的抗原性,表明重组蛋白PP8的抗原性最强。虽然我们在PP4、PP6和PP8的抗原性比较分析中发现,表位密度越大抗原性越强,但本研究最多只串联了8段表位肽,更多表位肽的串联是否会进一步提高抗原性,还有待深入研究。
因此,本研究以不同密度抗原表位串联表达,分析比较其抗原性,在建立ADV感染的血清学检测方法中具有重要意义,也为多表位疫苗的研究提供了科学依据。


