10株广西猪圆环病毒3型(PCV3)全基因组序列的遗传变异分析
卢冰霞,刘 磊,周英宁,何 颖,秦毅斌,段群棚,李 斌,陈忠伟,梁家幸,苏乾莲,闭炳芬,蒋冬福,卢敬专,杨思仪,赵 武
(广西兽医研究所 广西兽医生物技术重点实验室,广西 南宁 530001)
猪圆环病毒(Porcine circovirus,PCV)为一种共价闭合、单股环状DNA病毒,是迄今发现的最小的动物病毒[1]。2015年前,全球范围内仅发现PCV1和PCV2两个基因型[2]。其中,PCV1被认为对猪无致病性[3],但PCV2能引起多种猪圆环病毒相关疾病(PCVAD),主要有断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎和肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)、繁殖障碍、增生性坏死性肺炎(PNP)和肠炎等[4]。临床上PCV2常与猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)和猪肺炎支原体(M.hyo)等病原体混合感染。同时,感染PCV2后还容易继发细菌感染,给养猪业造成巨大的经济损失。
2015年6月,美国北卡罗来纳州某商品化猪场暴发PDNS疫情。Palinski等[5]借助新一代测序(NGS)技术,从患病母猪及流产胎儿体内首次鉴定出PCV3。作为新动物病原体,PCV3对猪的致病性、其在PCVAD中的作用以及现有商品化PCV2疫苗对其免疫效果等,均有待进一步研究。
目前已有PCV3在美国、韩国、巴西、意大利、波兰以及中国的华南、华中和华北多省市流行的报道[5]。养猪业是广西的支柱产业之一,近年来PCV2一直严重威胁广西养猪业的健康发展,PCV3的出现使猪圆环病毒病更加复杂化,且对广西PCV3的分子流行病学的研究资料尚不多。因此,本试验对广西地区流行的PCV3全基因组进行克隆和遗传进化分析,旨在了解广西猪群PCV3的遗传变异情况,丰富广西PCV3的分子流行病学资料,从而为有效防控PCV3的发生与流行提供参考。
1 材料与方法
1.1 毒株来源 10株广西PCV3阳性样品(CHGX1776D-2017、CHGX1948-2018、CHGX1963A-2018、CHGX2031-2018、CHGX2051A-2018、CHGX2192A-2018、CHGX2242-2018、CHGX2246-2018、CHGX2248-2018和CHGX2275A-2018)均由本实验室从发病猪内脏中鉴定并保存。
1.2 主要试剂 病毒基因组DNA/RNA快速抽提试剂盒为Axygen生物科技有限公司产品;2×F8 Fastlong PCR Master Mix为北京艾德莱生物科技有限公司产品;DL-2 000 DNA Marker为宝生物工程(大连)有限公司产品;其他试剂均为分析纯。
1.3 引物的设计与合成 根据GenBank上登录的PCV3的全基因组序列,利用MegAlign(DNA-STAR),Primer Premier 7.0 软件设计合成覆盖PCV3全基因组的2对特异性引物PCV3 A-F/ PCV3 A-R和PCV3 B-F/PCV3 B-R。PCV3 A片段上游引物PCV3 A-F:5′-CGGAGGGAAAGCCCGAAAC-3′,PCV3 A片段下游引物PCV3 A-R:5′-CGCCTAAACGAATGGGAAACT-3′,PCR扩增目的片段大小为1 561 bp。PCV3 B片段上游引物PCV3 B-F:5′-TTTCCGCATAAGGGTCGTCTT-3′,PCV3 B片段下游引物PCV3 B-R:5′-CAGGCATCTTCTCCGCAACT-3′,PCR扩增目的片段大小为1 020 bp。引物由宝生物工程(大连)有限公司合成。
1.4 PCV3阳性样品DNA的提取 按照AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit使用说明书进行DNA提取,所获得的DNA 用于下一步的PCR反应。
1.5 PCV3 全基因组序列的扩增及测序 PCR反应体系50 μL:灭菌水17 μL,2×F8 Fastlong PCR Master Mix 25 μL,25 μmol/L 上下游引物各1 μL,模板6.0 μL。按照下列条件进行扩增:94 ℃预变性10 min;94 ℃变性10 s,58 ℃复性10 s,72 ℃延伸10 s,40个循环;最后72 ℃延伸10 min,12 ℃保存。取扩增产物10 μL于10 g/L琼脂糖凝胶中电泳,并观察结果。将特异性扩增产物送生工生物工程(上海)股份有限公司进行序列测定。
1.6 序列分析和遗传进化树构建分析 将测序结果应用DNASTAR软件进行全基因组的编辑、拼接,并与GenBank上发表的国内外PCV3代表株进行比对分析;用MEGA 6.06软件的邻位连接法(Neighbor-Joining method)进行遗传进化分析并绘制遗传进化树。
2 结果
2.1 PCV3全基因组的PCR扩增和序列测定 运用PCR方法对10株广西PCV3阳性样品进行全基因组的分段扩增,均分别扩增出与预期大小相一致的目的片段,分别约为1 561 bp和1 020 bp,电泳结果见图1。用DNASTAR软件对测序序列进行全基因组序列的拼接,结果显示,10株广西PCV3全基因组全长均为2 000 bp。
2.2 PCV3全基因组序列测序分析 运用DNA-STAR软件将拼接好的10株广西PCV3全基因组序列与GenBank 上已发表的国内外PCV3全基因组代表株进行比较分析。结果显示,10株广西PCV3全基因组序列之间的核苷酸同源性为98.6%~99.8%(其中CHGX2031-2018和CHGX2275A-2018的核苷酸同源性为98.6%,CHGX1963A-2018和CHGX2246-2018的核苷酸同源性为99.8%)。与国内其他毒株的同源性为97.9%~99.8%;与美国毒株的同源性为98.8%~99.4%;与韩国毒株的同源性为98.8%~99.7%;与意大利毒株的同源性为98.9%~99.7%;与巴西毒株的同源性为98.8%~99.3%。
2.3 PCV3全基因组遗传进化分析 运用MEGA 6.06软件对基于PCV3全基因组序列进行遗传进化树的构建分析,结果表明,本试验所测得的7个广西PCV3毒株 CHGX2031-2018、CHGX2242-2018、CHGX2248-2018、CHGX1776D-2017、CHGX1948-2018、CHGX2051A-2018和CHGX2192A-2018与国内毒株CN/Chongqing、CN/Guangdong、CN/Shangdong、CN/Fujian、CN/Henan、CN/Anhui和CN/Jiangxi等以及美国、巴西、韩国和意大利的毒株同在PCV3a亚群;本试验得到的其他3个广西PCV3毒株(CHGX1963A-2018、CHGX2246-2018和CHGX2275A-2018)与CN/Guangdong-HZ4、SG1、GDQG1和CN/GXHJ1、GXHJ2、GXLC1、GXLJ1等部分来自广东和广西的毒株处在PCV3b亚群(见图2)。
2.4 PCV3Cap基因序列分析 测序结果分析显示,10株广西PCV3Cap基因的大小均为645 bp,编码214 aa。基因序列比对分析结果显示,10株广西PCV3Cap基因之间的核苷酸序列同源性在97.5%~99.8%,编码的氨基酸序列同源性为96.7%~100%;10株广西PCV3Cap基因与国内参考株的核苷酸序列同源性在97.2%~99.7%,编码的氨基酸序列同源性为96.7%~100%;与美国PCV3的核苷酸序列同源性在97.8%~99.5%,编码的氨基酸序列同源性为97.2%~100%;与韩国PCV3的核苷酸序列同源性在98.0%~99.7%,编码的氨基酸序列同源性为97.2%~100%;与意大利PCV3的核苷酸序列同源性在97.8%~99.7%,编码的氨基酸序列同源性为97.2%~100%;与巴西PCV3的核苷酸序列同源性在97.8%~99.4%,编码的氨基酸序列同源性为97.7%~100%。PCV3Cap基因比较保守,10株广西PCV3Cap基因与参考株相比,仅存在散在的突变位点。采用MEGA 6.06软件对PCV3Cap基因序列编码的214个氨基酸序列与其他参考株基因序列编码的氨基酸序列进行比对分析并构建系统进化树,结果显示,10株广西PCV3处于3a和3b两个亚群,只有毒株CHGX2246-2018为PCV3a亚群而基于全基因组序列构建的遗传进化树时为PCV3b亚群,利用Simplot 3.5.1软件对CHGX2246-2018进行重组分析,其与PCV3b亚群的广西分离株PCV3/CN/GXLJ2/2017 同源性最高,未发现与其他PCV3a的毒株有重组的现象。其他9株广西PCV3毒株与基于全基因组序列构建的遗传进化树结果基本相同(图2和图3)。结果表明,广西流行的PCV3至少存在2个亚群,而不同亚群PCV3毒株的致病性是否有差异还有待进一步的研究。
3 讨论
自2016年美国学者Palinski等[5]借助新一代测序(NGS)技术,从患病母猪及流产胎儿体内首次鉴定出PCV3后,包括美国、韩国、巴西、意大利和中国在内的多个国家和地区报道了猪群感染PCV3。2017年以来,我国华中、华南和华北的多个省市地区报道检测出PCV3。有学者报道,广西地区猪群也普遍存在PCV3的感染,Wen S等[6]报道广西猪群PCV3样品阳性率为37.96%。本实验室也采用PCR的方法检测广西地区猪群PCV3的感染情况,广西地区14个地市中有10个地市猪群存在PCV3感染,表明广西受检猪场猪群PCV3感染较普遍(具体数据略)。
本试验设计了2对PCV3特异性引物,以实验室鉴定并保存的PCV3阳性DNA为模版,分2段扩增 PCV3全基因组,通过拼接得到了10条PCV3的全基因组序列。将得到的10条广西PCV3全基因组序列与国内外PCV3代表毒株进行同源性比对,全基因组核苷酸同源性在97.9%~99.8%,说明当前全世界流行的PCV3相对比较保守,并没有出现大的变异。利用得到的10株广西PCV3全基因和Cap基因分别构建遗传进化树,两者结果基本一致,均表明本试验得到的10株PCV3处于PCV3a和PCV3b两个亚群,与刘相聪等[7]的研究结果一致。毒株CHGX2246-2018利用Cap基因序列构建遗传进化树时属于PCV3a亚群,而基于全基因组序列构建的遗传进化树时为PCV3b亚群,为了了解CHGX2246-2018是否是PCV3a和PCV3b两个亚群的重组毒株,利用Simplot 3.5.1软件对CHGX2246-2018进行重组分析,其与PCV3b亚群的广西分离株PCV3/CN/GXLJ2/2017 同源性最高,未发现与其他PCV3a的毒株有重组的现象,具体原因有待进一步研究分析。
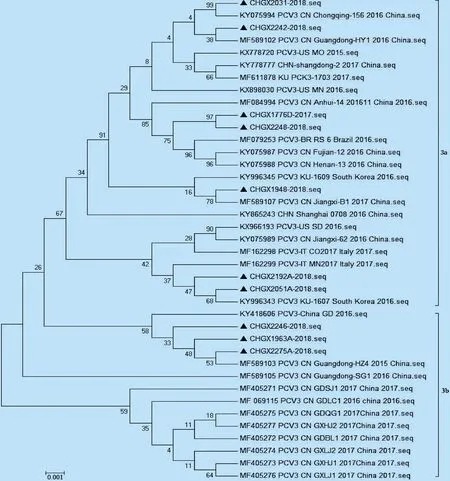
图2 基于PCV3全基因组序列遗传进化树Fig.2 Genetic evolution tree based on complete genome of PCV3 strain▲:本试验所测得的广西PCV3毒株▲:The Guangxi PCV3 strains measured by this research

图3 基于PCV3 Cap基因的遗传进化树Fig.3 Genetic evolution tree based on Cap gene of PCV3 strains▲:本试验所测得的广西PCV3毒株▲:The Guangxi PCV3 strains measured by this research
本试验结果表明,广西地区猪群中流行的PCV3至少存在2个亚群(PCV3a亚群和PCV3b亚群)共同流行,不同亚群的PCV3毒株的致病性差异还有待进一步的研究。

