地舒单抗治疗骨巨细胞瘤的卫生技术评估
芮明军 唐文熙 李洪超


摘 要 目的:評价地舒单抗治疗骨巨细胞瘤的有效性、安全性和经济性,为临床治疗和决策提供循证依据。方法:系统检索PubMed、Cochrane图书馆、ScienceDirect、中国知网、万方数据和维普网等数据库以及各国卫生技术评估(HTA)机构官网,纳入有关地舒单抗治疗成人和骨骼发育成熟的青少年骨巨细胞瘤患者的HTA报告、随机对照试验(RCT)、单臂试验以及回顾性研究,并对这些证据进行质量评估。采用描述性分析的方法描述纳入的HTA报告,使用R语言3.6.0软件对单臂临床试验和回顾性研究,进行Meta分析。结果:从49篇文献中筛选出HTA报告6篇、单臂试验5篇、回顾性研究3篇,没有RCT研究。各国的HTA报告普遍认为地舒单抗具有良好的有效性和安全性,且法国、澳大利亚等国的HTA报告认为该药具有经济性。在不可手术的骨巨细胞瘤患者中,地舒单抗可为约81%[95%CI(77%,86%)]的患者带来临床获益,完全缓解率约为14%[95%CI(10%,19%)],部分缓解率约为51%[95%CI(32%,70%)]。在可手术的骨巨细胞瘤患者中,地舒单抗可使35%[95%CI(21%,49%)]的患者免于手术,降低了40%[95%CI(36%,45%)]患者的手术分期;使用地舒单抗后,患者的术后复发率约为19%[95%CI(7%,35%)],术后中位复发时间约为6.73个月[95%CI(3.92,9.55)]。该药3~4级或高频发作且需治疗的不良事件主要为背痛、四肢疼痛、低磷血症和颌骨坏死。结论:基于现有证据,在本研究涉及的研究和地区中,地舒单抗用于骨巨细胞瘤治疗具有良好的有效性、安全性和经济性。
关键词 地舒单抗;骨巨细胞瘤;卫生技术评估;有效性;安全性;经济性
ABSTRACT OBJECTIVE: To provide evidence-based evidence for clinical treatment and decision by evaluating efficacy, safety and cost-effectiveness of denosumab in the treatment of giant cell tumor of bone(GCTB). METHODS: Retrieved from PubMed, the Cochrane Library, ScienceDirect, CNKI, Wanfang database and VIP as well as health technology assessment (HTA) organi- zation websites, HTA reports, randomized controlled trials (RCTs), single-arm trials and retrospective studies were included about denosumab in the treatment of GCTB in the adults and adolescents with mature bone, and their qualities were evaluated. HTA reports were analyzed with descriptive analysis qualitatively; Meta-analysis was conducted for single-arm clinical studies and retrospective studies by using R version 3.6.0 software. RESULTS: Among 49 screened literatures, there were 6 HTA reports, 5 single-arm trials and 3 retrospective studies.No eligible RCTs were retrieved. HTA reports of various countries generally believed that denosumab possessed good efficacy and safety; HTA reports of France, Austrila and other contries showed that denosumab possessed economics. For the GCTB patients who was unresectable, denosumab would bring the clinical benefits to about 81% [95%CI(77%,86%)] of patients. The complete response rate and partial response rate was around 14%[95%CI(10%,19%)] and 51%[95%CI(32%,70%)], respectively. For the GCTB patients was resectable, denosumab would prevent some patients from receiving surgery (35%)[95%CI(21%,49%)] or bring surgical down staging to them (40%)[95%CI(36%,45%)],the postoperative recurrence rate after experiencing the denosumab therapy was about 19%[95%CI(7%,35%)], and median relapse time was approximately 6.73 months [95%CI(3.92,9.55)] after receiving surgery. Main grade 3-4 or high frequercy ADR requiring treatment was back pain, limbs pain, hypophosphatemia and jaw osteonecrosis. CONCLUSIONS: Based on the currently available evidence, among the studies and regions covered in this study, denosumab has favorable efficacy, safety and cost-effectiveness in the treatment of TCTB.
KEYWORDS Denosumab; Giant cell tumor of bone; Health technology assessment; Efficacy; Safety; Cost-effectiveness
骨巨细胞瘤(Giant cell tumor of bone,GCTB)是一种罕见的组织学良性但局部呈侵袭性生长的骨肿瘤[1]。该病变可能会导致严重的骨骼并发症,包括病理性骨折、疼痛、关节活动受限、神经压迫以及肿瘤细胞侵及相邻结构等[2]。在我国,GCTB的发病率占到了所有原发性骨肿瘤的11.61%,显著高于西方人群(3%~8%)[3]。GCTB好发于20~40岁的青壮年,且肿瘤细胞在妊娠期女性体内有加速生长的倾向[4]。有文献报道,在实行肿瘤刮除术后,患者的复发率约为12%~65%,肺转移发生率约为3%[5]。尽管手术之后的复发率较高,但目前手术仍然是GCTB主要的治疗方法。在某些情况下,手术切除可能会导致患者严重的骨质流失或者功能缺陷,故为了实现局部的肿瘤控制,可能需要切除患者关节或者肢体。2013年6月,第1种GCTB治疗药物地舒单抗(Denosumab)在美国上市,可用于成年和骨骼发育成熟的青少年GCTB患者。该药是一种针对破骨细胞分化因子(RANK)受体的人源化单克隆抗体。有研究表明,GCTB由表达核因子κB受体活化因子配体(RANKL)的基质细胞和表达RANK受体的破骨细胞样巨细胞组成,其发病机制是RANKL过度表达引起的肿瘤细胞生长和骨质破坏[6]。可见,RANKL途径在GCTB的发病机制中起着关键作用。而地舒单抗就是通过与RANKL结合,阻止其激活破骨细胞、破骨细胞前体细胞和破骨细胞样巨细胞表面的RANK,从而达到抑制肿瘤细胞生长和减少骨质破坏的目的。
2018年11月,地舒单抗被列入我国《第一批临床急需境外新药名单》,进入国家药品监督管理局快速审评通道[7];随后,于2019年5月获国家药品监督管理局批准,用于治疗不可手术切除或者手术切除可能导致严重功能障碍的GCTB,包括成人和骨骼发育成熟(定义为至少有1处成熟长骨且体质量≥45 kg)的青少年患者[8]。我国《骨巨细胞瘤临床循证诊疗指南》[9]和《中国骨巨细胞瘤临床诊疗指南》[10]均推荐将其用于GCTB的治疗。
卫生技术评估(Health technology assessment,HTA)是一种广泛应用于医疗卫生政策制定过程中的决策评估方法。HTA是在对卫生技术给卫生系统和患者健康带来的长期和短期影响进行科学研究的基础上开展的评估,主要通过系统收集、分析和解释数据,对包括有效性、安全性、患者报告产出(Patient-reported outcome,PRO)、实际治疗效果(Real world effectiveness)、成本-效果(Cost-effectiveness)、社会、法律、伦理以及政治影响等进行总结,并转化成与卫生决策相关的信息[11]。本研究旨在通过对地舒单抗治疗GCTB进行HTA评估,为我国地舒单抗的临床应用和相关决策提供参考。
1 资料与方法
1.1 检索策略
以“Denosumab[Abstract/Title] and Giant cell tumor of bone[Abstract/Title]”为检索式在PubMed、Cochrane圖书馆、ScienceDirect等数据库中进行检索;以“地舒单抗”作为主题词在中国知网、万方数据和维普网等数据库中进行精确检索。检索时间均为各数据库建库起至2020年3月27日。HTA报告语种不限,其余文献限制为中英文。
1.2 纳入与排除标准
1.2.1 研究对象
成人和骨骼发育成熟的青少年GCTB患者。
1.2.2 干预措施
试验组患者采用地舒单抗治疗;对照组患者采用唑来膦酸等药物及支持治疗。
1.2.3 结局指标
有效性指标:对于不可手术患者,有效性指标包括①临床获益率(疼痛、活动性和功能性的改善),②完全缓解率,③部分缓解率;对于可手术患者,有效性指标则包括④手术避免率,⑤手术降期率,⑥术后复发率,⑦术后复发时间等。安全性指标:⑧背痛发生率,⑨四肢疼痛发生率,⑩低磷血症发生率,11颌骨坏死发生率等不良反应(ADR)发生率。经济性指标:成本-效果分析(Cost-effectiveness analysis,CEA)以及预算影响分析(Budget impact analysis,BIA)结果。
1.2.4 研究类型
各国HTA机构发布的HTA报告以及随机对照试验(RCT)、单臂试验、回顾性研究。
1.2.5 排除标准
研究对象为未成年GCTB患者的文献;未使用地舒单抗治疗GCTB患者的文献;会议摘要、综述和无法获取全文的文献。
1.3 数据提取
由2名研究者分别对文献的题目及摘要进行初步筛选,确定拟纳入的文献。经研究讨论对拟纳入的文献进行全文阅读并提取所需数据:对于HTA,需提取评估机构、国家、发布时间、患者人群、有效性、安全性、经济性等信息;对于RCT、单臂试验和回顾性研究,需提取作者、发表年份、患者特征、样本量、干预措施、结局指标等。
1.4 纳入文献的质量评价
对于HTA报告采用国际卫生技术评估机构网络(INAHTA)制定的HTA checklist评价其质量[12];对于单臂试验和回顾性研究采用Cochrane非随机研究方法工作组所推荐的Newcastle-Ottawa scale(NOS)量表评价其质量[13](由于本研究最终未筛选到RCT,故本文暂不列出RCT类文献的质量评价方法)。
1.5 统计学方法
采用描述性方法对纳入的HTA报告进行分类汇总。采用R语言3.6.0软件对纳入的单臂试验和回顾性研究进行Meta分析。结果以合并值及其95%置信区间(CI)表示。各研究间异质性检验采用χ2检验,若P>0.10、I 2≤50%,则认为各研究间无统计学异质性,采用固定效应模型进行合并分析;反之,则认为各研究间有统计学异质性,采用随机效应模型进行合并分析。P<0.05为差异有统计学意义。为确保数据录入及分析的准确性,由2名评价者同时进行统计分析;若2名研究者观点存在分歧,应先讨论解决;若仍不一致,则与第3名研究者共同商讨解决。
2 结果
2.1 文献检索结果
初次检索获得文献49篇,剔除重复文献并根据纳入与排除标准进行筛选,最后纳入文献14篇,其中HTA报告6篇[14-19],单臂试验5篇[20-24],回顾性研究3篇[25-27]。文献筛选流程见图1。
2.2 纳入文献的基本特征与文献质量评价结果
2.2.1 HTA报告
纳入的6篇HTA报告分别来自法国[14]、澳大利亚[15]、韩国[16]、英国威尔士[17]、英国苏格兰[18]和瑞士[19],详见表1。
在纳入的HTA报告中,英国苏格兰的HTA[18]报告质量较低,其余HTA报告的质量较高;但是,大部分报告中的经济性评价内容较少,尤其对于经济性评价的数据来源阐述不详,详见表2。
2.2.2 单臂试验和回顾性研究
纳入分析的单臂试验和回顾性研究共8篇,其中4篇[20,25-27]为近两年发表的文献,4项(3篇[20,23,26])研究的样本量较大(n>100),文献特征详见表3。所有文献在NOS量表中的“暴露队列的代表性”“暴露的确定”“研究开始时没有研究对象发生结局事件”“结局事件的评估”“为观察到结局发生,随访是否充分”“随访的完整性”等项目上均得1分,因此纳入的单臂试验和回顾性研究的NOS评价总分均为6分,研究质量均较高。
2.3 有效性
2.3.1 HTA报告
在法国HAS的HTA评估报告[14]中纳入了Thomas D等[21]以及Chawla S等[20]的研究。Thomas D等[21]的研究表明,在35名患者(另外2名患者由于数据不够,HAS认为不可以纳入分析)中有30名患者(85.71%)达到了肿瘤缓解的标准。该HTA报告认为,在上述研究[21]中,根据组织病理学和影像学结果对患者是否到达肿瘤缓解的判断标准差异很大,由于采用组织病理学评价的患者人数较少(n=20),因此该结果不可靠。Clawla S[20]的研究采用的有效性标准是入组6个月后未进行手术的患者比例,结果大多数患者在入组第6个月未进行手术(2011年为89.78%,2013年为90.66%);该研究还提到,截至2013年8月30日,在该队列的225名可评估的患者中,109名未接受手术、84名降低了预期的手术分期、26名按原计划接受了手术,另有6名患者因病情进展接受了更高等级的手术。在未接受手术的109名患者中,经地舒单抗治疗的患者有18名疾病复发或进展,而91名则经地舒单抗治疗后得以完全切除了肿瘤。但该HTA报告认为,上述研究[20]以避免手术为有效性衡量指标是值得商榷的,因为手术适应证和手术时机的选择是由研究者来判断的,这很可能会产生一定程度的偏差。
澳大利亚PBAC的HTA报告[15]也纳入了上述两项研究[20-21]结果。对于Thomas D等[21]的研究,该HTA报告认为,经过地舒单抗治疗后,患者的肿瘤缓解率高于对照组,但由于对照组本身存在一定问题(对照组为事后确定,且对照组治疗前后的影像学检查评估技术不一致),再加上对照组患者肿瘤缓解率的部分信息缺失,因此该HTA报告认为上述结果无法证明地舒单抗在GCTB患者中的疗效。对于Clawla S等[20]的研究,该HTA报告认为,此研究报道了一部分经地舒单抗治疗的患者可以免于手术,并认为这个结果可很好地说明了地舒单抗的疗效。
韩国药品效益评估委员会的HTA报告[16]主要参考了Branstetter DG等[24]的研究,并以肿瘤缓解率为主要指标。该HTA报告认为,地舒单抗是抗肿瘤药物,且没有其他能治疗GCTB的替代药物,同时单臂临床试验已证实了GCTB抑制肿瘤的效果。因此,地舒单抗在治疗GCTB上有临床必要性。
英国威尔士AWMSG的HTA报告[17]参考了Chawla S等[20]和Thomas D等[21]的两项研究,临床效果的评价指标同样为肿瘤缓解率。该HTA报告认为,虽然欧洲药品管理局重点介绍了有关地舒单抗生物学和临床意义的有利证据,例如手术次数的减少和疾病严重程度的降低等,但是由于该疾病的罕见性和研究缺乏对照,因此地舒单抗治疗GCTB的疗效证据有限。
英国苏格兰SMC的HTA报告[18]提到,由于未收到任何关于地舒单抗的审批材料,因此暂未作推荐。
瑞士BAG的HTA报告[19]除了纳入了以上两项研究[20-21]之外,还纳入了Branstetter DG等[24]的研究。该研究[24]是一项Ⅱ期临床试验(n=37),其主要终点是肿瘤缓解率,研究报道了对其中20名患者进行活检后,发现其均达到了肿瘤缓解,并且其中17名患者有其他的临床获益(比如疼痛减轻和总体情况改善);而另外17名患者由于未进行活检,因此无法评价地舒单抗是否给其带来了临床获益。
2.3.2 Meta分析
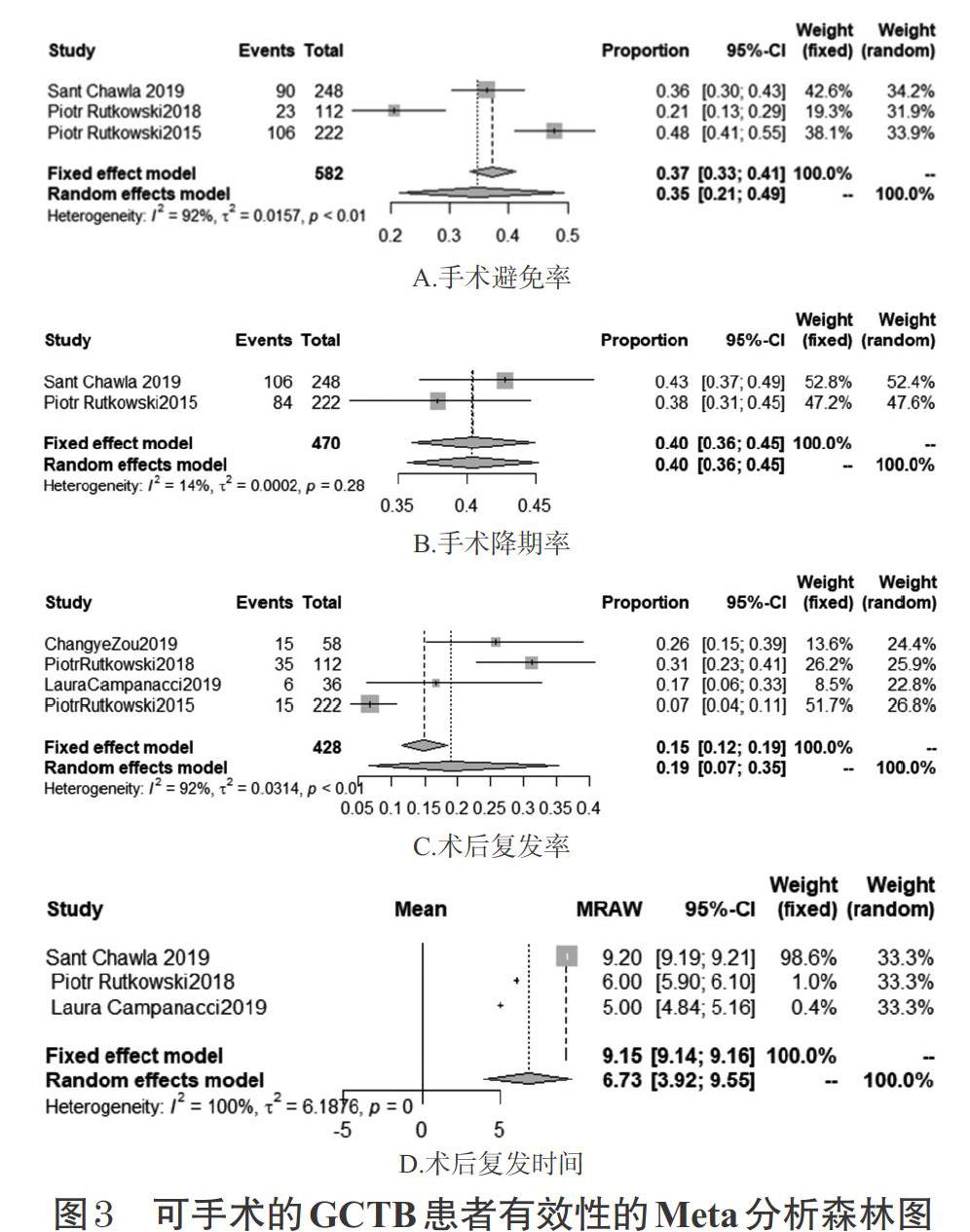
(1)不可手术的GCTB患者。有3项研究[20-21,24]报道了地舒單抗用于治疗不可手术的GCTB患者的临床获益率(疼痛、活动性和功能性的改善),各研究间无统计学异质性(P=0.61,I 2=0),采用固定效应模型进行分析,详见图2A。Meta分析结果显示,不可手术的GCTB患者使用地舒单抗后的临床获益率约为81%[95%CI(77%,86%)]。
根据澳大利亚PBAC的HTA报告[15],采用地舒单抗治疗的GCTB患者,每增加1名患者达到肿瘤缓解,增加的成本不到15 000澳元,具有经济性;由于患者人群规模较小,BIA结果表明地舒单抗纳入报销后的前5年,政府增加的净成本估计不到1 000万澳元,不会对医保财政造成过多的负担。
韩国药品效益评估委员会的HTA报告[16]认为,目前暂时没有药品可以替代地舒单抗,因此无需评价其经济性。其BIA结果表明,地舒单抗不会造成过多的公共卫生负担,但具体的预算影响由于保密措施无法读取。
英国威尔士AWMSG的HTA报告[17]没有提到经济性评价的结果;其BIA估计上市后的第1年为34 425英镑,第2年为13 770英镑,其后几年为12 240英镑。
英国苏格兰SMC的HTA报告[18]提到,由于该机构尚未就收到任何有关地舒单抗的内容,因此不对该药品作出推荐意见。
瑞士BAG的HTA报告[19]认为,地舒单抗对于骨骼完全成熟且伴有无法切除或可能会导致严重功能障碍的成年人和青少年GCTB患者的治疗是经济的,但是报告中没有提及具体的增量成本-效果比(ICER)以及BIA结果。
3 讨论
本研究系统检索了国内外关于地舒单抗治疗成人和骨骼发育成熟的青少年GCTB的有效性、安全性和经济性的研究文献,检索时限从建库起至2020年3月27日,检索数据库较全面。在对各类文献进行质量评估的基础上,分别对HTA报告、单臂试验以及回顾性研究分别进行了汇总分析,比较全面地总结了当前地舒单抗治疗GCTB的有效性、安全性与经济性方面的证据。
根据GCTB诊疗指南及文献检索结果,在地舒单抗上市以前,我国并无针对性的GCTB有效治疗药物,医疗需求迫切。因此,该药物的上市对于GCTB患者及临床均具有重要的意义,被列入我国《第一批临床急需境外新药名单》。
从有效性来看,对于不可手术的患者,地舒单抗在疼痛减轻以及活动性、功能性改善方面给81%的患者带来了临床获益,完全缓解率约为14%,部分缓解率约为51%;对于可手术治疗的患者,地舒单抗则可以使约35%的患者免于手术,约40%的患者手术分期降低,使用地舒单抗作为手术辅助治疗的患者术后的复发率约为19%,中位复发时间大约为术后6.73个月。从安全性方面来看,地舒单抗3~4级或高频发作且需要治疗的不良事件主要集中在背痛、四肢疼痛、低磷血症和颌骨坏死等方面,且发生率较低。总体来讲,各国的HTA报告普遍认为地舒单抗具有良好的有效性和安全性,并且认为在临床上没有地舒单抗的替代品。我国《地舒单抗注射液申请上市技术评估报告》[28]中也提及“两项开放标签的临床试验[20-21]证实了本品用于成人或骨骼成熟的青少年GCTB患者治疗的安全性和有效性”。
从经济性来看,目前关于地舒单抗治疗GCTB的经济性研究很少,仅有部分国家的HTA报告报道了经济性研究结果。其中,法国、澳大利亚、韩国和瑞士等国家的HTA机构都认为地舒单抗具有经济性,且不会给医保财政增加过多的负担,推荐使用地舒单抗。遗憾的是,作为国际HTA权威机构的英国国家卫生和临床技术优化研究所(NICE)以及加拿大药品与卫生技术局(CADTH)等并没有发布与地舒单抗治疗GCTB相关的经济性评估报告。
本研究也存在局限性。首先,临床证据相对较弱。由于GCTB属于罕见肿瘤,患病率低、治疗药物很少,地舒单抗治疗GCTB的临床试验数量也较少。因此,本报告只纳入了HTA报告、单臂临床试验或回顾性研究。最初纳入的唯一一项RCT文献在笔者后续重新检索时发现其已撤稿,因此未将其纳入分析。其次,经济学评价难度很高。药物经济学评价中需要以较高质量的临床疗效及安全性参数作为基础,同时需要有明确的对照干预措施的相关参数。由于地舒单抗是目前唯一被批准用于治疗GCTB的药品,缺乏合适的对照品,故开展高质量的经济学评价难度很大,因此本报告暂未能检索到高质量的经济学评价文献。
地舒单抗治疗GCTB在临床上已受广泛推荐,美国国立综合癌症网络(NCCN)《肿瘤临床指南骨肿瘤分册》[29]推荐其为首选用药,《中国骨巨细胞瘤临床诊疗指南》[10]和《骨巨细胞瘤临床循证诊疗指南》[9]也将地舒单抗作为GCTB治疗的推荐用药。我国开展的地舒单抗治疗成人和骨骼发育成熟青少年GCTB的临床研究数量很少,因此汇总其他国家或地区有关该药物有效性和安全性的研究结果对我国具有一定的参考意义。地舒单抗在我国还没有开展过药物经济学评价研究,且其他国家或地区的HTA报告中的药物经济学评价结果对我国的可参考性较弱,建议今后学者可根据我国的具体情况开展本地研究。
综上所述,地舒单抗在治療成人和骨骼发育成熟的青少年GCTB上具有良好的有效性、安全性和经济性,尽管现有研究证据的数量较少,但本研究可反映出地舒单抗可在一定程度上弥补了患者迫切的治疗需求。
参考文献
[ 1 ] GITELIS S. Bone and soft tissue tumors:clinical features,imaging,pathology and treatment[J]. J Radiology,2001,83(5):801-802.
[ 2 ] CAMPANACCI M,BALDINI N,BORIANI S,et al. Giant-cell tumor of bone[J]. J Bone Joint Surg Am,1987,69(1):106-114.
[ 3 ] 刘子君,李瑞宗,刘昌茂,等.骨肿瘤及瘤样病变12 404例病理统计分析[J].中华骨科杂志,1986,6(3):162-169.
[ 4 ] DAHLIN DC,CALDWELL L. Giant cell tumor of bone:highlights of 407 cases[J]. Am J Roentgenol,1985,144(5):955-960.
[ 5 ] BALKE M,AHRENS H,STREITBUERGER A,et al. Tr- eatment options for recurrent giant cell tumors of bone[J]. J Cancer Res Clin,2009. DOI:10.1007/s00432-008- 0427-x.
[ 6 ] KIM Y,NIZAMI S,GOTO H,et al. Modern interpretation of giant cell tumor of bone:predominantly osteoclastogenic stromal tumor[J]. Clin Orthop Surg,2012,4(2):107- 116.
[ 7 ] 國家药品监督管理局药品审评中心.关于发布第一批临床急需境外新药名单的通知 [EB/OL].(2018-11-01)
[2020-04-29]. http://www.nmpa.gov.cn/WS04/CL2094/
337894.html.
[ 8 ] 国家药品监督管理局.地舒单抗注射液获批上市[EB/OL].(2019-05-22)[2020-04-29]. http://www.nmpa.gov.cn/WS04/CL2094/337894.html.
[ 9 ] 中国医师协会骨科医师分会骨肿瘤专业委员会,郭卫,李建民,等.骨巨细胞瘤临床循证诊疗指南[J].中华骨与关节外科杂志,2018,11(4):276-287.
[10] 中华医学会骨科学分会骨肿瘤学组.中国骨巨细胞瘤临床诊疗指南[J].中华骨科杂志,2018,38(14):833-840.
[11] DI BELLO V,TONTI G,BARLETTA G,et al. Introduction to health technology assessment[J]. J Cardiovasc Echogr,2012,22(3):99-106.
[12] HAILEY D. Toward transparency in health technology assessment:a checklist for HTA reports[J]. Int J Technol Assess,2003,19(1):1-7.
[13] MARGULIS AV,PLADEVALL M,RIERA-GUARDIA N,et al. Quality assessment of observational studies in a drug-safety systematic review,comparison of two tools:the Newcastle-Ottawa scale and the RTI item bank[J]. Clin Epidemiol,2014. DOI:10.2147/CLEP.S66677.
[14] Haute Autorité de Santé. Ommission de la transparence avis:Xgeva 120 mg,solution[R]. 2015-07-01.
[15] Public Benefits Advisory Committee. Public summary document:denosumab,solution for injection,120 mg in 1.7 mL, Xgeva?[R]. 2013-11.
[16]
[17] All Wales Therapeutics and Toxicology Centre. AWMSG secretariat assessment report:Denosumab(Xgeva?) 120 mg solution for injection[R]. 2014-09-01.
[18] Scottish Medicines Consortium. Statement of advice:Denosumab Xgeva? 120 mg solution for injection[R]. 2015- 11-06.
[19] Bundesamtfür Gesundheit. Direktionsbereich kranken-und unfallversicherung:Xgeva,Amgen[R]. 2015-11.
[20] CHAWLA S,BLAY JY,RUTKOWSKI P,et al. Denosumab in patients with giant-cell tumour of bone:a multicentre,open-label,phase 2 study[J]. Lancet Oncol,2019,20(12):1719-1729.
[21] THOMAS D,HENSHAW R,SKUBITZ K,et al. Denosumab in patients with giant-cell tumour of bone:an open-label,phase 2 study[J]. Lancet Oncol,2010,11(3):275-280.
[22] UEDA T,MORIOKA H,NISHIDA Y,et al. Objective tumor response to denosumab in patients with giant cell tumor of bone:a multicenter phase Ⅱ trial[J]. Ann Oncol,2015,26(10):2149-2154.
[23] RUTKOWSKI P,FERRARI S,GRIMER RJ,et al. Surgical downstaging in an open-label phase Ⅱ trial of denosumab in patients with giant cell tumor of bone[J]. Ann Surg Oncol,2015,22(9):2860-2868.
[24] BRANSTETTER DG,NELSON SD,MANIVEL JC,et al. Denosumab induces tumor reduction and bone formation in patients with giant-cell tumor of bone[J]. Clin Cancer Res,2012,18(16):4415-4424.
[25] CAMPANACCI L,SAMBRI A,MEDELLIN MR,et al. A new computerized tomography classification to evaluate response to Denosumab in giant cell tumors in the extremities[J]. Acta Orthop Traumato,2019,53(5):376-380.
[26] RUTKOWSKI P,GASTON L,BORKOWSKA A,et al. Denosumab treatment of inoperable or locally advanced giant cell tumor of bone-multicenter analysis outside clinical trial[J]. EJSO,2018,44(9):1384-1390.
[27] ZOU C,LIN T,WANG B,et al. Managements of giant cell tumor within the distal radius:a retrospective study of 58 cases from a single center[J]. J Bone Oncol,2019. DOI:10.1016/j.jbo.2018.100211.
[28] 國家药品监督管理局药品审评中心.地舒单抗注射液申请上市技术评审报告[R]. 2019-10.
[29] BIERMANN JS,CHOW W,REED DR,et al. NCCN guidelines insights:bone cancer,version 2:2017[J]. J Natl Compr Canc Netw,2017. DOI:10.6004/jnccn.2017.0017.
(收稿日期:2020-04-29 修回日期:2020-06-18)
(编辑:孙 冰)

