荔枝核多糖的水提醇沉工艺优化及其对α-葡萄糖苷酶的抑制活性研究
张艳秋 郑炜 刘凯青 曲文笛 冯晨曦 徐多多
摘 要 目的:優化荔枝核多糖的水提醇沉工艺,并评价其体外降糖的活性。方法:采用苯酚-硫酸比色法测定多糖含量,并计算多糖提取率。采用单因素试验和响应面法,以料液比、提取次数、提取时间为因素,多糖提取率为指标,对水提工艺进行优化;采用单因素试验对醇沉工艺中水提液的浓缩体积和醇沉浓度进行筛选,并进行验证。以阿卡波糖为对照,采用4-硝基酚-α-D-吡喃葡萄糖苷法考察荔枝核多糖对α-葡萄糖苷酶的体外抑制活性。结果:荔枝核多糖水提醇沉的最优工艺为料液比1 ∶ 19(g/mL),煎煮3次,每次1 h,水提液浓缩至原体积的40%,加乙醇醇沉至含醇量80%,经Sevage法除蛋白后得荔枝核粗多糖。3次验证试验结果显示,多糖提取率分别为7.61%、7.89%、7.99%,平均提取率为7.83%(RSD=2.52%,n=3);多糖含量分别为 55.57%、55.83%、56.66%,平均含量为56.02%(RSD=1.81%,n=3)。荔枝核多糖对α-葡萄糖苷酶的抑制活性有随浓度升高而增强的趋势,其半数抑制浓度为0.056 mg/mL,低于阳性对照阿卡波糖的0.196 mg/mL。结论:优化的荔枝核多糖水提醇沉工艺稳定、可行。荔枝核多糖对α-葡萄糖苷酶具有明显的体外抑制作用,且活性强于阿卡波糖。
关键词 荔枝核多糖;水提醇沉工艺;响应面法;单因素试验;工艺优化;α-葡萄糖苷酶
ABSTRACT OBJECTIVE: To optimize the water extraction-ethanol precipitation technology of polysaccharide from Litchi chinensis seed, and to evaluate its hypoglycemic activity in vitro. METHODS: The content of polysaccharides was determined by phenol-sulfuric acid colorimetry, and the extraction rate of polysaccharides was calculated. Single factor test and response surface methodology were used to optimize the water extraction technology with the ratio of material to liquid, extraction times and extraction time as factors, and the extraction rate of polysaccharide as index. Single factor test was used to screen the concentration volume fraction of water extract and ethanol precipitation concentration in ethanol precipitation. Validation test was also conducted. Using acarbose as control, 4-nitrophenol-α-D-glucopyranoside method was used to investigate in vitro inhibitory activity of polysaccharide from L. chinensis seed to α-glucosidase. RESULTS: The optimal technology was the ratio of material to liquid 1 ∶ 19(g/mL), decocting for 3 times, 1 h for each time, concentrating the water extract to 40% of original volume, and adding ethanol to 80% volume fraction. After deproteinization by Sevage method, the crude polysaccharide of L. chinensis seed was obtained. The results of 3 times of validation tests showed that, extraction rates of polysaccharide were 7.61%, 7.89%, 7.99%, average extraction rate was 7.83%(RSD=2.52%,n=3). The contents of polysaccharide were 55.57%, 55.83% and 56.66%, average content was 56.02%(RSD=1.81%,n=3). The inhibitory activity of the polysaccharide from L. chinensis seed to α-glucosidase were increased as concentration; its IC50 was 0.056 mg/mL, which was lower than positive control acarbose (0.196 mg/mL). CONCLUSIONS: The optimal water extraction-ethanol precipitation technology of polysaccharide from L. chinensis seed is stable and feasible. The polysaccharide from L. chinensis seed show significant in vitro inhibitory effect on α-glucosidase, which is better than that of acarbose.
KEYWORDS Polysaccharide from Litchi chinensis seed; Water extraction-ethanol precipitation technology; Response surface methodology; Single factor test; Technology optimization; α-glucosidase
荔枝核为无患子科植物荔枝(Litchi chinensis Sonn.)的干燥成熟种子,主要产于我国的华南和东南等地区,又名荔仁、荔核等。荔枝核具有行气散结、祛寒止痛的功效,主要用于治疗寒疝腹痛、睾丸肿痛[1-2]。荔枝核的化学成分主要包括糖类、蛋白质与氨基酸类、有机酸、脂肪酸类、挥发油类、黄酮类、甾体类等[3-5],其中多糖的含量约为2.85%~3.34%[6]。目前,荔枝核的研究主要集中在黄酮类[7-9]和皂苷类[10-12]成分,而有关其多糖的研究很少。多糖类化合物是中药中重要的一类活性物质,因其活性高、毒副作用小,日益受到学者的关注。已有研究表明,荔枝核多糖类化合物具有降血糖的作用[13-14]。本课题组前期从荔枝核的降糖部位中分离得到均一多糖——荔枝核多糖(Litchi seed polysaccharide,以下简称“LP”)[15]。在本研究中,笔者拟对LP的提取工艺进行优化。LP现有提取工艺包括超声波提取[16]和表面活性剂(聚山梨酯80)协同酶解辅助水解法[17]等,其中超声波提取在生产中受仪器制约;而聚山梨酯80是一种亲水性的表面活性剂,具有很强的细胞膜破坏能力以及溶血性和致敏性(组胺释放),故上述两种提取方法均不适合于大规模生产。已有研究表明,水提醇沉法为提取多糖最常用的方法[18],该法简便、易行,由于不需要额外的设备,所以提取成本较低。为此,本研究以LP提取率为指标,对其水提醇沉工艺进行优化并初步研究其体外降糖活性,为荔枝核的进一步开发利用提供参考。
1 材料
1.1 仪器
UV754型紫外-可见分光光度计(上海佑科仪器仪表有限公司);AB204-N型分析天平(北京赛多利斯仪器系统有限公司);TL-5.0型台式离心机(上海市离心机械研究所有限公司);MK3型酶标仪[热电(上海)科技仪器有限公司];DHP-9052型电热恒温培养箱(苏州江东精密仪器有限公司)。
1.2 药品与试剂
荔枝核药材(批号:20190519)购自安徽亳州药材公司,经长春中医药大学人参研究院高其品教授鉴定为无患子科植物荔枝(L. chinensis Sonn.)的干燥成熟种子;阿卡波糖对照品(批号:100808-201905,纯度:≥98%)、葡萄糖对照品(批号:110833-201908,纯度:99.9%)均购自中国食品药品检定研究院;α-葡萄糖苷酶(批号:SLBT8587)、4-硝基酚-α-D-吡喃葡萄糖苷(PNPG,批号:HY-15927)均购自美国Sigma公司;磷酸氢二钾、磷酸二氢钾、碳酸氢钠均购自北京化工厂有限责任公司;正丁醇、浓硫酸、苯酚、无水乙醇、三氯甲烷等试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 多糖含量测定方法的建立
以葡萄糖为对照,采用苯酚-硫酸比色法[19]测定多糖含量。
2.1.1 对照品溶液的制备 取干燥至恒定质量的葡萄糖对照品适量,用水稀释,制成质量浓度约为100.0 μg/mL的对照品溶液,备用。
2.1.2 供试品溶液的制备 精密称取LP干燥粉末(所制LP经干燥、粉碎,过80目筛,即得)适量,加水溶解并稀释至100 mL,混匀,分别精密吸取0.4 mL,加水定容至1.0 mL,即得質量浓度为80 μg/mL的供试品溶液,备用。
2.1.3 标准曲线的绘制 分别精密吸取“2.1.1”项下葡萄糖对照品溶液0.2、0.4、0.6、0.8、1.0 mL,加水至1.0 mL(质量分别为20.8~104 μg);加入5%苯酚溶液1.0 mL,混匀;加入浓硫酸5.0 mL,混匀;放冷至室温,以水为空白对照,采用紫外-可见分光光度计于490 nm波长处测定吸光度。以葡萄糖质量(x,μg)为横坐标、吸光度(y)为纵坐标进行线性回归,得回归方程y=0.010 5x-0.020 2(r=0.999 1),表明葡萄糖检测质量的线性范围为20.8~104 μg。
2.1.4 精密度试验 取“2.1.2”项下供试品溶液适量,按“2.1.3”项下方法自“加入5%苯酚溶液1.0 mL”起进行操作,重复测定其吸光度6次。结果,葡萄糖吸光度的RSD为0.13%(n=6),表明本方法的精密度良好。
2.1.5 稳定性试验 取“2.1.2”项下供试品溶液适量,按“2.1.3”项下方法自“加入5%苯酚溶液1.0 mL”起进行操作,并于室温放置0、3、6、9、12、24 h时测定其吸光度。结果,葡萄糖吸光度的RSD为0.87%(n=7),表明供试品溶液显色后在室温下放置24 h内稳定。
2.1.6 重复性试验 取荔枝核药材适量,共6份,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下方法自“加入5%苯酚溶液1.0 mL”起进行操作,测定葡萄糖吸光度并按标准曲线法计算多糖含量(以葡萄糖计,下同)。结果,多糖含量的RSD为1.25%(n=6),表明本方法的重复性良好。
2.1.7 加样回收率试验 取“2.1.6”项下已知质量浓度的供试品溶液适量,共6份,分别加入等质量的对照品溶液,按“2.1.3”项下方法自“加入5%苯酚溶液1.0 mL”起进行操作,测定吸光度并计算加样回收率。结果,各样品的平均加样回收率为101.07%(RSD=1.34%,n=6)。
2.2 LP提取率的计算
取所制LP适量,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下方法自“加入5%苯酚溶液1.0 mL”起进行操作,测定吸光度,按标准曲线法计算多糖含量,并计算多糖提取率:多糖提取率=[(葡萄糖质量浓度×稀释倍数×待测样品溶液体积)/样品质量]×100%。
2.3 LP水提工艺的筛选
2.3.1 单因素试验 取荔枝核药材,粉碎,精密称取粉末5.0 g,置于烧杯中,采用水煎煮法以不同料液比[1 ∶ 5、1 ∶ 10、1 ∶ 15、1 ∶ 20、1 ∶ 25,g/mL(下同)]、提取时间(0.5、1、1.5、2、2.5 h)和提取次数(1、2、3、4、5次)提取,每次仅变动1个因素,以LP提取率为指标,对各因素进行考察。(1)料液比:随提取液用量的增加,LP提取率逐渐升高;当料液比达1 ∶ 15时,LP提取率趋于稳定,详见图1A。(2)提取时间:当煎煮时间为0.5~2.5 h时,LP提取率呈波浪形变化,并于1.5 h时达到最高,详见图1B。当煎煮时间超过1.5 h后,LP提取率反而下降,这可能是由于煎煮时间过长,多糖结构被部分破坏所致。故综合考虑,本研究选择提取时间0.5、1、1.5 h 进行后续研究。(3)提取次数:当提取次数≤3次时,LP提取率随着提取次数的增加而升高;但当继续增加提取次数时,LP提取率反而略有下降,详见图1C。故综合考虑LP提取率和提取效率,本研究选择提取次数2、3、4次进行后续研究。故综合考虑,本研究选择料液比1 ∶ 10、1 ∶ 15、1 ∶ 20进行后续试验。
2.3.2 响应面试验 采用响应面法对LP的水提工艺参数进行优化。根据“2.3.1”项下单因素试验结果,选取料液比(A)、提取时间(B)、提取次数(C)为因素,以LP提取率(Y)为响应值,采用Design-Expert 8.0.6软件设计3因素3水平响应面试验。因素与水平见表1,试验方案与结果见表2。
由表3中总模型的P值(P<0.000 1)可知,该模型的拟合度良好;决定系数(R 2)为0.699 0,调整决定系数(R 2Adj)为0.940 5,提示94.05%的LP提取率变化可用该模型解释;失拟项的P值为0.157 9,表明失拟项不显著,故可用该模型预测荔枝核的LP提取率。由各因素的F值可知,其对LP提取率的影响大小为:B>C>A;由各一次项、交互项、二次项的P值可知,A、B、C、AC、BC、A2、B2、C2对LP提取率的影响均有统计学意义(P<0.05)。
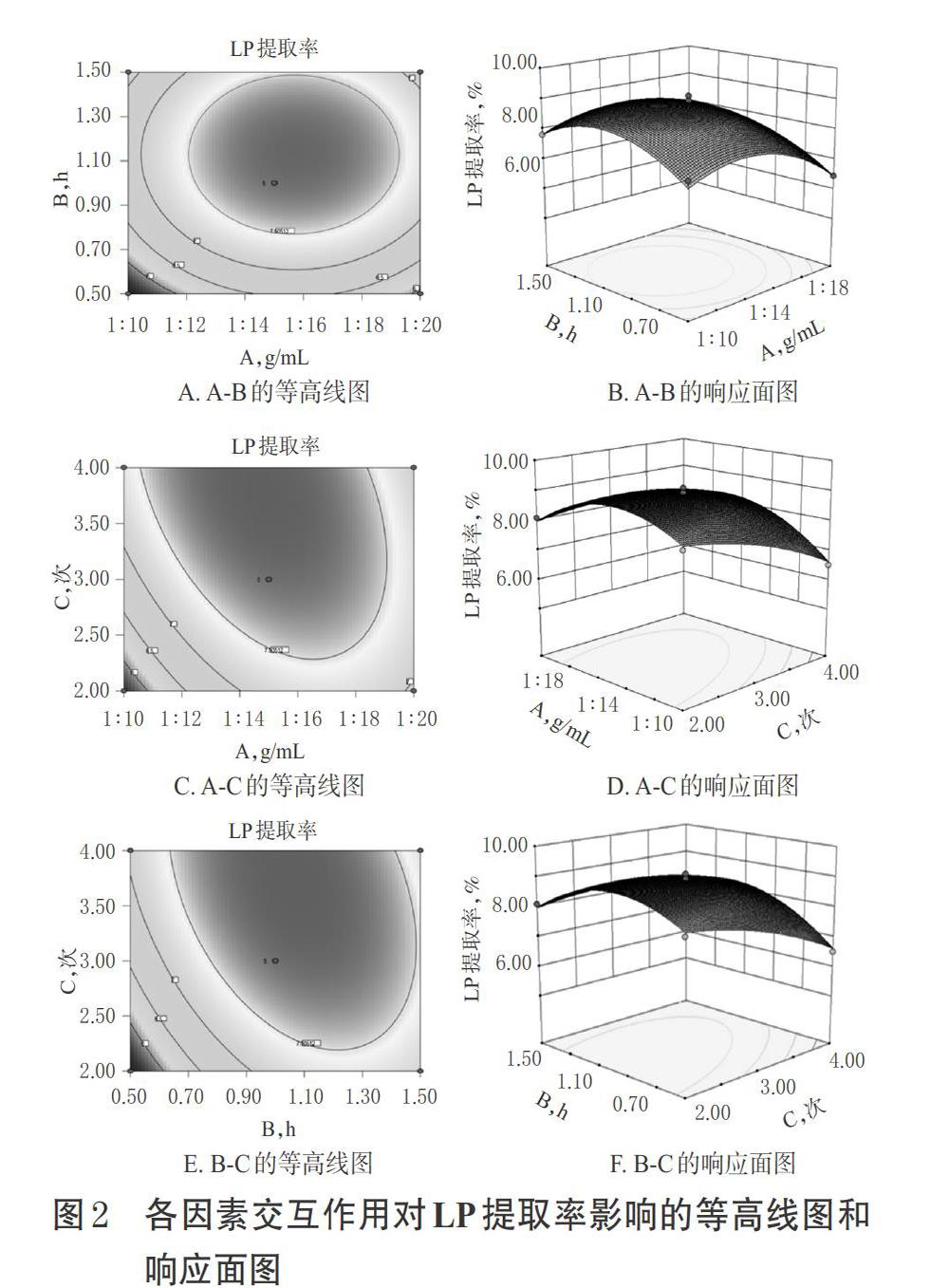
为进一步评价A、B、C之间的交互作用对荔枝核的LP提取率的影响并确定各因素的最佳水平范围,本研究采用Design-Expert 8.0.6软件绘制等高线图和响应面图,结果见图2。
由图2可见,在料液比、提取时间和提取次数所选范围内均存在极值,即存在响应面最高点,交互作用较为明显。求解二次多元回归方程,得LP的最优提取工艺为料液比1 ∶ 19.03、提取时间1.13 h、提取次数3.01次,预测LP提取率为7.57%。考虑到实际操作的方便性及可行性,故将最优水提工艺设定为料液比1 ∶ 19(g/mL)、提取时间1 h,提取次数3次。
2.3.3 验证试验 精密称取荔枝核药材各1 000 g,按“2.3.2”项下最优工艺平行操作3次,按“2.2”项下方法计算LP提取率。结果,荔枝核水提液的LP提取率分别为7.56%、7.60%、7.67%(RSD= 0.73%,n=3),平均提取率为7.61%,与预测值接近,提示该工艺可行。
2.4 LP醇沉工艺的筛选
影响醇沉的主要因素有水提液浓缩体积、醇沉浓度、离心条件(时间和转速),但由于离心转数和离心时间可根据样品数量及时调整,故暂不进行优化,其余两个因素采用单因素试验进行筛选。
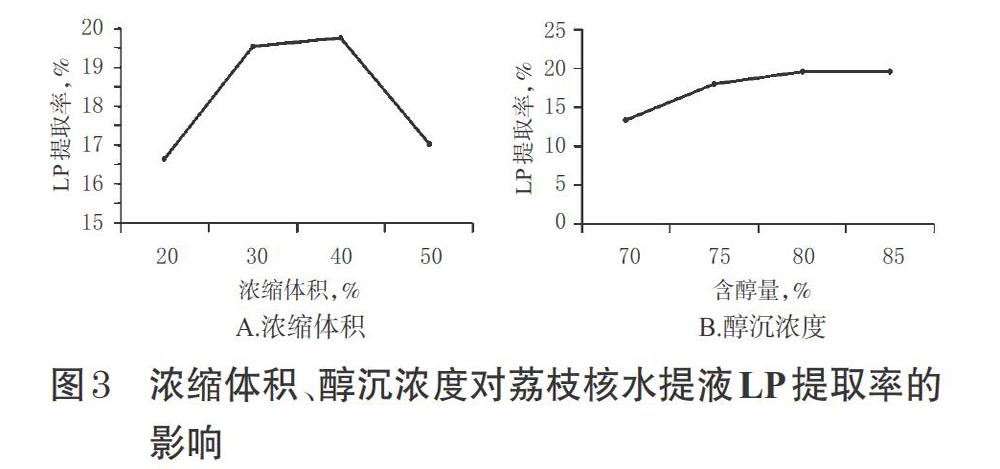
2.4.1 水提液浓缩体积 按“2.3.2”项下最优工艺制得荔枝核水提液,均分为4份,分别浓縮至原体积的20%、30%、40%、50%后,均加乙醇醇沉至含醇量80%,静置,以4 000 r/min离心10 min,取沉淀,干燥,按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下方法计算LP提取率。结果,当浓缩至原体积的30%~40%时,LP提取率较高,详见图3A。综合考虑乙醇消耗量和LP提取率,本研究最终选择将水提液浓缩至原体积的40%。
2.4.2 醇沉浓度 按“2.4.1”项下方法将荔枝核水提液浓缩至原体积的40%后,依次加乙醇醇沉至含醇量70%、75%、80%、85%,静置,以4 000 r/min离心10 min,取沉淀,干燥,按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下方法计算LP提取率。结果,随着醇沉浓度的提高,LP提取率也随之升高;当醇沉至80%时,再提高醇沉浓度,LP提取率基本没有变化详见图3B。故为了节约溶剂,本研究最终选择醇沉至含醇量的80%。
2.5 Sevage除蛋白
参照刘子健等[20]报道的除蛋白方法,取荔枝核药材适量,按“2.3”“2.4”项下最优条件水提醇沉后,干燥至恒定质量,用水稀释制成质量浓度为5 mg/mL的水溶液,与Sevage试剂(氯仿-正丁醇=4 ∶ 1,V/V)混合(LP水溶液-Sevage试剂=5 ∶ 1,V/V),振荡,静置,回收下层Sevage试剂,将剩余的药液和析出物以5 000 r/min离心10 min,再加入上清液体积1/5的Sevage试剂,重复上述操作3次,收集上清液,冻干,即得除蛋白后的粗多糖。
2.6 工艺验证
取荔枝核药材1 000 g,共3份,按“2.3”项下最优工艺用水提取,将水提液浓缩至原体积的40%后,用乙醇进行80%醇沉,再按“2.5”项下方法除蛋白后,按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下方法计算LP提取率。结果,3次验证试验的LP提取率分别为7.61%、7.89%、 7.99%,平均提取率为7.83%(RSD=2.52%,n=3);3次验证试验的LP含量分别为 55.57%、55.83%、56.66%,平均含量为56.02%(RSD=1.81%,n=3),提示该工艺稳定、可行。
2.7 LP对α-葡萄糖苷酶的抑制活性
采用PNPG法进行考察。
2.7.1 溶液的制备 (1)磷酸盐缓冲溶液(PBS):取一定量磷酸氢二钾、磷酸二氢钾,用水制成pH为6.8的缓冲溶液。(2)样品测定溶液:取一定量粗多糖固体粉末,用PBS制成质量浓度分别为 1.0、0.5、0.25、0.1、0.01 mg/mL的溶液(以葡萄糖计)。(3)阳性测定溶液:取一定量阿卡波糖,用PBS制成质量浓度分别为 1.0、0.5、0.25、0.1、0.01 mg/mL的溶液。(4)α-葡萄糖苷酶溶液:取一定量α-葡萄糖苷酶,用PBS制成浓度为 0.04 U/mL的溶液。(5)PNPG溶液:取一定量 PNPG,用PBS制成浓度为0.5 mmol/L的溶液。(6)碳酸氢钠溶液:取一定量碳酸氢钠,用水制成pH为9.8的水溶液。
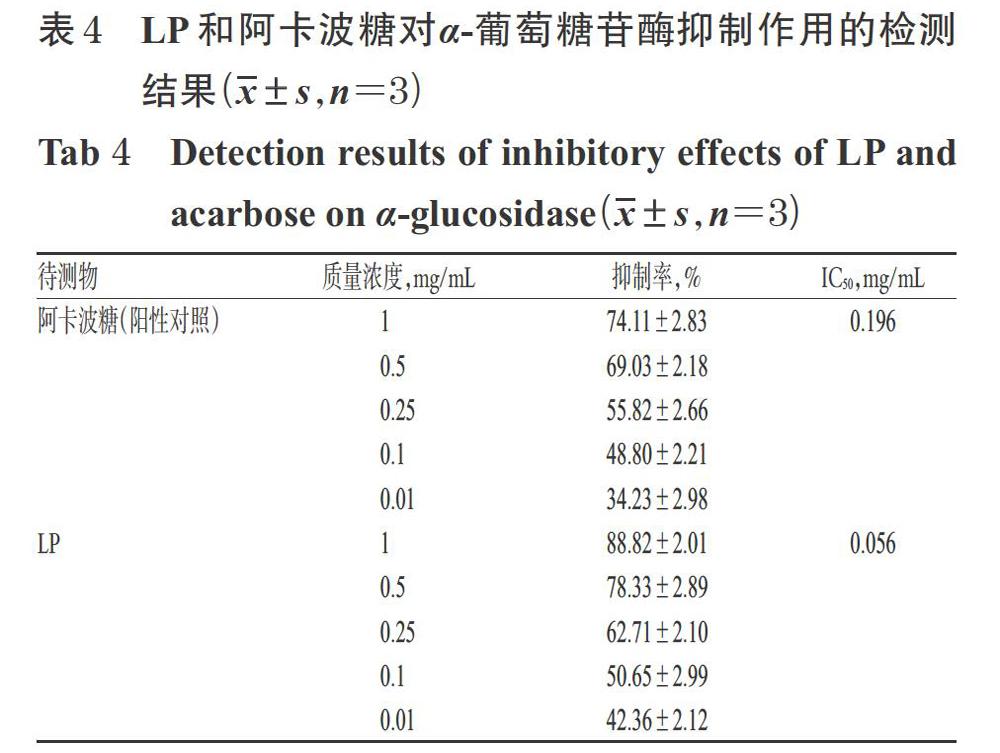
2.7.2 测定方法与结果 取“2.7.1”项下样品测定溶液、阳性测定溶液各40 μL至96孔板中,加入0.04 U/mL的α-葡萄糖苷酶溶液40 μL,混匀,于37 ℃孵育5 min;加入0.5 mmol/L的PNPG溶液20 μL,混匀,于37 ℃孵育30 min;加入0.1 mol/L的碳酸氢钠溶液100 μL终止反应(此时反应总体积达200 μL)。以PBS 40 μL为空白对照,以PBS 40 μL代替α-葡萄糖苷酶溶液作为检测背景以消除检测误差,使用酶标仪于405 nm波长处检测各孔的光密度(OD),每个样品重复3次,计算抑制率和半数抑制浓度(IC50)。抑制率=[OD空白对照-(OD检测样品-OD检测背景)/OD空白对照]×100%。结果,LP的IC50为0.056 mg/mL,阿卡波糖(阳性对照)的IC50为0.196 mg/mL,详见表4。
3 讨论
本研究采用响应面法优化了LP的水提工艺。响应面法是工艺优化的常用方法之一,相比于传统的正交设计,前者得到的回归方程精度更高,并可评价各因素的交互作用[21]。为此,本研究采用响应面法,以料液比、提取时间、提取次数为考察因素,以LP提取率为评价指标,对LP水提工艺进行优化。结果显示,响应面试验所得回归方程模型拟合良好。在所选的各因素水平范围内,提取时间对LP提取率的影响最大,提取次数的影响次之,料液比的影响最小;料液比、提取时间和提取次数有显著的交互作用。优化后的最优LP水提取条件为料液比1 ∶ 19(g/mL)、提取时间1 h、提取3次,预测多糖提取率为7.57%。水提取工艺的3次验证试验结果显示,平均LP提取率为7.61%,与预测值接近,提示该水提取工艺可行。
本研究进一步采用单因素试验法考察了LP的醇沉工艺,以水提液浓缩体积、醇沉浓度为考察因素,以LP提取率为评价指标,对LP醇沉工艺进行优化。结果,浓縮至原体积的40%、乙醇醇沉至含醇量的80%为最优醇沉工艺。
本研究采用Sevage 法沉淀蛋白纯化LP。虽然,水提醇沉可以获得较多的LP,但是纯化粗多糖的效果不佳;Sevage 法可以进一步纯化多糖,且条件比较温和,可较好地避免多糖降解[22]。由于本法实为萃取,在操作中有可能会出现乳化现象,造成多糖损失、含量偏低,故后续还需考察蛋白的除去率等。
本研究对所得最优水提醇沉工艺进行了验证。3次验证试验结果显示,平均LP提取率为7.83%(RSD=2.52%,n=3);所得平均LP含量为56.02%(RSD=1.81%,n=3),表明该水提醇沉工艺稳定、可行。
本研究进一步考察了LP对α-葡萄糖苷酶的体外抑制活性。α-葡萄糖苷酶是一种存在于小肠绒毛黏膜细胞刷状缘的酶,可将机体摄取的糖类物质水解成葡萄糖。若能竞争性抑制该酶的活性,就可以抑制糖的水解,从而降低餐后血糖,与口服降糖药物的作用机制相符[23]。本研究结果显示,当质量浓度≥0.01 mg/mL时,LP对α-葡萄糖苷酶的抑制率均略高于同质量浓度的阳性对照,其IC50值(0.056 mg/mL)低于阳性对照(0.196 mg/mL)。这提示LP对α-葡萄糖苷酶具有一定的体外抑制作用且活性强于阿卡波糖,并初步评价了其体外降糖活性。
综上所述,本研究筛选了LP的最优水提醇沉工艺,为其开发利用提供了理论参考。本研究不足在于提取多糖的同时也会使物料中的其他水溶性成分溶出,且多糖长期存放常会变质;此外,虽然α-葡萄糖苷酶的体外抑制活性提示LP是荔枝核降糖作用的有效物质,但还有待于药理学研究的进一步确认。
参考文献
[ 1 ] 陈衍斌,武可泗,顾宜,等.荔枝核化学成分及药理研究概况[J].中国中医药信息杂志,2007,14(5):97-98.
[ 2 ] 张菊艳,张萃.荔枝核化学成分及其药理作用的研究进展[J].广东药学院学报,2014,30(6):792-797.
[ 3 ] 郭洁文,潘竞锵.荔枝和荔枝核的化学成分、生物活性及药理作用研究[J].中国新药杂志,2006,15(8):585-588.
[ 4 ] 郑琳颖,韩超,潘竞锵.荔枝核的化学、药理和临床研究概况[J].中医药学报,1998(5):51-53.
[ 5 ] 黄雪松,陈杰.测定荔枝核中的游离氨基酸[J].氨基酸和生物资源,2007,29(2):11-14.
[ 6 ] 陆志科,黎深.荔枝核活性成分分析及其提取物抗氧化性能研究[J].食品科学,2009,30(23):110-113
[ 7 ] 罗伟生,龚受基,梁荣感,等.荔枝核黄酮类化合物体外抗流感病毒作用的研究[J].中国中药杂志,2006,31(16):1379-1380.
[ 8 ] 张夏,罗伟生,张扬武,等.大黄蒽醌联合荔枝核黄酮干预SIV/CEMx174细胞的蛋白组学研究[J].辽宁中医杂志,2019,46(1):111-115.
[ 9 ] REN S,XU D,PAN Z,et al. Two flavanone compounds from litchi(Litchi chinensis Sonn.)seeds,one previously unreported,and appraisal of their α-glucosidase inhibitory activities[J]. Food Chem,2011,127(4):1760-1763.
[10] 郭洁文,廖惠芳,潘竞锵,等.荔枝核皂苷改善高脂血症-脂肪肝大鼠胰岛素抵抗作用的机制研究[J].中国药房,2005,16(10):732-734.
[11] 林妮,邱玉文,官娜.荔枝核皂苷对乳腺增生大鼠雌激素受体ERα、ERβ及ERK、VEGF表达的影响[J].中药材,2016,39(3):659-662.
[12] 郭洁文,廖惠芳,潘竞锵,等.荔枝核皂苷改善地塞米松致大鼠胰岛素抵抗作用机制研究[J].中国药房,2004,15(12):719-720.
[13] WU JJ,XU YB,LIU XY,et al. Isolation and structural characterization of a non-competitive α-glucosidase inhibitory polysaccharide from the seeds of Litchi chinensis Sonn[J]. Int J Biol Macromol,2020. DOI:10.1016/j.ijbiomac.2019.11.170.
[14] 袁紅.荔枝核多糖提取物对四氧嘧啶致糖尿病小鼠降糖作用[J].健康研究,2010,30(4):252-255.
[15] 郭放.荔枝核多糖降糖活性部位的化学结构研究[D].长春:长春中医药大学,2012.
[16] 李珊,梁俭,冯群,等.香荔核多糖超声波辅助提取工艺的响应面优化及抗氧化性研究[J].食品研究与开发,2018,39(23):24-30.
[17] 韩淑琴,吴丽.表面活性剂协同酶解辅助水提荔枝核多糖[J].食品科技,2017,42(1):203-207.
[18] 董汝晶.多糖提取方法的研究进展[J].农产品加工(学刊),2014(4):46-48、51.
[19] DUBOIS M,GILLES KA,HAMILTON JK,et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem,1956,28(3):350-356.
[20] 刘子健,岳玲. Sevage法纯化紫菜粗多糖的工艺研究[J].吉林农业,2018(11):54-55.
[21] 程敬丽,郑敏,楼建晴.常见的试验优化设计方法对比[J].实验室研究与探索,2012,31(7):19-23.
[22] 杨明康.肝素前体多糖的分离纯化研究[D].杭州:浙江工业大学,2013.
[23] 段玉书,胡永,杨万霞,等.黔产青钱柳化学成分及α-葡萄糖苷酶抑制活性研究[J].天然产物研究与开发,2019,31(6):940-945.
(收稿日期:2020-03-06 修回日期:2020-07-15)
(编辑:邹丽娟)

